Дипломная работа химические методы стандартизации сердечных гликозидов. ПОИСК ХИМИЧЕСКИХ МЕТОДОВ СТАНДАРТИЗАЦИИ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬ. башкирский государственный медицинский университет министерства здравоохранения российской федерации кашфуллина камилла ильдаровна
 Скачать 2.35 Mb. Скачать 2.35 Mb.
|
|
ГЛАВА 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 3.1 Качественный анализ сердечных гликозидов Для качественного определения сердечных гликозидов мы испробовали следующие реакции: ТСХ: Реакция Балье на определение сердечных гликозидов, которая также приводится в ГФ XIV Приготовление извлечения: 0,5 г измельчённого сырья помещают в колбу на 100 мл, заливают 50 мл 80% этанола, настаивают 24 часа. Водно-спиртовый экстракт отфильтровывают. Очистка: Водный остаток промывают в делительной воронке четырёххлористым углеродом 6 раз по 10 мл. Сердечные гликозиды извлекают смесью хлороформ-спирт (3:1) 4 раза по 10 мл. Хлороформно-спиртовый экстракт гликозидов сушат безводным сульфатом натрия и фильтруют в круглодонную колбу (на 100 мл). С полученным извлечением проводят качественные реакции. Приготовление реактива: для приготовления натрия пикрата в метаноле взвешивают 1 г пикриновой кислоты, растворяют в 50 мл метанола, добавляют 5 мл едкого натра 10%, доводят водой до 100 мл, перемешивают. Реактив используют свежий! Проведение реакции: а) Для проведения реакции подготовили систему хроматографирования хлороформ-ацетон-метанол (6:2:2). Нанесли на линию старта ранее приготовленное извлечение и поместили в систему. По достижении фронта растворителей финишной линии вынимаем пластинку и просушиваем на воздухе до исчезновения следов растворителей. Высушенную пластинку обрабатываем раствором пикрата натрия и отправляем в сушильный шкаф на 5 минут при температуре 100 градусов. На линии финиша наблюдаем слабые маленькие оранжевые пятна, что свидетельствует о наличии сердечных гликозидов в данном сырье. б) Испытаем в деле другую систему хроматографирования: этилацетат-метанол-вода (15:2:1,5). Далее проведём те же манипуляции с пластинкой. В результате на хроматограмме не были обнаружены оранжевые зоны адсорбции. Из этого можем сделать вывод, что данная система не эффективна. Результат:  Рис. Хроматограмма в системе этилацетат-метанол-вода (15:2:1,5) после обработки пикратом натрия. Не наблюдается зон адсорбции. ТСХ: Реакция с ванилином Подготовка реактива: Для получения 1% раствора ванилина взвесим 0,1 г порошка ванилина и смешаем с 10 мл 10% соляной кислоты. Перемешиваем до полного растворения. Очистка: К 1,0 г измельченного сырья (сито 180) прибавляют смесь 20 мл 50 %-ного этанола и 10 мл 10 %-ного раствора свинца ацетата, кипятят 2 мин, охлаждают и центрифугируют. Надосадочную жидкость помещают в делительную воронку и взбалтывают с 20 мл хлороформа. Если образуется стойкая эмульсия, раствор центрифугируют. Хлороформный слой отделяют и пропускают через безводный натрия сульфат. 10 мл фильтрата упаривают досуха на водяной бане. Сухой остаток растворяют в 1 мл смеси равных объемов хлороформа и метанола. [22] Проведение реакции: В систему растворителей хлороформ-метанол-толуол (8:1:1) поместили активизированную пластинку ТСХ с нанесёнными на линию старта препаратами. Когда фронт растворителей достиг 90%, пластинку вынули, просушили на воздухе, обработали 1% раствором ванилина в соляной кислоте и поместили в сушильный шкаф на 5-10 минут при температуре 100 градусов. После того как пластинку вынули из сушильного шкафа на ней можно наблюдать ряд цветных полосок, состоящих из разноцветных пятен по линии фронта. Помимо некоторых примесей, чётко наблюдались фиолетовые пятна – зоны адсорбции конваллотоксина у ландыша майского и капель Зеленина, и зелёные зоны – зоны адсорбции цимарина у горицвета весеннего и препарата Адонис-бром. По результатам экспериментов можно сделать вывод, что наиболее подходящей системой хроматографирования является система хлороформ-метанол-толуол (8:1:1) и соответствующий ей реактив 1% раствор ванилина. Результаты: 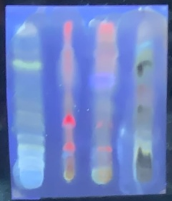 Рис. Хроматограмма в системе хлф-мет-толуол (8:1:1) до обработки ванилином в УФ-свете. Препараты слева направо: Адонис-бром, 2 – ландыша листья, 3 – капли Зеленина, 4 – трава горицвета  Рис. Хроматограмма в системе хлф-мет-толуол (8:1:1) после обработки ванилином. Препараты слева направо: Адонис-бром, 2 – ландыша листья, 3 – капли Зеленина, 4 – трава горицвета Расчёт коэффициентов подвижности. Рассчитаем коэффициенты подвижности для каждого вещества (Rf) и для каждой зоны адсорбции: 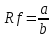 Где: а – расстояние от стартовой линии до центра пятна, исследуемого вещества; b – расстояние от стартовой линии до фронта растворителя, которое в нашем случае равно 7,8 см. Расчёт коэффициентов подвижности препаратов горицвета: Адонис-бром. Наблюдалось две зоны адсорбции зелёного цвета (цимарин): а1=5,8см а2=1,8см 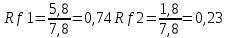 Трава горицвета. Наблюдалось две зоны адсорбции зелёного цвета (цимарин): а1=6,5см а2=1,7см 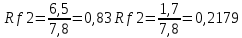 Как видно из расчётов, зоны адсорбции стандартного образца: а1 =5,8 см а3=1,8 см практически полностью совпадают с зонами адсорбции испытуемого образца: а1=6,5 см а2=1,7 см. УФ-спектры препаратов горицвета 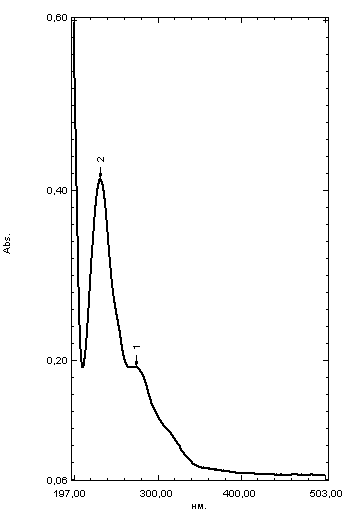    Трава горицвета УФ спектр Rf1=6,5 Адонис-бром УФ спектр Rf1=5,8   Адонис-бром УФ спектр Rf2=1,7 Трава горицвета УФ спектр Rf2=1,8 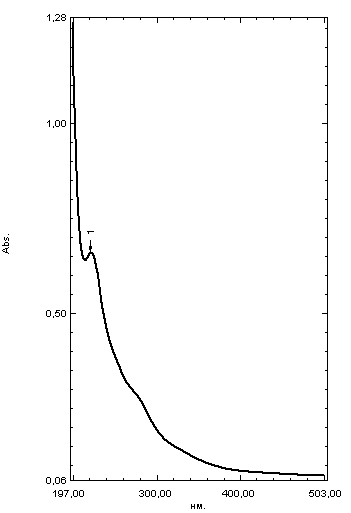 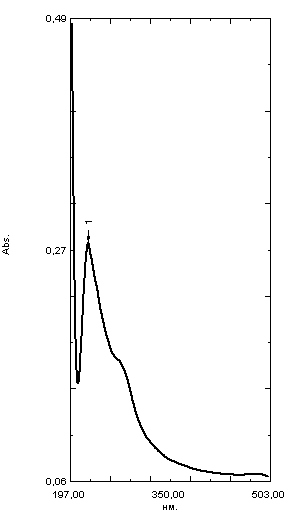 Сэлюированные образцы неокрашенной хроматограммы показали наличие сердечных гликозидов при длине волны 221 нм. Согласно справочной литературе, сердечные гликозиды определяются при длине волны примерно 220 нм. Отсюда следует вывод, что исследуемые вещества были определены верно. Расчёт коэффициентов подвижности препаратов ландыша: Капли Зеленина. Наблюдалось две зоны адсорбции фиолетового цвета (конваллятоксин): а1=5,5см а2=1,1см  Ландыша листья. Наблюдалось две зоны адсорбции фиолетового цвета (конваллятоксин): а1=5,8см а2=1,0см 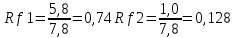 Здесь также наблюдаем, что зоны адсорбции стандартного образца: а2 =5,5 см а3=1,1 см практически полностью совпадают с зонами адсорбции испытуемого образца: а1=5,8 см а2=1,0 см. УФ-спектры препаратов ландыша   Листья ландыша УФ спектр Rf1=5,8 Капли Зеленина УФ спектр Rf1=5,5 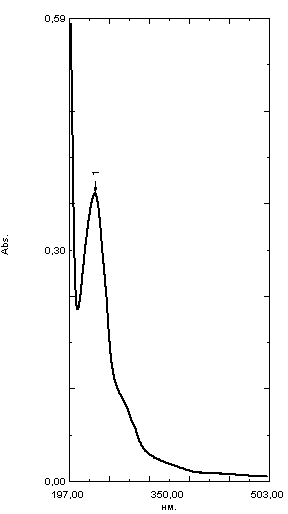 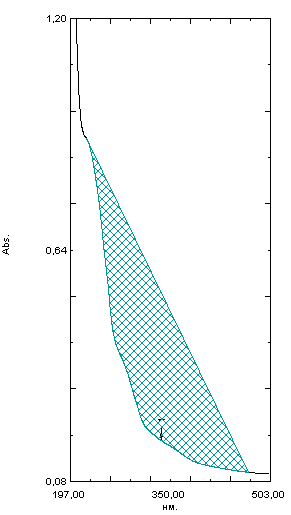   Листья ландыша УФ спектр Rf2=1,0 Капли Зеленина УФ спектр Rf2=1,1  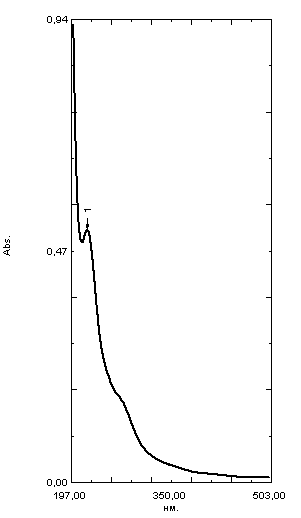 Сэлюированные образцы неокрашенной хроматограммы также показали наличие сердечных гликозидов при длине волны 221 нм. Согласно справочной литературе, сердечные гликозиды определяются при длине волны примерно 220 нм. Отсюда следует вывод, что исследуемые вещества были определены верно. ТСХ: Реакция с ванилином без предварительного очищения исследуемого раствора спирто-хлороформной смесью и выпаривания до сухого остатка. Попробуем упростить процедуру качественного определения сердечных гликозидов в ТСХ, пропустив стадию спирто-хлороформного извлечения в делительной воронке и пропускания препарата через слой безводного сульфата натрия. Для этого начнём проведение реакции сразу после приготовления извлечения. В систему растворителей хлороформ-метанол-толуол (8:1:1) также поместили активизированную пластинку ТСХ с нанесёнными на линию старта препаратами. Когда фронт растворителей достиг 90%, пластинку вынули, просушили на воздухе, обработали 1% раствором ванилина в соляной кислоте и поместили в сушильный шкаф на 5-10 минут при температуре 100 градусов. По истечении времени вынимают пластинку из сушильного шкафа. Результат:  Рис. Хроматограмма в системе хлф-мет-толуол (8:1:1) после обработки ванилином без спирто-хлороформного извлечения Препараты слева направо: Адонис-бром, 2 – ландыша листья, 3 – капли Зеленина, 4 – трава горицвета Как видно на хроматографированной пластинке практически не обнаруживается никаких зон адсорбции. ТСХ: Реакция с ванилином без предварительного очищения исследуемого раствора спирто-хлороформной смесью, но с этапом предварительного выпаривания до суха в выпарительной чаше и последующего растворения сухого остатка в смеси растворителей. Повторим данную процедуру ещё раз, но на этот раз перед тем, как нанести извлечение на линию старта, 10 мл неочищенного профильтрованного извлечения выпарим досуха на водяной бане, затем сухой остаток растворим в 1 мл смеси равных объёмов хлороформа и метанола. Затем небольшое количество полученного раствора нанесём на активизированную пластинку и повторим процедуру хроматографирования. Результат:  Рис. Хроматограмма в системе хлф-мет-толуол (8:1:1) после обработки ванилином без спирто-хлороформного извлечения, но с этапом выпаривания Препараты слева направо: Адонис-бром, 2 – ландыша листья, 3 – капли Зеленина, 4 – трава горицвета На высушенной хроматограмме наблюдаются цветные зоны адсорбции, однако, местами они выделены довольно слабо, а зоны адсорбции препарата «Адонис-бром» практически не проявились. Отсюда следует вывод, что длительная процедура спирто-хлороформного очищения препарата обеспечивает наиболее чёткую хроматограмму, по которой гораздо легче определяются зоны адсорбции. Мы попробовали сэлюировать слой хроматограммы в предположительных местах проявления сердечных гликозидов, однако по результатам элюирования сердечные гликозиды не проявились в элюируемой зоне адсорбции. Из всего вышеперечисленного следует вывод о том, что процедура очищения препарата спирто-хлороформной смесью с последующим пропусканием через безводный слой сульфата натрия даёт хорошие и гораздо более точные результаты для выявления зон адсорбции сердечных гликозидов с последующим определением коэффициентов подвижности. 3.2. Количественный анализ сердечных гликозидов 3.2.1 Количественный анализ сердечных гликозидов в листьях ландыша майского Для количественного анализа использовалась методика анализа фармакопейной статьи для настойки травы ландыша. Спектофотометрический метод. Содержание суммы сердечных гликозидов в пересчёте на конваллятоксин в 1 мл препарата должно быть от 0,104 до 0,133 мг. [4] 5,0 мл препарата помещают в выпарительную чашку, упаривают на водяной бане до приблизительно 2 мл. Объем жидкости доводят водой до первоначального объёма, прибавляют 1 мл свинца(II) ацетата раствора 10 % и тщательно перемешивают. Раствор фильтруют через бумажный складчатый фильтр в делительную воронку, фильтр промывают 5 мл воды, прибавляют 30 мл смеси спирт 95 % - хлороформ (2:8) и взбалтывают в течение 5 мин. После расслоения органическую фазу фильтруют через бумажный фильтр с 3 г натрия сульфата безводного, смоченного 5 мл хлороформа, в колбу для отгона. Операцию извлечения спирто-хлороформной смесью повторяют ещё дважды, используя по 30 мл спирто-хлороформной смеси того же состава и фильтруют спирто-хлороформное извлечение в ту же колбу для отгона. Фильтр с натрия сульфатом безводным промывают 10 мл спирто-хлороформной смеси. Полученное спирто-хлороформное извлечение отгоняют под вакуумом при 45-50 о С на роторном испарителе досуха. Сухой остаток растворяют в 10 мл спирта 25 %, затем колбу выпарительную дважды промывают 5 мл этого же спирта и раствор переносят в мерную колбу вместимостью 25 мл. Объем раствора в колбе доводят тем же спиртом до метки и перемешивают. 25 мл полученного раствора пропускают через колонку диаметром 1 см, заполненную 1,5 г полиамида для колоночной хроматографии или 5 г силикагеля для хроматографии (L 100/250) (испытуемый раствор А). В мерную колбу вместимостью 25 мл помещают 15 мл испытуемого раствора А, прибавляют 7,5 мл натрия пикрата раствора нейтрального 1 %, доводят до метки тем же растворителем и тщательно перемешивают (испытуемый раствор Б). [4] Через 10 мин измеряют оптическую плотность испытуемого раствора Б при длине волны 495 нм, в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют смесь, состоящую из 15 мл спирта 25 %, 7,5 мл натрия пикрата раствора нейтрального 1 %, и 2,5 мл натрия гидроксида раствора 2 %. Содержание суммы сердечных гликозидов в пересчёте на конваллятоксин в 1 мл препарата (Х) вычисляют по формуле: 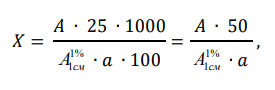 где A – оптическая плотность испытуемого раствора Б; a – объем настойки, мл (1 мл); A1%1см – удельный показатель поглощения комплекса конваллятоксина с натрия пикратом при длине волны 495 нм, равный 170; 1000 – коэффициент пересчета г в мг. [4] После измерения оптической плотности раствора мы получили следующие результаты:
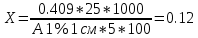 Эксперимент показал, что в испытуемом растворе содержится стандартное количество сердечных гликозидов: 0,104 ≤ 0,12 ≤ 0,133 мг. Вследствие этого можно сделать вывод, что даный метод подходит для количественного определения сердечных гликозидов в лекарственном растительном сырье. 3.2.2 Количественное определение сердечных гликозидов в готовой лекарственной форме «Коргликард» Проведём количественное определение сердечных гликозидов методом спектрофотометрии в препарате для внутривенного введения «Коргликард». Так как препарат уже является очищенным и готовым к применению, мы пропускаем процедуру спирто-хлороформного извлечения, и можем перейти к процедуре смешивания раствора с красителем. В мерную колбу вместимостью 25 мл поместим 15 мл стандартногообразца А, прибавим 7,5 мл натрия пикрата раствора нейтрального 1 %, доведём до метки тем же растворителем и тщательно перемешаемт (испытуемый раствор Б). Через 10 мин измерим оптическую плотность испытуемого раствора Б при длине волны 495 нм, в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют смесь, состоящую из 15 мл спирта 25 %, 7,5 мл натрия пикрата раствора нейтрального 1 %, и 2,5 мл натрия гидроксида раствора 2 %. При проведении измерений на спектрофотометре оптическая плотность показала отрицательные значения. Процедура измерения бы проведена пять раз с тем же отрицательным результатом. Такой результат может быть связан с тем, что для данной формы не подошёл выбранный нами краситель либо повлияли какие-то другие факторы. Данный вопрос требует больше времени для более детального и тщательного изучения. |
