Тема 20. Арены. Бензол и его производные Содержание главы
 Скачать 252.49 Kb. Скачать 252.49 Kb.
|
|
Номенклатура производных бензола Производные бензола можно рассматривать как продукты замещения атомов водорода алкильными радикалами или другими группами. Монозамещенные бензолы изомеров не имеют. 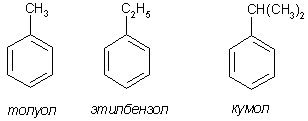 В полизамещенных наблюдается изомерия взаимного расположения заместителей в кольце. В этих случаях атомы в ядре нумеруют таким образом, чтобы старший заместитель (см. Главу Стереохимия) имел наименьший номер. Положение заместителей зачастую обозначают приставками – различают орто-, мета- и пара-дизамещенные бензолы. 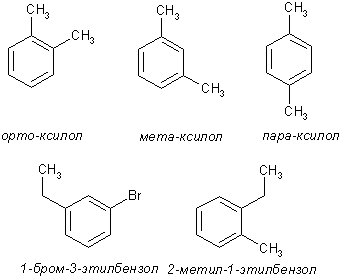 В том случае, когда монозамещенный бензол имеет принимаемое правилами IUPAC тривиальное название, оно используется как основа для названия полизамещенного соединения. 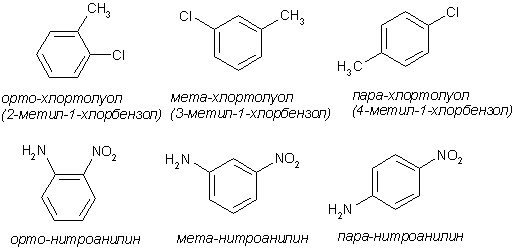 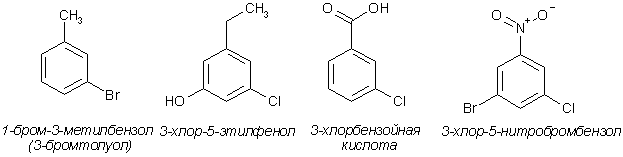 Конденсированные арены Арены подразделяются на моноциклические и полициклические, последние в свою очередь делятся на изолированные и конденсированные (аннелированные). К моноциклическим аренам относятся бензол и его гомологи. Примерами изолированных полициклических аренов являются бифенил, трифенилметан и другие соединения. 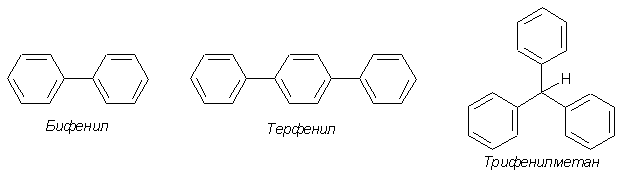 К аннелированным аренам относятся соединения, имеющие общую π-систему для нескольких ароматических ядер, например: 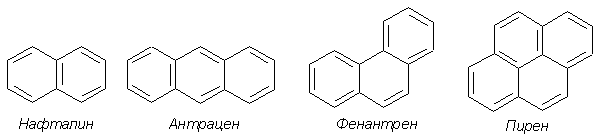 Ароматические радикалы Названия ароматических радикалов, как и алифатических, образуются с использованием суффикса –ил: для производных бензола основой является фенил (т.к. старое название бензола – фен): 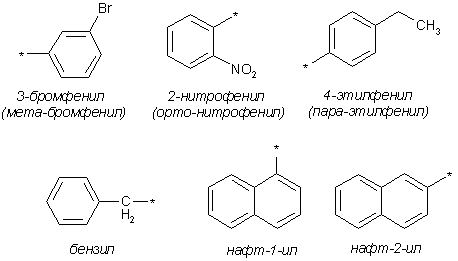 Получение производных бензола В промышленности ароматические углеводороды получают из нефти или из каменного угля, при сухой перегонке которого наряду со смолой и коксом образуется газ, в 1 м3 которого содержится около 30 г бензола. Каменноугольная смола тоже содержит производные бензола. Другим способом крупнотоннажного синтеза производных бензола является дегидрирование циклоалканов и дегидроциклизация алканов. 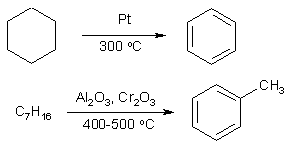 В разработке этой технологии основной вклад сделан русскими химиками – Р. Молдавским, Н. Зелинским, Б. Казанским. Ацетилены превращаются в производные бензола в процессе тримеризации при повышенной температуре в присутствии качестве катализатора активированного угля. 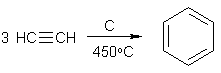 Лабораторные методы синтеза бензоидных углеводородов чаще всего сводятся к трансформации имеющихся заместителей. Так, ароматические углеводороды синтезируют восстановлением кетонов по Клемменсену или по Кижнеру-Вольфу. Первая реакция заключается в нагревании карбонильного соединения с амальгамированным цинком в кислой среде, вторая – в щелочном расщеплении соответствующего гидразона. Необходимые для этого ароматические кетоны могут быть получены посредством реакции ацилирования, например, по Фриделю-Крафтсу, действием на арен хлорангидрида карбоновой кислоты в присутствии кислот Льюиса (см. главу Свойства аренов). 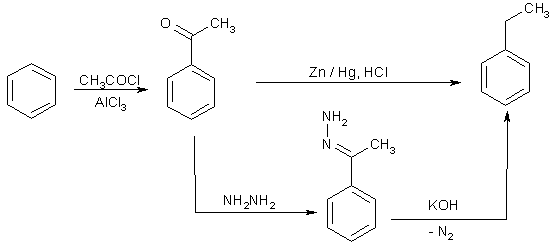 Декарбоксилирование аренкарбоновых кислот позволяет удалить заместитель из ароматического ядра, превращая соединение в углеводород. 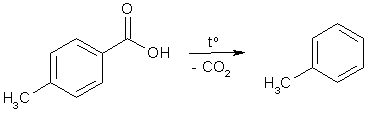 Эта реакция протекает в присутствии оксидов металлов при нагревании и облегчается, если в молекуле имеются электроноакцепторные заместители, например, нитрогруппы. Замещенные бензойные кислоты являются доступными соединениями. Их можно синтезировать различными способами, например, окислением алкилбензолов. 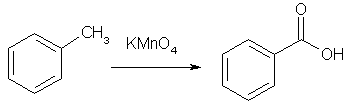 Гомологи бензола могут быть получены из бензола прямым алкилированием по Фриделю-Крафтсу. Недостаток этой реакции состоит в том, что она, во-первых, зачастую не останавливается на стадии моноалкилирования, а во-вторых, не позволяет получить алкилбензолы с линейной боковой цепью (см. главу Свойства аренов). 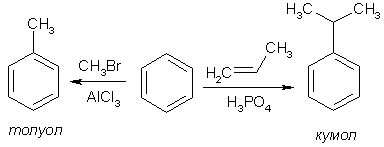 Используют так же реакцию Вюрца-Фиттига 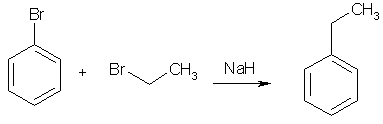 Химические свойства аренов Реакции электрофильного замещения Ранее нами были рассмотрены реакции непредельных соединений с электрофильными и нуклеофильными реагентами, приводящие в большинстве случаев к продуктам присоединения. Т.е. π-связи разрушались с образованием более прочных σ-связей (см. главы Алкены,Алкадиены, Алкины). Как было сказано выше, ароматические соединения обладают повышенной устойчивостью, которая определяется энергией π-электронной делокализации. Поэтому для них более характерны те превращения, в результате которых сопряженная циклическая π-система сохраняется, т.е. бензол и его производные преимущественно вступают в реакции замещения. Склонность тех или иных аренов к реакциям с электрофилами либо с нуклеофилами определяется, в первую очередь, π-электронной плотностью в молекуле. Для производных бензола это подразумевает наличие электронодонорных либо электроноакцепторных заместителей соответственно. Соединения первого типа (например, фенол, анилин) называют π-избыточными, а второго типа (нитробензол, бензойная кислота) – π-дефицитными. π-Избыточные арены более активны, чем бензол, в реакциях с электрофилами и меньше подвержены нуклеофильной атаке, π-дефицитные – наоборот неохотно воспринимают атаку электрофилов и более легко реагируют с нуклеофилами. Механизм реакций ароматического электрофильного замещения Характерными превращениями производных бензола являются реакции, в ходе которых происходит замещение атома водорода при углеродном атоме кольца под действием электрофила (для краткости обозначается – SE2). Менее распространены реакции электрофильного замещения функциональных групп – так называемое ипсо-замещение. Электрофилом называют частицу, имеющую вакантную орбиталь, на которую может быть принята пара электронов для образования σ-связи. По современным представлениям, реакция электрофильного замещения включает в себя два этапа. Сначала образуется π-комплекс электрофила с ароматическим кольцом, которое выступает в роли π-донора. π-Комплекс затем перерождается в катионный σ-комплекс частицу, содержащую один sp3-гибридный атом в кольце. При этом одна пара π-электронов превращается в связывающую пару новой экзоциклической σ-связи. На этой стадии ароматичность ядра разрушается, что невыгодно для соединения, т.к. требует ощутимой затраты энергии. Поэтому активационный барьер данной стадии чаще всего является максимальным на всей координате реакции, а сама стадия является лимитирующей. В отличие от σ-комплекса, возникающего в реакциях ионного присоединения к алкенам, аренониевый σ-комплекс стабилизирован посредством делокализации положительного заряда, который оказывается сосредоточенным в пара- и двух орто-положениях по отношению к реагирующему атому. Второй этап представляет собой обратный процесс – отрыв протона от σ-комплекса с образованием конечного продукта. Это – стадия ароматизации, т.е. возрождение циклической π-электронной системы, она протекает при участии противоиона электрофила или частиц среды, которые отрывают и акцептируют протон. 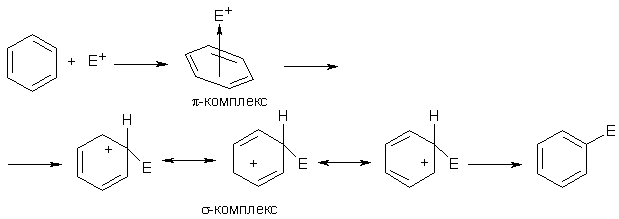 Изменения энергетики частиц в процессе замещения в кольце бензола можно представить на графике энергетического профиля реакции.  Правила ориентации электрофильного замещения под влиянием заместителей в ароматическом кольце Замещение в бензоле равновероятно происходит при любом из шести атомов углерода, т.к. полная и равномерная делокализация электронной плотности делает все атомы кольца эквивалентными. Другими словами, при монозамещении в бензоле возможно образование лишь одного продукта. Напротив, проведение реакции SE2 в бензольном кольце, уже имеющем заместитель, может привести к четырем продуктам, а именно – к орто-, мета-, пара-дизамещенным бензолам и продукту ипсо-замещения. Практика показывает, что в большинстве случаев соотношение изомеров отличается от статистического 2:2:1:1. Ипсо-электрофильное замещение в бензолах, имеющих свободные положения, вообще встречается редко, а соотношение орто-, мета- и пара-изомеров в большой степени зависит от природы заместителя. Эту зависимость называют правилами ориентации. Заместители, обладающие способностью повышать электронную плотность в бензольном кольце называют заместителями первого рода. Они ориентируют вступление электрофила в орто- и пара-положения относительно себя. Заместители, более электронодефицитные, чем водород, (заместители второго рода) направляют реакцию в мета-положения относительно себя. При этом в первом случае реакция протекает, как правило, легче, чем в бензоле, во втором – труднее. Исключение составляют галогенарены, которые реагируют преимущественно по пара-положению, но медленнее, чем бензол. Анализируя энергетический профиль реакции, можно увидеть два фактора, определяющих легкость и ориентацию замещения: а) величина энергии активации на стадии образования σ-комплекса; б) относительная стабильность σ-комплекса В связи с этим существуют два варианта объяснения причин ориентации – кинетический и энергетический. В гомологах бензола симметрия молекулы и электронная плотность на кольцевых атомах углерода нарушены из-за наличия заместителей. Происходящее перераспределение электронной плотности приводит к тому, что шесть бензольных углеродных атомов перестают быть эквивалентными. По этой же причине замещенные бензолы, в отличие от самого бензола, имеют дипольный момент. 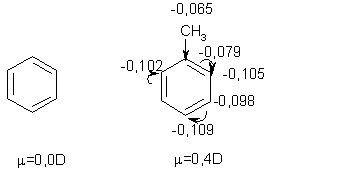 Электрофильное замещение происходит при том С-атоме, на котором сосредоточен больший отрицательный заряд, т.к. это связано с большим выигрышем в энергии. Деформации электронной системы кольца вызывают не только алкильные группы, но и другие заместители. Кинетическое объяснение ориентации требует рассмотреть характер взаимодействия заместителей с π-электронной системой ароматического кольца. Заместители первого рода в большинстве случаев обладают более высокой, чем бензольное кольцо, электронной плотностью, и поэтому проявляют электронодонорный характер. К ним относятся алкилы (+I-эффект), группы с неподеленным электронными парами: -NH2, -NR2 -OH, -OR, -O- -Cl, -Br, -I и др. (-I, +M-эффект). Мезомерные доноры обычно ориентируют более эффективно, чем индуктивные. Заместители второго рода, имея пониженную в сравнении с бензолом электронную плотность, проявляют электроноакцепторный эффект. К ним относятся группы, имеющие положительный заряд катионного типа (NR3+), или такие, в которых положительный заряд обусловлен внутренней поляризацией (-CF3, -NO2, -SO3H, -CHO, -CN, -COOH и др.). Группы – акцепторы различаются на электромерные (NR3+, SR2+ CF3), обладающие только –I – эффектом, и мезомерные, способные к сопряжению с π-системой (-I, -M – эффект). К последним относятся -N2+, -NO2, -SO3H, -CHO, -CN, -COOH. Влияние заместителей разного рода наглядно представляется набором резонансных структур для анилина и бензальдегида. 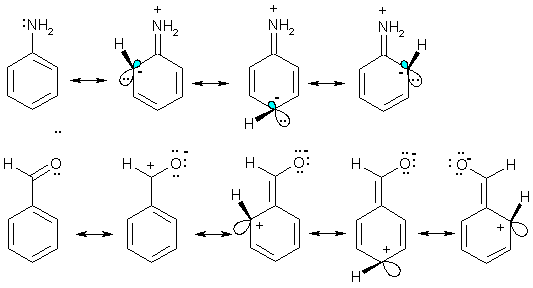 Легко видеть, что заместитель оказывает влияние на π-заряд одновременно в орто- и пара-положениях. Это положения называются сопряженными. мета-Положение не сопряжено ни с донором, ни с акцептором, поэтому влияние заместителя на него минимально. На второй стадии реакции SE2 в замещенных бензолах образование σ-комплекса происходит за счет связывания электрофила не с любым углеродным атомом, а с тем, на котором локализована бóльшая π-электронная плотность, т.е. отрицательный заряд. В этом случае энергия активации имеет меньшую величину и лимитирующая стадия реакции идет быстрее. Среди канонических структур для соединений с донорными заместителями имеются такие, в которых отрицательный заряд и пара электронов находятся на орто- и пара-углеродных атомах. Вклад этих структур в резонансный гибрид и определяет ориентацию атаки электрофила. Электроноакцепторные заместители, напротив, понижают электронную плотность преимущественно в орто- и пара-положениях и это обусловливает атаку реагента в мета-положение (положение с наименее пониженной электронной плотностью). Заметим, что снижение электронной плотности в кольце вообще затрудняет образование как π-, так и σ-комплекса (поскольку делает кольцо менее восприимчивым к атаке электрофила), т.е. замедляет любую электрофильную реакцию. Термодинамическое объяснение ориентации основано на сравнении энергии различных σ-комплексов, образования которых можно ожидать в ходе реакции. Стабильность σ-комплекса непосредственно зависит от степени делокализации в нем положительного заряда. Для соединений с донорными мезомерными заместителями она является максимальной в случае присоединении электрофила к орто- или пара-положениям, т.к. при этом в делокализации положительного заряда наряду с π-электронами бензольного кольца участвует неподеленная электронная пара самого заместителя. Резонансные структуры для σ-комплексов, которые могут образоваться в реакции анизола с бромом: 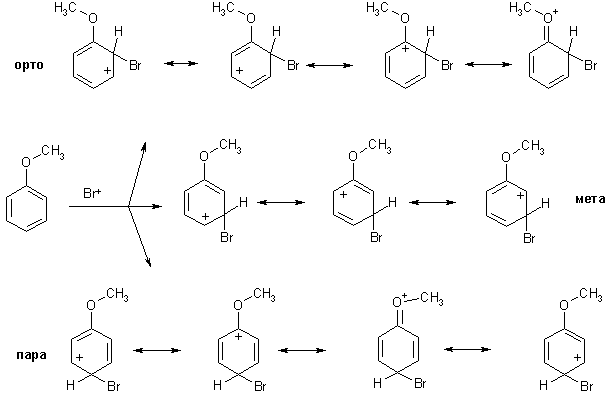 Очевидно, что орто- и пара- σ-комплексы энергетически более выгодны, чем мета-σ-комплекс, т.к. положительный заряд рассредоточен по большему количеству атомов. Электроноакцепторные заместители не участвуют в делокализации (+)-заряда в σ-комплексе и поэтому совершенно не способствуют орто- и пара-ориентации электрофила, но зато в меньшей степени «мешают» атаке электрофила в мета-положение. Резонансные структуры для σ-комплексов при нитровании бензотрифторида (соединение с электромерным заместителем второго рода) 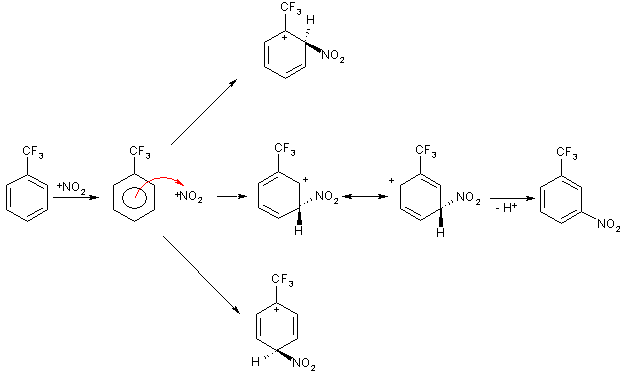 Атомы галогенов, являясь орто-, пара-ориентантами, тем не менее затрудняют реакцию. Это объясняют тем, что их сильный -I-эффект в стационарном состоянии молекулы снижает электронную плотность в кольце, что замедляет реакцию, но при образовании σ-комплекса вступает в действие +М-эффект, и галоген становится донором электронов. В тех случаях, когда в кольце бензола находится два заместителя, ориентацию замещения рекомендуют определять по следующим правилам: 1. Два заместителя одного рода ориентируют согласованно, если они находятся в мета-положении 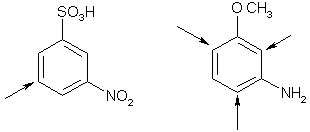 2. Два заместителя ориентируют согласованно, если они находятся в орто- или пара-положениях 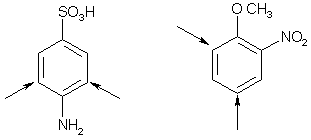 3. Когда отсутствуют условия согласованной ориентации, замещение может происходить во все свободные положения, но при этом направление в основном определяется более электронодонорным заместителем 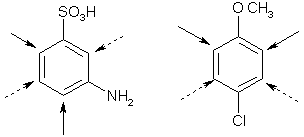 |
