Тема 20. Арены. Бензол и его производные Содержание главы
 Скачать 252.49 Kb. Скачать 252.49 Kb.
|
|
Бензол и его производные Содержание главы:
Известно, что гибридное состояние атома углерода в молекуле в большой степени определяет химическое поведение соединения. Так,алканы, образованные sp3-гибридными атомами углерода, инертны по отношению к большинству реагентов. Производные этилена имеют склонность к присоединению электрофильных реагентов и свободных радикалов, что приводит к разрушению π-связи и образованию более устойчивых σ-связей. В то же время, некоторые соединения с двойными связями способны к присоединению и нуклеофильных реагентов. Это в первую очередь относится к двойной связи α,β-непредельных альдегидов и кетонов, нитрилов, β-нитростиролов, т.е. тех соединений, в которых π-связь сопряжена с электроноакцепторной группой. Ацетилены могут присоединять как электрофильные, так и нуклеофильные реагенты. Это связано с тем, что в их молекулах одновременно присутствуют как доступные электроны π-связи, так и электроотрицательные атомы углерода. Ранее было показано, что химические свойства пространственно ненапряженных циклоалканов почти не отличаются от свойств этана, пропана и т.д. Аналогично, довольно близкую реакционную способность имеют бутадиен и циклогексадиен. Однако, поведение циклических соединений, скелет которых образован исключительно sp2-гибридными атомами, зачастую принципиально отличается от свойств их линейных аналогов. Примером соединений такого типа является бензол, а также его гомологи и производные. Своеобразие свойств этих соединений заставило выделить их в отдельный класс ароматических соединений. Происхождение этого названия связано с тем, что многие из представителей ряда имеют специфический, зачастую приятный, аромат. Строение бензола Бензол был открыт английским естествоиспытателем М. Фарадеем в 1825 году. Ему была приписана правильная формула С6Н6, однако истинное строение молекулы в течение долгого времени оставалось загадкой. Лишь в 1865 году немецкий химик Август Кекуле предложил циклическую формулу, которая представляет молекулу бензола в виде плоского шестигранника, в котором атомы углерода связаны между собой тремя одинарными и тремя двойными связями и каждый из них имеет связь с атомом водорода. 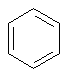 Этой формулой мы пользуемся и сейчас, хотя вкладываем в нее несколько иное содержание. Вот что написал сам Кекуле об установлении формулы бензола: "Я сидел и писал учебник, но работа продвигалась плохо, мои мысли блуждали где-то далеко. Я подвинул кресло к камину и задремал. Снова атомы запрыгали перед моими глазами. На этот раз малые группы атомов скромно оставались на заднем плане. Мой мысленный взор, обостренный повторением таких видений, мог теперь различать структуры большего размера в многочисленных конформациях, длинные цепи иногда тесно группировались, все они изгибались и поворачивались подобно змеям. Но что это? Одна из змей захватила свой собственный хвост, и эта фигура завертелась перед моими глазами, как бы посмеиваясь надо мной. Как от вспышки молнии я пробудился... Остаток ночи я провел, обдумывая следствие из моей гипотезы. Научимся мечтать и тогда, может быть, мы постигнем истину" (1865). Однако формула Кекуле не согласовывалась с данными экспериментов. Было обнаружено, например, что можно получить лишь три изомерных дизамещенных бензола. Так, при мононитровании толуола образуется смесь лишь трех соединений: орто-, мета- и пара-нитротолуолы. 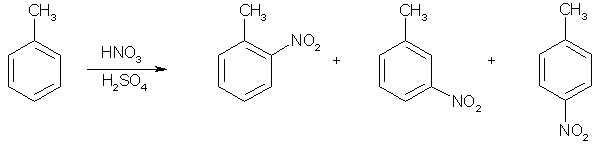 Если бы двойные и одинарные связи в бензоле можно было различить, то изомеров было бы пять: 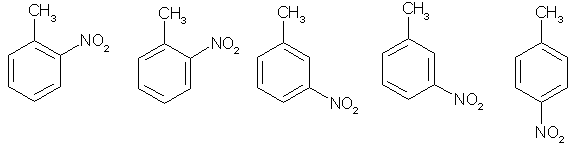 Поэтому Кекуле предложил считать, что кратные связи в молекуле бензола быстро перемещаются (осциллируют). Это утверждение подразумевает свободное перемещение π-электронов в цикле. 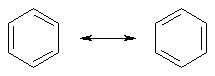 Отметим, что для объяснения строения бензола с учетом элементного состава ошибочно предлагались и другие формулы, например: 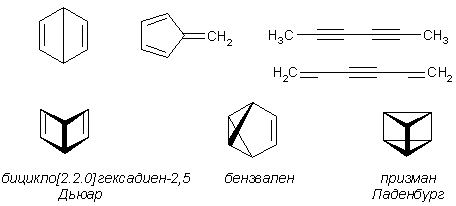 Среди этих предполагаемых структур лишь призман (бензол Ладенбурга) имеет шесть эквивалентных атомов углерода, что могло бы объяснить химическое поведение бензола. Позднее, в 20-м веке, некоторые представители указанных систем (включая призман) были получены, однако оказались весьма неустойчивыми соединениями. Атомы углерода в бензоле имеют sp2-гибридизацию, чему соответствует валентный угол 120о. Таким образом, геометрия молекулы бензола не приводит к напряжению, связанному с искажением валентных углов. Каждый С-атом образует три σ-связи и (формально) одну π-связь, для образования которой предоставляет один р-электрон. Известно, что электронные орбитали π-связей имеют способность к сопряжению. В молекуле бензола сопряжение кратных связей максимально, следствием чего является эквивалентность всех шести атомов углерода. Связывающие π-электроны в равной мере принадлежат всем шести атомам, другими словами, последние вносят по одному электрону в общую циклическую π-систему. Это явление называется делокализацией π-электронов. Длины и порядки всех шести С-С связей равны, т.е. их нельзя различить на одинарные и двойные, поэтому дипольный момент бензола равен нулю. В молекуле бензола атомы углерода образуют плоский правильный равносторонний шестиугольник с осью симметрии шестого порядка. На продолжении радиусов, проходящих через С-атомы, располагаются атомы водорода. 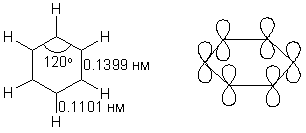 Распределение спиновой плотности в молекуле бензола можно представить как резонансный гибрид нескольких граничных структур: 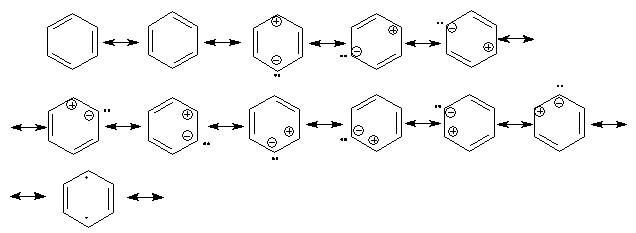 Теплота образования бензола из атомов больше суммарной энергии образования трех молекул этилена на 160 кДж/моль. Близкая величина получена также из расчетов теплот гидрирования. Так, теплота гидрирования бензола равна 206 кДж/моль, а для циклогексена эта величина составляет 119 кДж/моль. Разница составляет 3 · 119 - 206 = 151 кДж/моль. Эту разницу называют энергией π-электронной делокализации или энергией резонанса и она показывает выигрыш энергии за счет делокализации π-электронов во всей замкнутой системе. 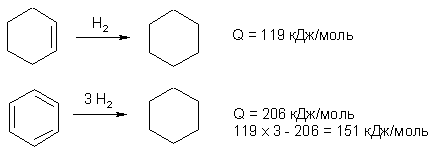 Энергия делокализации (резонанса) ER=151кДж/моль показывает, насколько ароматические молекулы устойчивее аналогичных структур с локализованными π-связями. Поэтому энергия резонанса может служить необходимым и достаточным условием ароматичности и ее количественным термодинамическим критерием. В свете сказанного молекулу бензола следует изображать в виде шестиугольника с кольцом внутри, но для удобства пользуются формулой Кекуле с двойными и одинарными связями, подразумевая при этом, что все связи выровнены. Ароматичность. Правило Хюккеля Тип ароматических систем не ограничивается соединениями, в молекулах которых содержится бензольное кольцо. В 1931 году Хюккель на основании квантовой теории определил в качестве критерия ароматичности количество π-электронов в плоской циклической сопряженной системе. Согласно правилу Хюккеля, ароматическими являются те соединения, в молекулах которых число π-электронов соответствует формуле 4n+2. Например, для бензола n = 1 (6 π-электронов), для нафталина 2 (10 π-электронов), для фенантрена и антрацена – 3 (14 π-электронов). Структуры, содержащие в цикле хотя бы один sp3-гибридный атом, ароматическими не являются, т.к. циклическое сопряжение отсутствует (исключением являются так называемые гомоароматические катионы, в которых два атома соединены формально только π-связью, а σ-связь между ними заменяется мостиком. 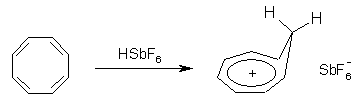 Если сопряженная циклическая система содержит количество π-электронов, подчиняющееся формуле 4n, ее называют антиароматической. Отличительной особенностью антиароматических соединений является их относительная неустойчивость. Циклооктатетраен (8 π-электронов) имеет неплоское строение (существует в конформациях ванны и кресла) и проявляет свойства полиена, т.е. циклическое сопряжение в его молекуле отсутствует. Циклобутадиен (4 π-электрона) крайне неустойчив и существует лишь при температурах близких к абсолютному нулю. Доказано, что его молекула имеет строение прямоугольника, т.е. двойные связи стремятся к минимальной степени сопряжения. Эти факты являются следствием того, что на несвязывающей МО антихюккелевских соединений имеется 2 электрона. 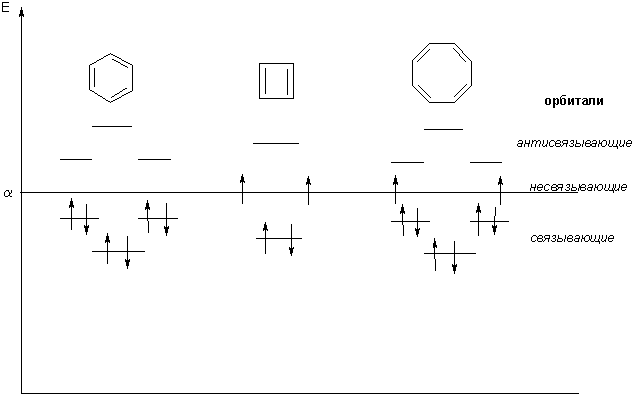 Небензоидные ароматические соединения Существуют системы с циклом, отличным от шестичленника, но удовлетворяющие Правилу Хюккеля и имеющие ароматические свойства. Так, анион циклопентадиена и катион циклогептатриенилия (тропилия) имеют 6 π-электронов (n = 1), поэтому обладают повышенной устойчивостью по сравнению с другими углеродцентрированными ионами. Эти частицы, как и бензол, имеют плоское строение и выровненные длины связей. Заряд в равной степени распределен по всем атомам цикла. Циклопентадиенил-анион проявляет нуклеофильные свойства, он может быть генерирован обработкой циклопентадиена сильными основаниями, такими как н-бутиллитий. 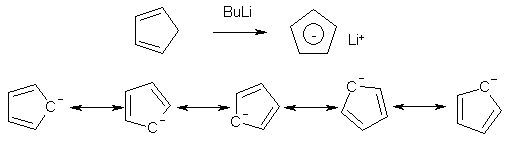 Катион тропилия образуется из циклогептатриенилбромида или циклогептатриенола в присутствии сильных кислот, содержащих ненуклеофильные (стабилизирующие) анионы, такие как перхлорат, тетрафторборат и т.д. 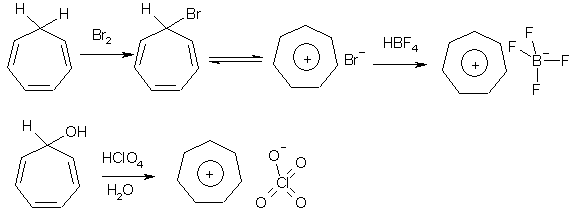 Равномерное распределение положительного заряда в кольце катиона тропилия описывается набором канонических структур. 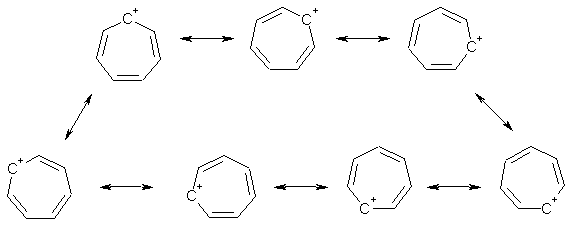 Некоторые нуклеофильные противоионы обратимо присоединяются к катиону тропилия, поэтому соответствующие соли (галогениды, роданиды и т.д.) существуют в равновесии с ковалентным аддуктом. В качестве примера небензоидного конденсированного арена можно привести азулен, в π-системе которого имеется 10 электронов (как и в нафталине). Это соединение проявляет ярко выраженные ароматические свойства. В молекуле азулена имеет место ощутимое смещениеπ-электронной плотности из семичленного в пятичленное ядро, что приводит к появлению значительного дипольного момента и голубой окраски. Можно сказать, что пятичленное ядро азулена является π-избыточным, а семичленное – π-дефицитным. Максимум электронной плотности сосредоточен в положениях 1 и 3, которые склонны к реакциям электрофильного замещения. Указанные особенности связаны с тем, что оба аннелированных цикла стремятся к ароматическому шестиэлектронному состоянию. Катион циклопропенилия отвечает правилу Хюккеля с n = 0 и числом π-электронов 2, т.е. является самой маленькой ароматической системой. Разумеется, он менее устойчив, чем тропилий-катион: дестабилизирующими факторами являются как напряжение валентных углов, так и повышенная плотность заряда. 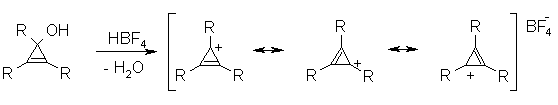 Поэтому к существованию в твердом виде способны лишь те соли циклопропенилия, катионы которых стабилизированы донорными заместителями (см. электронные эффекты – М-доноры), например, продажным реактивом является трис-изопропилтиоциклопропенилия тетрафторборат. Соли циклопропенилия проявляют свойства сильных С-электрофилов и склонны к реакциям, сопровождающимся раскрытием трехчленного цикла. 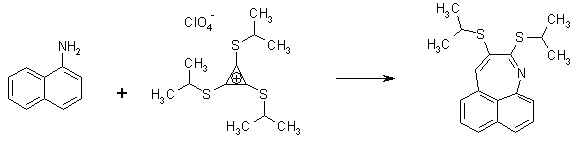 К особенностям химических свойств ароматических соединений следует отнести следующие: 1. Формальная ненасыщенность (формула С6Н6, С7Н8 и т.д.). 2. Высокая устойчивость к действию окислителей (KMnO4, CrO3). 3. Скрытый непредельный характер (реакции присоединения требуют жестких условий). 4. Предпочтительность участия в реакциях замещения при действии электрофильных агентов. Критерии ароматичности Единого критерия, позволяющего надёжно классифицировать соединение как ароматическое или неароматическое, не существует. Основными характеристиками ароматических соединений являются:
Современные представления В современной физической органической химии выработана общая формулировка критерия ароматичности[6]. Ненасыщенная циклическая или полициклическая диатропная молекула или ион может рассматриваться как ароматическая, если все атомы цикла входят в полностью сопряжённую систему таким образом, что в основном состоянии все π-электроны располагаются только на связывающих молекулярных орбиталях аннулярной (замкнутой) оболочки |
