Тема 20. Арены. Бензол и его производные Содержание главы
 Скачать 252.49 Kb. Скачать 252.49 Kb.
|
|
Примеры реакций электрофильного замещения Гомологи бензола вступают в реакции электрофильного замещения легче, чем бензол, из-за электронодонорного влияния алкильных заместителей. В результате монозамещения образуются, как правило, все три изомера с преобладанием орто- и пара-продуктов. Дейтерирование Дейтерирование аренов осуществляют действием концентрированных дейтерокислот. Так, толуол дейтерируется по положениям 2 , 4 и 6 при комнатной температуре, будучи растворенным в D2SO4. 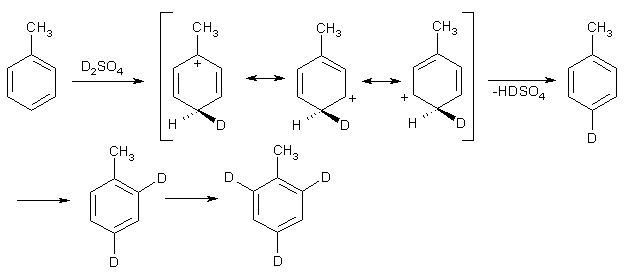 Факты протонирования аренов зафиксированы не только приборными методами, некоторые σ-комплексы получены и выделены как индивидуальные вещества. Например, ониевая "соль" толуола с тетрафторбороводородной кислотой устойчива при низких температурах и имеет т.пл. -65 оС (толуол проявляет свойства основания). Ее строение изображается формулой 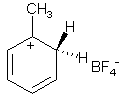 Галогенирование Для введения галогена в ароматическое кольцо в качестве реагентов используют комплексы галогенов с кислотами Льюиса. Роль последних заключается в поляризации связи галоген-галоген, в результате чего один из атомов приобретает положительный заряд, тогда как другой образует связь с кислотой Льюиса за счет ее вакантной d-орбитали. 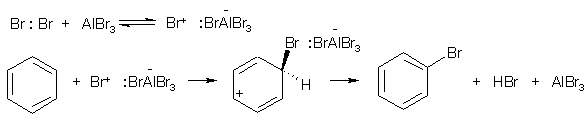 На практике вместо безводного бромида алюминия часто применяют железные стружки. При добавлении в реакционный сосуд галогена (хлора или брома) железо превращается в галогенид железа(III), который является сильной кислотой Льюиса и тоже катализирует реакцию. 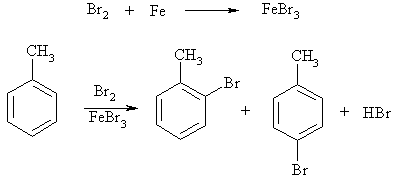 Скорость реакции галогенирования зависит от электроотрицательности галогена и π-избыточности арена. Так, лишь для немногих субстратов удается провести электрофильное иодирование, тогда как фторирование зачастую сопровождается разрывом связей С-С. По этой причине путь электрофильного замещения водорода применяется, в основном, для синтеза бром- и хлораренов. Хлор активнее брома, поэтому электроноизбыточные ароматические соединения реагирует без катализатора. Для бромирования алкилбензолов и собственно бензола катализ необходим, тогда как ариламины и эфиры фенолов бромируются в мягких условиях. Во всех этих реакциях электрофильного замещения галоген вступает в положение с наибольшей электронной плотностью, соответственно правилам ориентации. 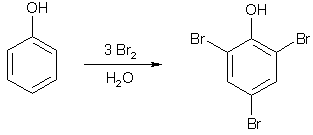 Некоторые субстраты бромируют в условиях свободно-радикальной реакции. Для этого используются такие реагенты, как N-бром- и N-хлорсукцинимид (N-галогенированные имиды янтарной кислоты), либо добавляется активатор типа AIBN или перекиси бензоила. Свободно-радикальные реакции не отличаются высокой избирательностью и ориентация радикального галогенирования зачастую сильно отличается от электрофильного. 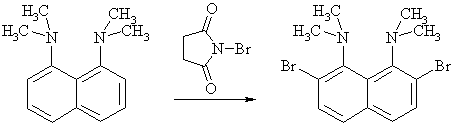 Нитрование Бензол и его гомологи превращаются в нитросоединения действием нитрующей смеси, которая состоит из концентрированных серной и азотной кислот (2:1). Нитрующей частицей (электрофилом) является катион нитрония NO2+, существование которого в нитрующей смеси доказано криоскопическим методом: измерения температур замерзания азотной и серной кислот и их смеси указывает на присутствие четырех частиц в растворе. 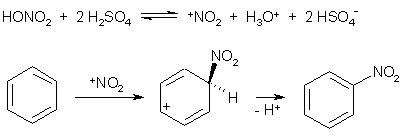 Можно нитровать азотной кислотой без применения серной, но реакция идет медленнее, т.к. равновесие смещено влево. Еще медленнее реакция идет, когда азотную кислоту используют в растворах уксусной кислоты, нитрометана и т.д., поэтому такие условия применяют для нитрования соединений с повышенной активностью. 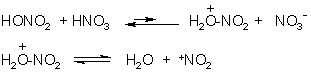 Сульфирование Реакция сульфирования аренов, как считают, протекает в олеуме при действии триоксида серы, а в серной кислоте - с участием катиона HSO3+. Триоксид серы проявляет электрофильный характер благодаря полярности связей S–O. 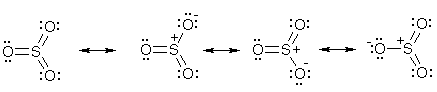 В результате атаки триоксида серы образуется σ-комлекс, который представляет собой биполярную нейтральную частицу. Вероятно, поэтому, в отличие от других реакций электрофильного замещения, где σ-комплекс положительно заряжен, в этом случае медленной стадией является не образование σ-комплекса, а отщепление протона и реароматизация. 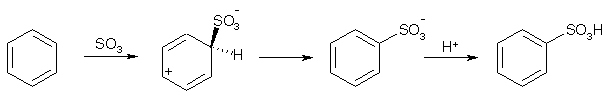 При сульфировании серной кислотой катион гидросульфоксония образуется в результате следующей обменной реакции: 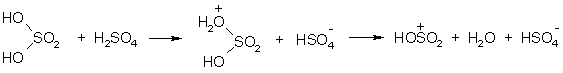 Образующийся при сульфировании серной кислотой заряженный σ-комплекс находится в равновесии с нейтральным σ-комплексом. Это объясняет тот факт, что скорость реакции и в этом случае определяется скоростью стадии реароматизации. 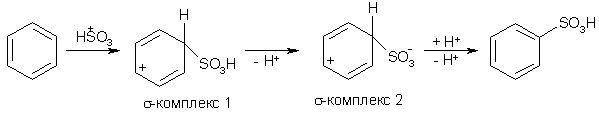 Реакция сульфирования обратима. Это подтверждается тем, что выход бензолсульфокислоты увеличивается, если при проведении реакции производится азеотропная отгонка воды избытком бензола. Кроме того, нагревание аренсульфокислот с 25-50%-ной серной кислотой приводит к удалению сульфогруппы. 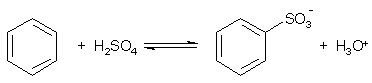 Поэтому сульфирование зачастую применяют для защиты определенного положения в ядре в многостадийных синтезах, например: 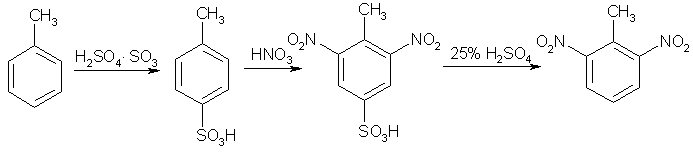 Алкилирование по Фриделю-Крафтсу Одним из способов получения гомологов бензола является реакция алкилирования. Превращение носит имя Ш. Фриделя и Дж. М. Крафтса, которые его открыли. В реакцию, как правило, вводят галогеналканы и галогениды алюминия в качестве катализаторов. Считают, что катализатор – кислота Льюиса – поляризует связь С-галоген, создавая на атоме углерода дефицит электронной плотности, т.е. механизм аналогичен реакции галогенирования 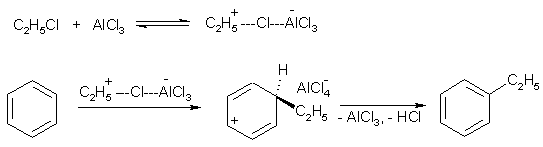 Этот углеродный атом является электрофилом, и атакует молекулу арена. При планировании синтеза Фриделя-Крафтса очень важно учитывать строение алкильного радикала, который предполагается ввести в ароматическую молекулу. Природа алкилов, входящих в комплекс с кислотой Льюиса, близка к катионной. Известно, что устойчивость карбокатионов зависит от их структуры и падает в ряду третичный > вторичный > первичный. Поэтому при электрофильном алкилировании может происходить и часто происходит перегруппировка промежуточных катионов в более устойчивые: первичных во вторичные и третичные, вторичных – в третичные. Так, взаимодействие 1-хлорпропана с хлоридом алюминия может быть представлено одной из схем 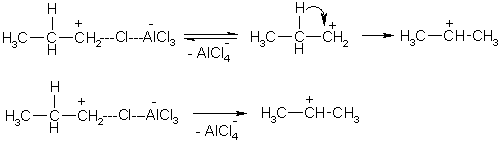 Именно такой перегруппировкой объясняется то, что при попытке синтеза н-пропилбензола из бензола и 1-хлорпропана получают изопропилбензол (кумол). 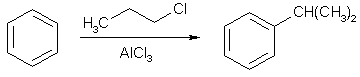 Для алкилирования аренов не обязательно применять галогеналканы. В реакции могут использоваться алканолы и алкены, этиленоксид; из них также генерируются карбокатионы при действии сильных протонных и льюисовских кислот. 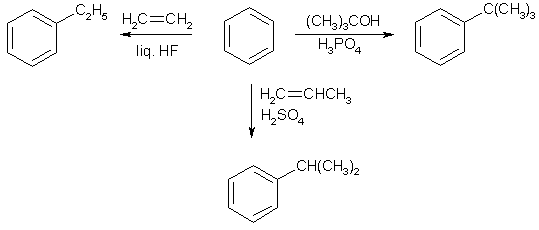 Ацилирование по Фриделю-Крафтсу Сходной с реакцией алкилирования является реакция ацилирования ароматических соединений. В качестве реагентов применяют ангидриды или галогенангидриды карбоновых кислот, продуктами являются ароматические кетоны. Механизм этой реакции включает образование комплексного соединения между ацилирующим реагентом и кислотой Льюиса. В результате положительный заряд на атоме углерода несравненно возрастает, что делает его способным к атаке ароматического соединения. 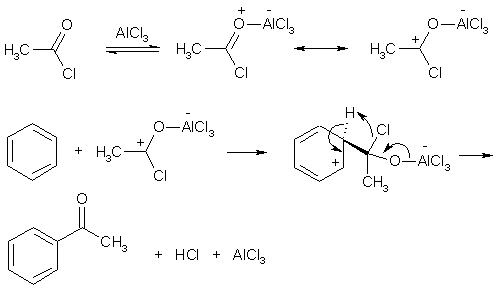 Нужно отметить, что, в отличие от реакции алкилирования, в данном случае необходимо брать избыток катализатора по отношению к количеству реагентов, т.к. продукт реакции (кетон) сам способен к комплексообразованию и связывает кислоту Льюиса. Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя Метод, предложенный Б.В. Пассетом с сотр., позволил повысить выход п-фенилуретилансульфохлорида иснизить расходхлорсульфоновой кислоты, а также использовать такой растворитель (например, ДХЭ), который растворяет только целевой продукт, что уменьшает возможность взаимодействия его с серной кислотой: Авторы показали, что:
Это можно объяснить тем, что хлорсульфоновая кислота может диссоциировать по двум направлениям: При низких температурах образуется довольно большое количество катиона SO2Cl+, который и взаимодействует с активированными ароматическими ядрами. Малоактивные соединения в этих условиях не реагируют. При повышенных температурах хлорсульфоновая кислота образует сульфотриоксид и катионHSO3+, которые с ареном образуют сульфокислоты. Продукты диссоциации молекул хлорсульфоновой кислоты в безводных растворителях находятся в виде ионных пар. Поэтому схема реакции сульфохлорирования может быть представлена следующим образом: 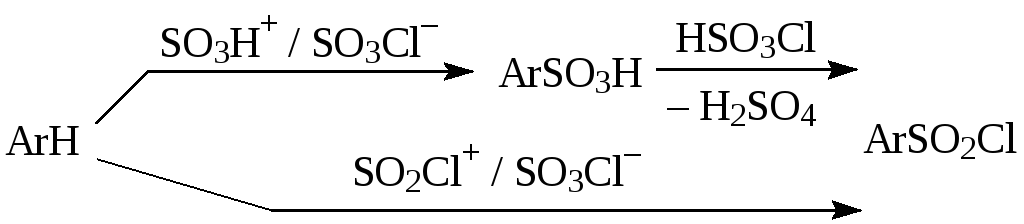 Реакции боковых цепей аренов Бензольное кольцо в обычных условиях устойчиво к действию окислителей (KMnO4, K2Cr2O7), алкильные заместители, напротив, весьма легко подвергаются окислению и реагируют с другими реагентами радикального характера. Наиболее реакционным центром боковой цепи является атом углерода, непосредственно связанный с ароматическим ядром, так называемый α-атом. Действие перманганата калия в воде или бихромата калия в кислой среде окисляет алкильный заместитель. Окисление происходит таким образом, что вся боковая цепь "отгорает", а связанный с кольцом атом углерода окисляется до карбоксильной группы, и образуется аренкарбоновая кислота. Если алкильных заместителей несколько, то образуются многоосновные кислоты. 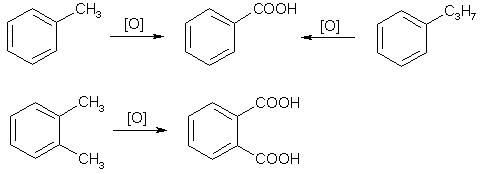 Гомологи бензола легко реагируют с галогенами на свету. В отличие от реакции с участием кислот Льюиса (см. выше), в данном случае происходит галогенирование боковой цепи. Как и при действии окислителей, в реакцию вступает α-углеродный атом. Промежуточно образующийся бензильный радикал по стабильности близок к аллильному благодаря тому, что ароматическое кольцо принимает участие в делокализации неспаренного электрона. 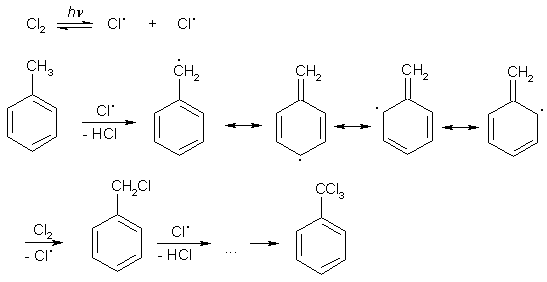 Процесс хлорирования протекает до полного замещения всех α-водородов галогеном и образования бензотрихлорида; в то же время, бромирование можно остановить на стадии замещения одного или двух атомов водорода, и в качестве продукта реакции получить бромистый бензил или бромистый бензилиден. 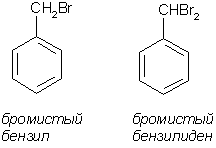 Реакции присоединения к ароматическому кольцу Бензол и его гомологи присоединяют три моля водорода в присутствии катализатора при повышенной температуре. Превращение бензольного кольца в циклогексановое сопровождается выделением тепла (теплоты гидрирования), количество которого служит сравнительной мерой устойчивости соединения. 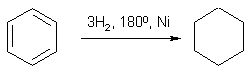 При действии на арены натрием в жидком аммиаке в присутствии этанола происходит присоединение двух атомов водорода в пара-положения кольца (восстановление по Берчу). Реакция протекает с двумя стадиями одноэлектронного переноса от атома натрия к ароматическому субстрату. 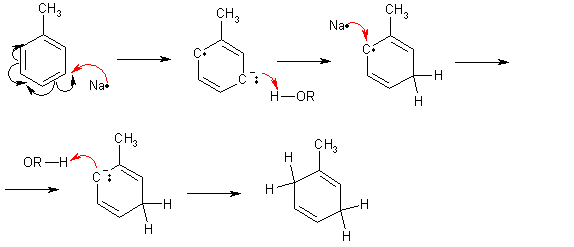 Реакция останавливается на стадии моноприсоединения по причине того, что полученный циклогексадиен не имеет циклического сопряжения и не способен к образованию стабильного анион-радикала. Бензольное кольцо при облучении ультрафиолетом присоединяет хлор, превращаясь в смесь стереоизомеров гексахлорциклогексана (гексахлоран). Это вещество ранее широко использовалось в качестве пестицида, хотя лишь один из стереоизомеров является активным. 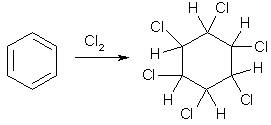 Сульфаниламиды синтез 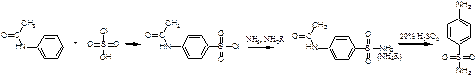 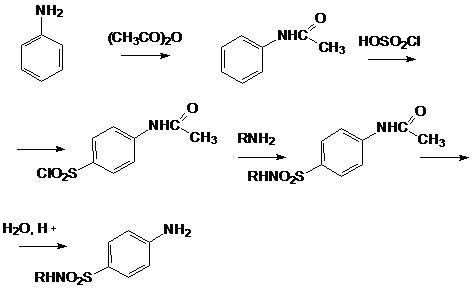 Окисление бензола. 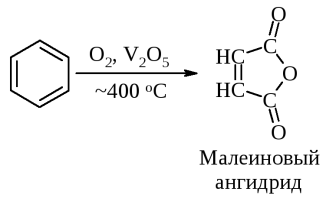 |
