Билет 1 биологическое окисление
 Скачать 1.13 Mb. Скачать 1.13 Mb.
|
|
Билет №4 1(3,4) Окислительное фосфорилирование и тканевое дыхание.Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием. Отношение количества связанного фосфата к количеству поглощенного кислорода (О) называют коэффициентом фосфорилирования и обозначают как Р/О. Как было показано, коэффициент Р/О равен 3. Эта величина отражает теоретически возможный выход АТФ. В действительности часть энергии электрохимического потенциала используется не на синтез АТФ, а на перенос веществ через митохондриальную мембрану при участии ферментов транслоказ. Суммарный результат окисления (НАДН + Н+) и фосфорилирования АДФ в дыхательной цепи можно представить следующим образом: НАДН + Н++ ½О2 → НАД+ + Н2О; 3АДФ + 3Н3РО4 → 3АТФ + 3Н2О. Митохондрии обычно имеют форму цилиндра с закругленными концами, длиной 1–4 мкм и диаметром 0,3–0,7 мкм. Они состоят из внешней и внутренней мембран, которые различаются по составу, свойствам и функциям. Внешняя мембрана легко проницаема для молекул с молекулярной массой до 5 000, в то время как проницаемость внутренней мембраны строго ограничена и избирательна, что определяется наличием специфических транспортных систем. На долю ферментов дыхательной цепи приходится 30–40% всех белков внутренней мембраны. Сопряжение дыхания и синтеза АТФ в митохондриях. I - NADH-дегидрогеназа; II - сукцинатдегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза; V - АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. 2 (42,43)Липопротеины. Классификация, функции, места образования. Все типы липопротеинов имеют сходное строение - гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов- фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части - к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.В организме синтезируются следующие типы липопротеинов: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). . Апопротеинывыполняютнесколькофункций: Формируют структуру липопротеинов; взаимодействуют с рецепторами на поверхности клеток и таким образом определяют, какими тканями будет захватываться данный тип липопротеинов; служат ферментами или активаторами ферментов, действующих на липопротеины. Основные апопротеины и их Функции: В-48 - основной белок ХМ; В-100 - основной белок ЛПОНП, ЛПНП, ЛППП, взаимодействует с рецепторами ЛПНП; С-II - активатор ЛП-липазы, переносится с ЛПВП на ХМ и ЛПОНП в крови; Е - взаимодействует с рецепторами ЛПНП; A-I - активатор фермента лецитингхолестеролацилтрансферазы (ЛХАТ).
3(21) Синтези распад гликогена: Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). синтез гликогена из глюкозы, как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида"праймер". Распад гликогена происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется фермент гликогенфосфорилазой. чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно. Билет №5 1(10) Окислительное декарбоксилирование пирувата. происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+ Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением: СН3-СО-СООН + NAD++ HSKoA → CH3-CO ∼SKoA + NADH + H++ CO2 В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил- КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль. Превращение пирувата в ацетил-КоА включает 5 стадий: Стадия I. На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию. Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2. В результате этой реакции образуется производное ТДФ с гидроксиэтильной группой при тиазоловом кольце Стадия П. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2 Стадия IV. На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD - простетическую группу фермента Е3. Стадия V . На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH. 2(17) Моносахариды - производные многоатомных спиртов, содержащие карбонильную группу. В зависимости от положения в молекуле карбонильной группы моносахариды подразделяют на альдозы и кетозы. Альдозы содержат функциональную альдегидную группу -НС=О, кетозы содержат кетонную группу >С=О. Название моносахарида зависит от числа составляющих его углеродных атомов, например альдотриозы, кетотриозы, альдогексозы, кетогексозы и т.д. Моносахариды -простые углеводы, так как они не гидролизуются при переваривании, сложные -при гидролизе распадаются с образованием простых углеводов. В пище(фрукты, мёд, соки) содержится небольшое количество моносахаридов, в основном глюкоза и фруктоза Глюкоза является альдогексозой. Она может существовать в линейной и циклической формах. Циклическая форма глюкозы,, обусловливает химические свойства глюкозы. глюкоза имеет 4 асимметричных углеродных атома, обусловливающих наличие стереоизомеров. Возможно образование 16 стереоизомеров, наиболее важные из которых D- и L-глюкоза. В организме млекопитающих моносахариды находятся в D-конфигурации, так как к этой форме глюкозы специфичны ферменты, катализирующие её превращения. В растворе при образовании циклической формы моносахарида образуются ещё 2 изомера (α- и β-изомеры), аномеры Фруктозаявляется кетогексозой (кетогругша находится у второго углеродного атома). Фруктоза так же, как и глюкоза, существует в циклической форме, образуя α- и β-аномеры Реакции моносахаридов Присутствие гидроксильных, альдегидных и кетонных групп позволяет моносахаридам вступать в реакции, характерные для спиртов, альдегидов или кетонов. Мутаротация, или аномеризация -взаимопревращение аномерных форм моносахаридов, α- и β-формы аномеров находятся в растворе в состоянии равновесия. При достижении этого равновесия происходит мутаротация - размыкание и замыкание пиранового кольца и, соответственно, изменение расположения Н- и ОН-групп при первом углероде моносахарида. Образование гликозидов.Гликозидная связь имеет важное биологическое значение, потому что именно с помощью этой связи осуществляется ковалентное связывание моносахаридов в составе олиго- и полисахаридов. При образовании гликозидной связи аномерная ОН-группа одного моносахарида взаимодействует с ОН-группой другого моносахарида или спирта. При этом происходят отщепление молекулы воды и образование О-гликозидной связи. Все линейные олигомеры (кроме дисахаридов) или полимеры содержат мономерные остатки, участвующие в образовании двух гликозидных связей, кроме концевых остатков, образующих только одну гликозидную связь. Некоторые гликозидные остатки могут образовывать три гликозидные связи, что характерно для разветвлённых олиго- и полисахаридов. Олиго- и полисахариды могут иметь концевой остаток моносахарида со свободной аномерной ОН-группой, не использованной при образовании гликозидной связи. В этом случае при размыкании цикла возможно образование свободной карбонильной группы, способной окисляться. Такие олиго- и полисахариды обладают восстанавливающими свойствами и поэтому называются восстанавливающими Аномерная ОН-группа моносахарида может взаимодействовать с NН2-группой других соединений, что приводит к образованию N-гликозидной связи. Подобная связь присутствует в нуклеотидах и гликопротеинах Этерификация.Это реакция образования эфирной связи между ОН-группами моносахаридов и различными кислотами. В метаболизме углеводов важную роль играют фосфоэфиры - эфиры моносахаридов и фосфорной кислоты. В метаболизме глюкозы особое место занимает глюкозо-6-фосфат. Образование глюкозо-6-фосфата происходит в ходе АТФ-зависимой реакции при участии ферментов, относящихся к группе киназ. АТФ в данной реакции выступает как донор фосфатной группы. Фосфоэфиры моносахаридов могут образовываться и без использования АТФ. Например, глюкозо-1-фосфат образуется из гликогена при участии Н3РО4. Физиологическое значение фосфоэфиров моносахаридов заключается в том, что они представляют собой метаболически активные структуры. Реакция фосфорилирования моносахаридов важна для метаболизма ещё и потому, что клеточная мембрана мало проницаема для этих соединений, т.е. клетка удерживает моносахариды благодаря тому, что они находятся в фосфорилированной форме. Окисление и восстановление.При окислении концевых групп глюкозы -СНО и -СН2ОН образуются 3 различных производных. При окислении группы -СНО образуется глюконовая кислота. Если окислению подвергается концевая группа -СН2ОН, образуется глюкуроновая кислота. А если окисляются обе концевые группы, то образуется сахарная кислота, содержащая 2 карбоксильные группы. Восстановление первого углерода приводит к образованию сахароспирта - сорбитола. 3(51) Метаболизм фосфолипидов. Обмен глицерофосфолипидов. Биологическое значение различных фосфолипаз. Биосинтез фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина. Метаболизм фосфолипидов тесно связан со многими процессами в организме: образованием и разрушением мембранных структур клеток, формированием ЛП, мицелл жёлчи, образованием в альвеолах лёгких поверхностного слоя, предотвращающего слипание альвеол во время выдоха. Нарушения обмена фосфолипидов - причина многих заболеваний, в частности, респираторного дистресс-синдрома новорождённых, жирового гепатоза, наследственных заболеваний, связанных с накоплением гликолипидов, - лизосомных болезней. При лизосомных болезнях снижается активность гидролаз, локализованных в лизосомах и участвующих в расщеплении гликолипидов. Начальные этапы синтеза глицерофосфолипидов и жиров происходят одинаково до образования фосфатидной кислоты. Фосфатидная кислота может синтезироваться двумя разными путями: через глицеральдегид-3-фосфат и через дигидроксиацетонфосфат На следующем этапе фосфатидаза отщепляет от фосфатидной кислоты фосфатный остаток, в результате чего образуется диацилглицерол. Дальнейшие превращения диацилглицерола также могут идти разными путями. Один из вариантов - образование активной формы "полярной головки" фосфолипида: холин, серии или этаноламин превращаются в ЦДФ-холин, ЦДФ-серин или ЦДФ-этаноламин. Далее диацилглицерол взаимодействует с ЦМФ-производными, при этом выделяется ЦМФ, и образуется соответствующий фосфолипид, например фосфатидилхолин. Между глицерофосфолипидами возможны различные взаимопревращения. Фосфатидилхолин может образовываться и другим путём: из фосфатидилэтаноламина, получая последовательно 3 метальные группы от SAM. Фосфатидилсерин может превращаться в фосфа-тидилэтаноламин путём декарбоксилирования. Фосфатидилэтаноламин может превращаться в фосфатидилсерин путём обмена этаноламина на серии. Билет №6 1(12) Цикл лимонной кислоты: биороль, последовательность реакций, характеристика ферментов. кислоты центральная часть ОПК, циклич аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных промеж продуктовдо CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая участие в синтезе АТФ.это ключевой этап дыхания всех клеток, использующих кислород, Кроме значительной энергетической роли цикл это важный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются как АК, ЖК углев.  2(18,19) Дисахариды . Дисахариды - наиболее распространённые олигомерные углеводы, встречающиеся в свободной форме, . По химической природе дисахариды представляют собой гликозиды, которые содержат 2 моносахарида, соединённые гликозидной связью в α- или β-конфигурации. В пище содержатся в основном такие дисахариды, как сахароза, лактоза и мальтоза Сахароза - дисахарид, состоящий из α-D-глюкозы и β-D-фруктозы, соединённых α,β-1,2-гликозидной связью. В сахарозе обе аномерные ОН-группы остатков глюкозы и фруктозы участвуют в образовании гликозидной связи. не относится к восстанавливающим сахарам. Сахароза - растворимый дисахарид со сладким вкусом. Источники-сахарная свёкла, сахарный тростник. . Лактоза - молочный сахар; важнейший дисахарид молока млекопитающих. В лактозе аномерная ОН-группа первого углеродного атома остатка D-галактозы связана β-гликозидной связью с четвёртым углеродным атомом D-глюкозы (β-1,4-связь). Поскольку аномерный атом углерода остатка глюкозы не участвует в образовании гликозидной связи,лактоза относится к восстанавливающим сахарам. Мальтоза поступает с продуктами, содержащими частично гидролизованный крахмал, например, солод, пиво. Мальтоза также образуется при расщеплении крахмала в кишечнике. Мальтоза состоит из двух остатков D-глюкозы, соединённых α-1,4-гликозидной связью. Изомальтоза - промежуточный продукт, образующийся при расщеплении крахмала в кишечнике. Состоит из двух остатков D-глюкозы, но соединены эти моносахариды α-1,6-гликозидной связью. Полисахариды —класс сложных высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов. Полисахариды необходимы для жизнедеятельности животных и растительных организмов. Они являются одним из основных источников энергии, образующейся в результате обмена веществ организма. Они принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере. Крахмал: 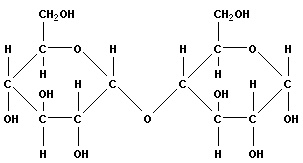 Крахмал состоит из 2 полисахаридов - амилозы и амилопектина, образованных остатками глюкозы. Химическая формула крахмала (C6H10O5)n. Служит основным поставщиком углеводов — одного из важнейших компонентов пищи. Под действием ферментов крахмал гидролизуется до глюкозы, которая окисляется в клетках до углекислого газа и воды с выделением энергии, необходимой для функционирования живого организма. Гликоген — (C6H10O5)n, полисахарид, образованный остатками глюкозы, связанными α-1→4 связями (α-1→6 в местах разветвления); основной запасной углевод человека и животных. Гликоген: 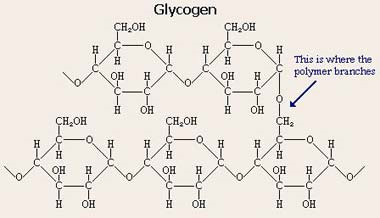 Гетерополисахариды( на картинке 3 представителя, они подписаны) : 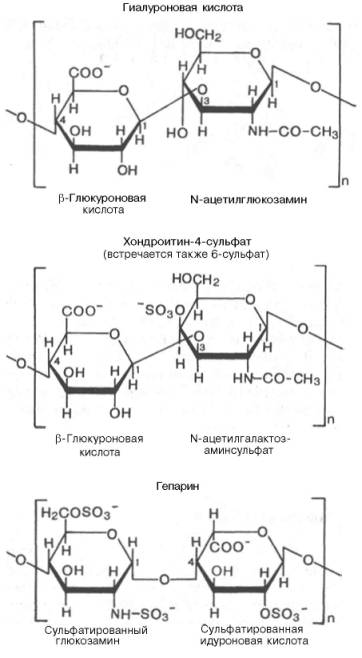 гетерополисахариды играют важную роль в жизнедеятельности животных организмов, в которых они являются основой углеводных компонентов соединительных тканей (например, хрящей), входят в состав костей и различных слизей. Особенно значительную роль гетерополисахариды играют во многих сложных биохимических системах. Гетерополисахариды составляют основу так называемых гликопептидов — сложных комплексов белков с углеводами, широко представленных в различных тканях организмов. Гетерополисахариды, содержащие аминосахара (а иногда и полипептидиые цепи), играют важную роль в вопросах иммунитета, обеспечивая специфичность иммунологических реакций. Этого же типа гетерополисахариды определяют групповую принадлежность крови. гетерополисахариды играют важную роль в жизнедеятельности животных организмов, в которых они являются основой углеводных компонентов соединительных тканей (например, хрящей), входят в состав костей и различных слизей. Особенно значительную роль гетерополисахариды играют во многих сложных биохимических системах. Гетерополисахариды составляют основу так называемых гликопептидов — сложных комплексов белков с углеводами, широко представленных в различных тканях организмов. Гетерополисахариды, содержащие аминосахара (а иногда и полипептидиые цепи), играют важную роль в вопросах иммунитета, обеспечивая специфичность иммунологических реакций. Этого же типа гетерополисахариды определяют групповую принадлежность крови.3(49)Биосинтез ТАГ (липогенез). Особенности биосинтеза ТАГ в печени и жировой ткани. Гормональная регуляция. Образование ЛПОНП в печени. Печень-основной орган, где идет синтез жирных кислот из продуктов гликолиза. В гладком Эр гепатоцитов жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идет через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и секретируются в кровь.В состав ЛПОНП, кроме жиров, входят холестерол, фосфолипиды и белок апоВ-100. Это очень «длинный» белок , содержащий 11536 аминокислот. Одна молекула апоВ-100 покрывает поверхность всего липопротеина. ЛПОНП из печени секретируется в кровь, где на них, как и на ХМ, действует ЛП-липаза. Жирные кислоты поступают в ткани, в частности в адипоциты, и используются для синтеза жиров. В процессе удаления жиров из ЛПОНП под действием ЛП-липазы ЛПОНП сначала превращаются в ЛППП , а затем в ЛПНП. В ЛПНП основными липидными компонентами служат холестерол и его эфиры, поэтому ЛПНП являются липопротеинами, доставляющими холестерол в периферические ткани. Глицерол, освободившийся из липопротеинов, кровью транспортируется в печень, где опять может использоваться для синтеза жиров. Скорость синтеза ЖК и жиров в печени существенно зависит от состава пищи. Если в пище содержится белее 10% жиров, то скорость синтеза жиров в печени резко снижается. Гормональная регуляция синтеза жиров. Какой процесс будет преобладать в организме – синтез жиров или их распад зависит от поступления пищи и физической активности В абсорбтивном состоянии под действием инсулина происходит липогенез, в постабсорбтивном состоянии – липолиз, активируемый глюкагоном. Адреналин, секреция которого увеличивается при физической активности, также стимулирует липолиз. В абсорбтивный период при увеличении соотношения инсулин/глюкагон в печени активируется синтез жиров. В жировой ткани индуцируется синтез ЛП-липазы в адипоцитах и осуществляется ее экспонирование на поверхность эндотелия , следовательно в этот период увеличивается поступление жирных кислот в адипоциты. Одновременно инсулин активирует белки-переносчики глюкозы – ГЛЮТ-4. Поступление глюкозы в адипоциты и гликолиз также активируется. В результате образуются все необходимые компоненты для синтеза жиров: глицерол-3-фосфат и активные формы жирных кислот. В печени инсулин, действуя через различные механизмы, активирует ферменты путем дефосфорилирования и индуцирует их синтез. В результате увеличиваются активность и синтез ферментов, участвующих в превращении части глюкозы, поступающей с пищей в жиры. Это – регуляторные ферменты гликолиза, пируватдегидрогеназный комплекс и ферменты, участвующие в синтезе ЖК из ацетил-КоА. Результат действия инсулина на обмен углеводов и жиров в печени – увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП. ЛПОНП доставляют жиры в капилляры жировой ткани, где действие ЛП-липазы обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе ТАГ.  Билет №7 1(16) Образование активных форм кислорода ОБРАЗОВАНИЕ ТОКСИЧНЫХ ФОРМ КИСЛОРОДА В ЦПЭ В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием Кислорода, делятся на 2 группы: оксидазы и оксигеназы. Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2. Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции. Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот (см. раздел 9), синтезе жёлчных кислот и стероидов, в реакциях обезвреживания чужеродных веществ в печени. В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода. В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон. Полное восстановление О2 происходит в результате 4 одноэлектронных переходов. Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки (рис. 6-30). Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции. Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород. В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов. В фагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода. Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов. 2(18) Дисахариды . Дисахариды - наиболее распространённые олигомерные углеводы, встречающиеся в свободной форме, . По химической природе дисахариды представляют собой гликозиды, которые содержат 2 моносахарида, соединённые гликозидной связью в α- или β-конфигурации. В пище содержатся в основном такие дисахариды, как сахароза, лактоза и мальтоза Сахароза - дисахарид, состоящий из α-D-глюкозы и β-D-фруктозы, соединённых α,β-1,2-гликозидной связью. В сахарозе обе аномерные ОН-группы остатков глюкозы и фруктозы участвуют в образовании гликозидной связи. не относится к восстанавливающим сахарам. Сахароза - растворимый дисахарид со сладким вкусом. Источники-сахарная свёкла, сахарный тростник. . Лактоза - молочный сахар; важнейший дисахарид молока млекопитающих. В лактозе аномерная ОН-группа первого углеродного атома остатка D-галактозы связана β-гликозидной связью с четвёртым углеродным атомом D-глюкозы (β-1,4-связь). Поскольку аномерный атом углерода остатка глюкозы не участвует в образовании гликозидной связи,лактоза относится к восстанавливающим сахарам. Мальтоза поступает с продуктами, содержащими частично гидролизованный крахмал, например, солод, пиво. Мальтоза также образуется при расщеплении крахмала в кишечнике. Мальтоза состоит из двух остатков D-глюкозы, соединённых α-1,4-гликозидной связью. Изомальтоза - промежуточный продукт, образующийся при расщеплении крахмала в кишечнике. Состоит из двух остатков D-глюкозы, но соединены эти моносахариды α-1,6-гликозидной связью. 3(56) Эйкозаноиды. Биосинтез, строение, номентклатура, биологические функции. Ингибиторы синтеза эйкозаноидов. Эйкозаноиды – биологически активные вещества , синтезируемые большинством клеток из полиеновых жк, содержащих 20 углеродных атомов. Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, - высокоактивные регуляторы клеточных функций. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как "гормоны местного действия", влияя на метаболизм продуцирующей их клетки по аугокзэинному механизму, и на окружающие клетки - по паракринному механизму. Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например бронхиальной астме и аллергическим реакциям. Хотя субстраты для синтеза эйкозаноидов имеют довольно простую структуру (полистовые жирные кислоты), из них образуется большая и разнообразная группа веществ. Наиболее распространены в организме человека простагландины, которые впервые были выделены из предстательной железы, откуда и получили свое название. Позже было показано, что и другие ткани организма синтезируют простагландины и другие эйкозаноиды. Структура и номенклатура простагландинов и тромбоксанов . Простагландины обозначают символами, например PG А, где PG обозначает слово "простагландин", а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида. Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, PG Е2. Число двойных связей в боковых цепях простагландинов зависит от структуры предшественника - полистовой кислоты, из которой образовались простагландины. Две двойные связи полиеновой кислоты используются при образовании кольца в молекуле простагландина, а количество оставшихся двойных связей в радикалах, связанных с кольцом, определяет серию простагландина: 1 - если одна двойная связь, 2 - если две двойные связи и 3 - если в радикалах имеются три двойных связи. PG I - простациклины. Имеют 2 кольца в своей структуре: одно пятичленное, как и другие простагландины, а другое - с участием атома кислорода. Их также подразделяют в зависимости от количества двойных связей в радикалах (PG I2, PG I3). Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба. Тромбоксаны имеют шестичленное кольцо, включающее атом кислорода (рис. 8-46). Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях, образуя ТХ А2, или ТХ A3, отличающиеся по активности. ТХ В2 - продукт катаболизма ТХ А2 и активностью не обладает. Циклооксигеназный путь: синтез простагландинов и тромбоксанов . Активация фосфолипаз. Синтез проетагландинов начинается только после отделения полиеновых кислот от фосфолипида мембраны под действием ферментов (рис. 8-47). Активация фосфолипаз, ассоциированных с мембранами, происходит под действием многих факторов: гормонов, гистамина, цитокинов, механического воздействия. Связывание стимулирующего агента с рецептором может активировать или фосфолипазу А2 или фосфолипазу С. Это зависит от типа клетки и типа рецепторов. После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеется 2 основных пути превращения арахидоновой кислоты: циклооксигеназный, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, и липоксигеназный, заканчивающийся образованием лейкотриенов или других эйкозаноидов (рис. 8-48). Синтез простагландинов. Фермент, катализирующий первый этап синтеза простагландинов, называется PG Н2 синтазой и имеет 2 каталитических центра. Один из них называют циклооксигеназой, другой - пероксидазой. Этот фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. Фермент имеет гидрофобный домен, погружённый в липидный слой мембран ЭР, и каталитический домен, обращённый в полость ЭР. В активном центре циклооксигеназы находится тирозин (385), в активном центре пероксидазы - простетическая группа - гем. В организме имеются 2 типа циклооксигеназ (PG Н2 синтаз). Циклооксигеназа 1 - конститутивный фермент, синтезирующийся с постоянной скоростью. Синтез циклооксигеназы 2 увеличивается при воспалении и индуцируется соответствующими медиаторами - цитокинами. Оба типа циклооксигеназ катализируют включение 4 атомов кислорода в арахидоновую кислоту и формирование пятичленного кольца. В результате образуется нестабильное гидропероксидпроизводное, называемое PG G2. Гидропероксид у 15-го атома углерода быстро восстанавливается до гидроксильной группы пероксидазой с образованием PG Н2. До образования PG Н2 путь синтеза разных типов простагландинов одинаков. Дальнейшие превращения PG Н2 специфичны для каждого типа клеток. Например, PG Н2 в клетках ГМК может быть восстановлен под действием PG E синтазы с образованием PG Е2 или под действием PG D синтазы с образованием PG D2. В тромбоцитах содержится фермент тромбоксансинтаза, превращающий тот же исходный PG Н2 в ТХ А2 обладающий сильным сосудосуживающим действием. В клетках эндотелия под действием фермента простациклинсинтазы из PG Н2 синтезируется PG I2 (простациклин), имеющий сосудорасширяющее действие. Воспаление - реакция организма на повреждение или инфекцию, направленная на уничтожение инфекционного агента и восстановление повреждённых тканей. Продукция медиаторов воспаления - эйкозаноидов, гистамина, кининов) - активируется каскадами реакций, запускающимися при внедрении инфекционных агентов или повреждении тканей. Многие эйкозаноиды выполняют функцию медиаторов воспаления и действуют на всех этапах воспаления. В результате увеличивается проницаемость капилляров, транссудат и лейкоциты проходят через сосудистую стенку. Лейкотриен В4 и липоксин А4 являются мощными факторами хемотаксиса; взаимодействуя с рецепторами, стимулируют движение лейкоцитов в область воспаления и секрецию ими лизосомальных ферментов и фагоцитоз чужеродных частиц.На семейства эйкозаиоидов, синтезируемых в организме, влияет состав жирных кислот пищи. Если с пищей поступает больше эйкозапентаеновой кислоты (20:5, ю-3), в большом количестве содержащейся в рыбьем жире, то эта кислота включается преимущественно в фосфо-липиды мембран (вместо арахидоновой) и после действия фосфодипазы А2 служит основным субстратом для синтеза эйкозаноидов. Это имеет существенное влияние на свёртывание крови. Аспирин - препарат, подавляющий основные признаки воспаления. Механизм противовоспалительного действия аспирина стал понятен, когда обнаружили, что он ингибирует циклооксигеназу. Следовательно, он уменьшает синтез медиаторов воспаления и, таким образом, уменьшает воспалительную реакцию. Циклооксигеназа необратимо ингибируется путём ацетилирования серина в положении 530 в активном центре (рис. 8-54). Однако эффект действия аспирина не очень продолжителен, так как экспрессия гена этого фермента не нарушается и продуцируются новые молекулы фермента. Другие нестероидные противовоспалительные препараты (например, ибупрофен и ацетаминофен) действуют по конкурентному механизму, связываясь в активном центре фермента, и также снижают синтез простагландинов. Билет №8 1(3)Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием. Отношение количества связанного фосфата к количеству поглощенного кислорода (О) называют коэффициентом фосфорилирования и обозначают как Р/О. Как было показано, коэффициент Р/О равен 3. Эта величина отражает теоретически возможный выход АТФ. В действительности часть энергии электрохимического потенциала используется не на синтез АТФ, а на перенос веществ через митохондриальную мембрану при участии ферментов транслоказ. Суммарный результат окисления (НАДН + Н+) и фосфорилирования АДФ в дыхательной цепи можно представить следующим образом: НАДН + Н++ ½О2 → НАД+ + Н2О; 3АДФ + 3Н3РО4 → 3АТФ + 3Н2О. Митохондрии обычно имеют форму цилиндра с закругленными концами, длиной 1–4 мкм и диаметром 0,3–0,7 мкм. Они состоят из внешней и внутренней мембран, которые различаются по составу, свойствам и функциям. Внешняя мембрана легко проницаема для молекул с молекулярной массой до 5 000, в то время как проницаемость внутренней мембраны строго ограничена и избирательна, что определяется наличием специфических транспортных систем. На долю ферментов дыхательной цепи приходится 30–40% всех белков внутренней мембраны. 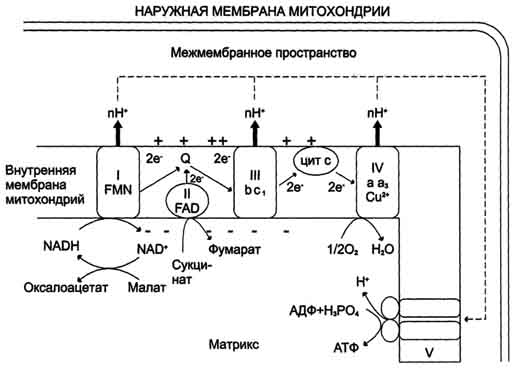 Сопряжение дыхания и синтеза АТФ в митохондриях. I - NADH-дегидрогеназа; II - сукцинатдегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза; V - АТФ-синтаза. Энергия протонного потенциала (электрохимического потенциала ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы. 2(21,22) Гликоген в печени и мышцах. Распад гликогена в печени. Биологическое значение процесса. 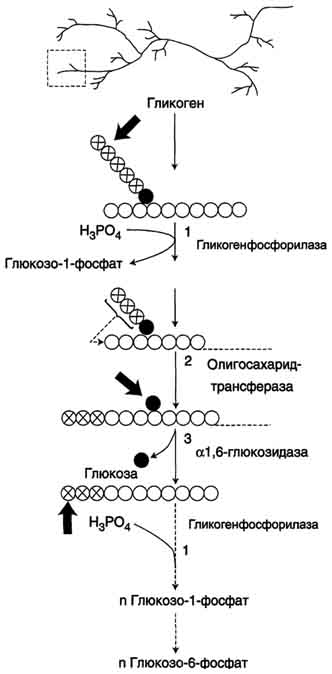 Распад гликогена. 1 - Гликогенфосфорилаза; 2 - олигосахаридтрансфераза; 3 - α-1,6-глюкозидаза. Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). синтез гликогена из глюкозы, как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. Так как гликоген в клетке никогда не расщепляется полностью, синтез гликогена осуществляется путём удлинения уже имеющейся молекулы полисахарида, называемой "затравка", или "праймер". Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой. Так же как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахаридной цепи. При этом наличие разветвлённой структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно. 3(40) .ЖЕЛЧНЫЕ КИСЛОТЫ. Жёлчные кислоты синтезируются в печени из холестерола. Часть жёлчных кислот в печени подвергается реакции конъюгации - соединения с гидрофильными молекулами (глицином и таурином). Жёлчные кислоты обеспечивают эмульгирование жиров, всасывание продуктов их переваривания и некоторых гидрофобных веществ, поступающих с пищей, например жирорастворимых витаминов и холестерола. Жёлчные кислоты также всасываются, через юротную вену попадают опять в печень и многократно используются для эмульгирования жиров. Этот путь называют энтерогепатической циркуляцией жёлчных кислот. Синтез жёлчных кислот В организме за сутки синтезируется 200- 600 мг жёлчных кислот. Первая реакция синтеза - образование 7-α-гидроксихолестерола - является регуляторной. Фермент 7-α-гидроксилаза, катализирующий эту реакцию, ингибируется конечным продуктом - жёлчными кислотами. 7-α-Гидроксилаза представляет собой одну из форм цитохрома Р450 и использует кислород как один из субстратов. Один атом кислорода из О2 включается в гидроксильную группу в положении 7, а другой восстанавливается до воды. Последующие реакции синтеза приводят к формированию 2 видов жёлчных кислот: холевой и хенодезоксихолевой, которые называют "первичными жёлчными кислотами". Конъюгирование жёлчных кислот Конъюгирование - присоединение ионизированных молекул глицина или таурина к карбоксильной группе жёлчных кислот; усиливает их детергентные свойства, так как увеличивает амфифильность молекул. Конъюгация происходит в клетках печени и начинается с образования активной формы жёлчных кислот - производных КоА. Затем присоединяется таурин или глицин, и в результате образуется 4 варианта конъюгатов: таурохолевая и таурохенодезоксихолевая, гликохолевая или гликохенодезоксихолевая кислоты (они значительно более сильные эмульгаторы, чем исходные жёлчные кислоты). Конъюгатов с глицином образуется в 3 раза больше, чем с таурином, так как количество таурина ограничено. Продукты гидролиза жиров всасываются в основном в верхнем отделе тонкого кишечника, а соли жёлчных кислот - в подвздошной кишке. Около 95% жёлчных кислот, попавших в кишечник, возвращается в печень через воротную вену, затем опять секретируются в жёлчь и повторно используются в эмульгировании жиров. Этот путь жёлчных кислот называют энтерогепатической циркуляцией. В сутки всего реабсорбируется 12-32 г солей жёлчных кислот, так как в организме имеется 2-4 г жёлчных кислот, и каждая молекула жёлчной кислоты проходит этот крут 6-8 раз. |
