Билет 1 биологическое окисление
 Скачать 1.13 Mb. Скачать 1.13 Mb.
|
|
Часть жёлчных кислот в кишечнике подвергается действию ферментов бактерий, которые отщепляют глицин и таурин, а также гидроксильную группу в положении 7 жёлчных кислот. Жёлчные кислоты, лишённые этой гидроксильной группы, называют вторичными. Вторичные жёлчные кислоты: дезоксихолевая, образующаяся из холевой, и литохолевая, образующаяся из дезоксихолевой, хуже растворимы, медленнее всасываются в кишечнике, чем первичные жёлчные кислоты. Поэтому с фекалиями в основном удаляются вторичные жёлчные кислоты. Однако реабсорбированные вторичные жёлчные кислоты в печени опять превращаются в первичные и участвуют в эмульгировании жиров. За сутки из организма выводится 500-600 мг жёлчных кислот. Путь выведения жёлчных кислот одновременно служит и основным путём выведения холестерола из организма. Для восполнения потери жёлчных кислот с фекалиями в печени постоянно происходит синтез жёлчных кислот из холестерола в количестве, эквивалентном выведенным жёлчным кислотам. В результате пул жёлчных кислот (2-4 г) остаётся постоянным. Нарушения переваривания и всасывания жиров. Стеаторея. Нарушение переваривания жиров может быть следствием нескольких причин. Одна из них - нарушение секреции жёлчи из жёлчного пузыря при механическом препятствии оттоку жёлчи. Это состояние может быть результатом сужения просвета жёлчного протока камнями, образующимися в жёлчном пузыре, или сдавлением жёлчного протока опухолью, развивающейся в окружающих тканях. Уменьшение секреции жёлчи приводит к нарушению эмульгирования пищевых жиров и, следовательно, к снижению способности панкреатической липазы гидролизовать жиры. Нарушение секреции сока поджелудочной железы и, следовательно, недостаточная секреция панкреатической липазы также приводят к снижению скорости гидролиза жиров. В обоих случаях нарушение переваривания и всасывания жиров приводит к увеличению количества жиров в фекалиях - возникает стеа-торея (жирный стул). В норме содержание жиров в фекалиях составляет не более 5%. При стеаторее нарушается всасывание жирорастворимых витаминов (A, D, E, К) и незаменимых жирных кислот, поэтому при длительно текущей стеаторее развивается недостаточность этих незаменимых факторов питания с соответствующими клиническими симптомами. При нарушении переваривания жиров плохо перевариваются и вещества нелипидной природы, так как жир обволакивает частицы пищи и препятствует действию на них ферментов. Билет №9 1(1)Эндергонические и экзергонические реакции в живой клетке. Макроэргические соединения: определение, примеры. Анаболические превращения направлены на образование и обновление структурно-функциональных компонентов клетки, т.е. на синтез сложных биомолекул из более простых. Это восстановительные, эндергонические процессы, протекающие с увеличением свободной энергии. Катаболические превращения направлены на расщепление сложных молекул (как поступивших с пищей, так и уже входящих в состав клеток) до простых компонентов (на конечных стадиях – преимущественно до CO2 и воды). Это окислительные, экзергонические процессы, сопровождающиеся понижением свободной энергии. Анаболические процессы протекают благодаря энергии, заключенной в химических связях молекул специфической группы «высокоэнергетических» соединений (АТФ и др.), в которых аккумулируется энергия, выделяемая в катаболических процессах. В биохимии под "высокоэнергетическими" соединениями понимаются лабильные вещества, гидролиз которых в физиологических условиях сопровождается значительным понижением ∆G. Выигрыш в свободной энергии используется для смещения равновесия в сопряженных термодинамически невыгодных биохимических процессах, например синтеза биополимеров. Так, АТФ является сопрягающим энергетическим звеном обеих сторон метаболизма – анаболизма и катаболизма. Такое энергетическое сопряжение представляет собой основной способ использования энергии в живых организмах. Но не только АТФ, а и другие соединения, образующиеся в результате катаболизма и используемые в анаболических процессах для синтеза специфических биомолекул, выполняют роль субстратов, сопрягающих отдельные метаболические процессы. Такие пути (или циклы) катаболических и анаболических процессов – называют амфиболические. Амфиболические пути придают обмену веществ значительную гибкость и экономичность с точки зрения использования энергии и материальных ресурсов. 2(28) Регуляция углеводного обмена в организме. Уровень «сахара» в крови как гомео-статический параметр внутренней среды. Глюкозоксидазный метод определения содержания глюкозы крови. Результат регуляции метаболических путей превращения глюкозы - постоянство концентрации глюкозы в крови. Концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 60-100 мг/дл (3,3-5,5 ммоль/л). После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл (∼8 ммоль/л, алиментарная гипергликемия), а затем возвращается к нормальному уровню (примерно через 2 ч). Регуляция содержания глюкозы в крови в абсорбтивном и постабсорбтивном периодах Для предотвращения чрезмерного повышения концентрации глюкозы в крови при пищеварении основное значение имеет потребление глюкозы печенью и мышцами, в меньшей мере - жировой тканью.В печени глюкоза откладывается в печени в форме гликогена, остальная часть превращается в жиры и окисляется, обеспечивая синтез АТФ. Ускорение этих процессов инициируется повышением инсулинглюкагонового индекса. Другая часть глюкозы, поступающей из кишечника, попадает в общий кровоток. Примерно 2/3 этого количества поглощается мышцами и жировой тканью. Это обусловлено увеличением проницаемости мембран мышечных и жировых клеток для глюкозы под влиянием высокой концентрации инсулина. Остальная часть глюкозы общего кровотока поглощается другими клетками (инсулинонезависимыми).При нормальном ритме питания и сбалансированном рационе концентрация глюкозы в крови и снабжение глюкозой всех органов поддерживается главным образом за счёт синтеза и распада гликогена. Лишь к концу ночного сна, может несколько увеличиться роль глюконеогенеза, значение которого будет возрастать, если завтрак не состоится и голодание продолжится Глюкозооксидазный метод Фермент глюкозооксидаза катализирует окисление глюкозы до глюконовой кислоты и образование перекиси водорода H2O2: Фермент пероксидаза в присутствии перекиси водорода окисляет хромогенный краситель типа о-дианизидина, что приводит к образованию окрашенного продукта, интенсивность окраски которого пропорциональна содержанию глюкозы в среде инкубации: Фотометрию проводят при длине волны 400 нм. Реакция протекает в два этапа. На 1 этапе происходит окисление глюкозы до глюконовой кислоты при участии фермента глюкозооксидазы. Глюкозооксидаза высокоспецифична по отношению к β-D-глюкозе. В водных растворах глюкоза находится в λ-форме (36%)и β-форме (64%). Окисление глюкозы при участии глюкозооксидазы требует превращения λ- в β-форму, которое ускоряется под влиянием фермента мутаротазы. Некоторые образцы глюкозооксидазы содержат фермент мутаротазу, обеспечивающий превращение этих форм. В противном случае требуется увеличение времени инкубации, что способствует самопроизвольному переходу λ-формы в β-форму. 2 этап, включающий пероксидазную реакцию, является менее специфичным. Многие вещества: мочевая кислота, аскорбиновая кислота, билирубин, гемоглобин, тетрациклины, глутатион — приводят к занижению результатов, вероятно, конкурируя с хромогеном за H2O2. Большая часть мешающих определению веществ может быть удалена из раствора их осаждением. Глюкозооксидазный метод пригоден для определения глюкозы в спинномозговой жидкости. В моче содержатся высокие концентрации веществ, способных вмешиваться в пероксидазную реакцию, в частности, мочевая кислота, что способствует получению ложноотрицательных результатов. В связи с этим глюкозооксидазный метод следует с осторожностью использовать для определения глюкозы в моче. 3(31,32) Липиды. Общая характеристика. Биологическая роль.Классификация липидов. Характеристика отдельных групп Липиды. Общая характеристика. Биологическая роль. Липи́ды широкая группа органических соединений, включающая жирные кислоты, а также их производные, как по радикалу, так и по карбоксильной группе. Классификация липидов, как и других соединений биологической природы, — весьма спорный и проблематичный процесс. Предлагаемая ниже классификация, хоть и широко распространена в липидологии, является далеко не единственной. Она основывается, прежде всего, на структурных и биосинтетических особенностях разных групп липидов. Простые липиды Жирные кислоты, Жирные альдегиды, Жирные спирты, Предельные углеводороды с длинной алифатической цепочкой, Сфингозиновые основания, Воски Сложные липиды Полярные (Фосфолипиды, Гликолипиды, Фосфогликолипиды, Сфинголипиды,Мышьяколипиды); Нейтральные; Ацилглицериды(Триглицериды (Жиры); Диглицериды; Моноглицериды Церамиды Эфиры стеринов N-ацетилэтаноламиды Оксилипиды Оксилипиды липоксигеназного пути Оксилипиды циклооксигеназного пути Биологические функции Энергетическая (резервная) функция Многие жиры, в первую очередь триглицериды, используются организмом как источник энергии. При полном окислении 1 г жира выделяется около 9 ккал энергии, примерно вдвое больше, чем при окислении 1 г углеводов (4.1 ккал). Жировые отложения используются в качестве запасных источников питательных веществ, прежде всего животными, которые вынуждены носить свои запасы на себе. Растения чаще запасают углеводы, однако в семенах многих растений высоко содержание жиров Функция теплоизоляции Жир — хороший теплоизолятор, поэтому у многих теплокровных животных он откладывается в подкожной жировой ткани, уменьшая потери тепла. у животных, обитающих в условиях жаркого климата (верблюды, тушканчики) жировые запасы откладываются на изолированных участках тела (в горбах у верблюда, в хвосте у жирнохвостых тушканчиков), в качестве резервных запасов воды, так как вода — один из продуктов окисления жиров. Структурная функция Фосфолипиды составляют основу бислоя клеточных мембран, холестерин — регулятор текучести мембран.. Воски образуют кутикулу на поверхности надземных органов (листьев и молодых побегов) растений. Их также производят многие насекомые пчёлы строят из них соты Регуляторная Защитная (амортизационная) Толстый слой жира защищает внутренние органы многих животных от повреждений при удара 32.классификация липидов. Характеристика отдельных групп.
Билет №10 1(4) ЦПЭ-мессто расположения в митохондрии.компоненты Дыхательная цепь — система структурно и функционально связанных трансмембранных белков и переносчиков электронов. Она позволяет запасти энергию, выделяющуюся в ходе окисления НАД∙Н и ФАДН2 молекулярным кислородом (в случае аэробного дыхания) или иными веществами (в случае анаэробного) в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи, сопряжённого с перекачкой протонов через мембрану. Организация дыхательной цепи в митохондриях Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности . В этой последовательности их стандартные о-в потенциалы становятся более положительными по мере приближения к кислороду. Каждое звено этой цепи специфично в отношении донора и акцептора электронов. На первом этапе дегидрогеназы катализируют отщепление водорода от различных субстратов. Если субстратами служат а-гидрокси-кислоты малат, изоцитрат, 3-гидроксибутират, водород переносится на NAD+. Образовавшийся NADH в дыхательной цепи, в свою очередь, окисляется NADH-дегидрогеназой (комплекс I). Если субстратом служат такие соединения, как сукцинат или глицерол-3-фосфат, акцептором водорода служат FAD-зависимые дегидрогеназы. От NADH и FADH2 электроны и протоны передаются на убихинон и далее через цепь цитохромов к молекулярному кислороду. До сих пор точно неизвестно, каким образом расположены все переносчики электронов дыхательной цепи. Однако установлено, что в расположении дыхательных комплексов существует определённая асимметрия: некоторые из белков-переносчиков находятся ближе к той стороне внутренней мембраны, которая обращена к матриксу, а другие - к противоположной; некоторые белки пронизывают мембрану насквозь Комплекс I (НАДН дегидрогеназа) окисляет НАД-Н, отбирая у него два электрона и перенося их на растворимый в липидах убихинон, который внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 4 протона из матрикса в межмембранное пространство митохондрии. Комплекс II (Сукцинатдегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината. Комплекс III (Цитохром bc1 комплекс) переносит электроны с убихинола на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии.Убихинол передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинола и перекачиваются комплексом. Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов А и А3, которые, помимо гема, содержат ионы меди. Ингибиторы дыхательной цепи Некоторые вещества блокируют перенос электронов через комплексы I, II, III, IV . Ингибиторы I комплекса — барбитураты, ротенон, пиерицидин Ингибитор II комплекса — малонат. Ингибитор III комплекса — антимицин А, миксотиазол, стигматтелин Ингибиторы IV комплекса — сероводород, цианиды, угарный газ, оксид азота. 2(23) Гликолиз гликонеогенез.основные реакции и схема.субстратные циклы Гликолиз и глюконеогенез. Глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. 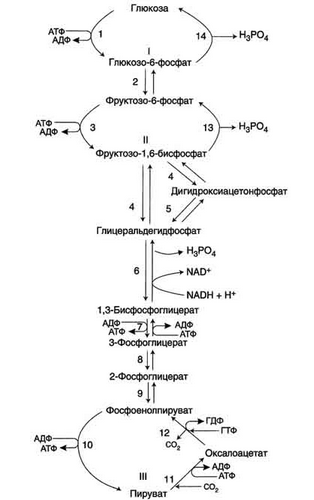 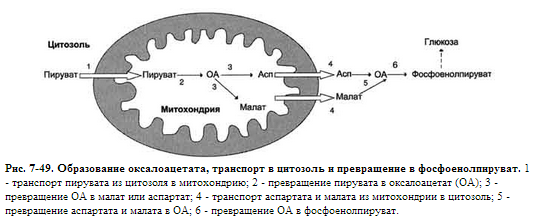 |
