|
|
Билет 1 биологическое окисление
Ферменты обратимых реакций гликолиза и глюконеогенеза: 2 - фосфоглюкоизомераза; 4 - альдолаза; 5 - триозофосфатизомераза; 6 - глицеральдегидфосфатдегидрогеназа; 7 -фосфоглицераткиназа; 8 - фосфоглицератмутаза; 9 - енолаза. Ферменты необратимых реакций глюконеогенеза: 11 - пируваткарбоксилаза; 12 - фосфоенолпируваткарбоксикиназа; 13 - фруктозо-1,6-бисфосфатаза; 14 -глюкозо-6-фосфатаза. I-III -субстратные циклы.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза (реакции 9, 8, 7, 6, 5, 4, 2) и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы.
1. Образование фосфоенолпирувата из пирувата - первая из необратимых стадий глюконеогенеза.
Схема всех реакций, протекающих на первой необратимой стадии глюконеогенеза, представлена на рисунке справа.
2. Гидролиз фруктозо-1,6-бисфосфата и глюкоза-6-фосфата.
Отщепление фосфатной группы из фруктозо-1,6-бисфосфата и глюкозо-6-фосфата - также необратимые реакции глюконеогенеза. В ходе гликолиза эти реакции катализируют специфические киназы с использованием энергии АТФ. В глюконеогенезе они протекают без участия АТФ и АДФ и ускоряются не киназами, а фосфатазами - ферментами, принадлежащими к классу гидролаз. В печени существуют 4 фермента, которые принимают участие только в глюконеогенезе и катализируют обходные реакции необратимых стадий гликолиза. Это - пируват-карбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозе-1,6-бисфосфатаза и глюкозо-6-фосфатаза.
Энергетический баланс глюконеогенезаиз пирувата
В ходе этого процесса расходуются 6 моль АТФ на синтез 1 моль глюкозы из 2 моль пирувата. Четыре моль АТФ расходуются на стадии синтеза фосфоенолпирувата из оксалоацетата и ещё 2 моль АТФ на стадиях образования 1,3-бисфосфоглицерата из 3-фосфоглицерата.
Суммарный результат глюконеогенеза:
2 Пируват + 4 АТФ + 2 ГТФ + 2 (NADH + Н+)+ 4 Н20 → Глюкоза + 4 АДФ + 2 ГДФ + 6 H3PO4+ 2 NAD+
3(52,53)Синтаз высших жирных кислот синтетаза жк и строение.образование малонил Коа
Билет 11 1(11) процесс окислительного декарбоксилирования пирувата катализирует пируватдегидрогеназный комплекс. В (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1) – кофермент - ТДФ, дигидролипоилтрансацетилаза (Е2) – кф липоевая кислота и коа- и дигидролипоилдегидрогеназа (Е3),-FAD, NAD+ .в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза 
Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ; II - Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ЛК); III - ацетилированная дигидролипоилтрансацетилаза взаимодействует с КоА с образованием восстановленной формы липоевой кислоты и ацетил-КоА; IV - окисленная форма трансацетилазы регенерируется при участии E3;V - окисленная форма Е3 востанавливается при участии NAD+
2. Метаболизм фруктозы начинается с реакции фосфорилирования, катализируемой фруктокиназой с образованием фруктозо-1-фосфата. Фермент обнаружен в печени, в почках и кишечнике. Этот фермент обладает абсолютной специфичностью. Фруктозе-1-фосфат не может превращаться во фруктозо-6-фосфат из-за отсутствия соответствующего фермента. фруктозо-1-фосфат расщепляется фруктозо-1-фосфатальдолазой на глицеральдегид и дигидроксиацетон-3-фосфат. Последний является промежуточным продуктом гликолиза и образуется в ходе реакции, катализируемой фруктозо-1,6-бисфосфосфатальдолазой. Глицеральдегид может включаться в гликолиз после его фосфорилирования с участием АТФ. Две молекулы триозофосфатов конденсируются с образованием фруктозо-1,6-бисфосфата. причиной Нарушения метаболизма фруктозы является дефект ферментов -Недостаточность фруктокиназы, Наследственная непереносимость фруктозы
Галактоза образуется в кишечнике в результате гидролиза лактозы. Чтобы превратить галактозу в глюкозу, необходимо изменить оптическую конфигурацию Н- и ОН-групп С4 атома в галактозе. Эта реакция в клетке возможна только с УДФ-произ-водным галактозы. УДФ-галактоза образуется из УДФ-глюкозы. происходит фосфорилирование с образованием галактозо-1-фосфата.Далее галактозо-1-фосфат замещает остаток глюкозы в УДФ-глюкозе с образованием УДФ-галактозы. Затем галактоза включается в реакцию эпимеризации, в которой участвует эпимераза - NAD-зависимый фермент. Галактоземия возникает при нарушении обмена галактозы, обусловленном наследственным дефектом любого из трёх ферментов, включающих галактозу в метаболизм
 
3(39) ПЕРЕВАРИВАНИЕ ТАГ,ХОЛЕСТЕРИНА,ФОСФОЛИПИДОВ панкреатической липазой.
Панкреатическая липаза выделяется в полость тонкой кишки из поджелудочной железы вместе с белком колипазой кот своим гидрофобным доменом связывается с поверхностью мицеллы эмульгированного жира. Панкреатическая липаза гидролизует жиры преимущественно в положениях 1 и 3, поэтому основными продуктами гидролиза являются свободные жирные кислоты и 2-моноацилглицеролы.
В переваривании глицерофосфолипидовучаствуют Фосфолипаза А2 гидролизует сложноэфирную связь у второго атома углерода глицерола, превращая глицерофосфолипиды в лизофосфолипиды. ФосфолипазаA2 активируется в полости кишечника путём частичного протеолиза. Для проявления активности необходимы ионы кальция.
Переваривание эфиров холестерола
В составе пищи холестерол находится в основном в виде эфиров. Гидролиз эфиров холестерола происходит под действием холестеролэстеразы - фермента, который также синтезируется в поджелудочной железе и секретируется в кишечник. Продукты гидролиза (холестерол и жирные кислоты) всасываются в составе смешанных мицелл.
Всасывание продуктов гидролиза липидов в тонком кишечнике.Образование смешанных мицелл.Продукты гидролиза липидов - жирные к-ты с длинным углеводородным радикалом, 2-моноацилглицеролы, холестерол, а также соли жёлчных к-т образуют в просвете кишечника смешанные мицеллы. гидрофобные части молекул обращены внутрь мицеллы, а гидрофильные - наружу, поэтому мицеллы хорошо растворяются. Мицеллы сближаются со щёточной каймой клеток слизистой оболочки тонкого кишечника, и липидные компоненты мицелл проходят ч\з мембраны внутрь клеток. Вместе с продуктами гидролиза липидов всасываются жирорастворимые витамины A, D, Е, К и соли жёлчных кислот.
Билет №12
1(14)Анаплеротические реакции цикла лимонной кислоты. Анаболическое значение
ЦТК- один из амфиболических путей метаболизма. В нём осуществляются не только окислительные превращения энергетических субстратов до конечных продуктов СО2 и Н2О, но и происходит образование субстратов для других метаболических путей. Некоторые промежуточные продукты цикла лимонной кислоты: α-кетоглутарат, сукцинат, оксалоацетат могут использоваться для синтеза заменимых аминокислот.
Убыль промежуточных продуктов цикла восполняется в реакциях, катализируемых специфическими ферментами. В н.у. реакции, отвлекающие промежуточные продукты из цикла и восполняющие их убыль, находятся в состоянии динамического равновесия, так что концентрация этих продуктов в митохондриях остаётся постоянной.
Реакции, обеспечивающие пополнение фонда промежуточных продуктов ЦТК, называются анаплеротическими (пополняющими). Важнейшая из них - реакция синтеза оксалоацетата из пирувата. Эту реакцию катализирует митохондриальный фермент - пируваткарбоксилаза.
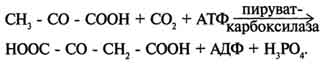
Пируваткарбоксилаза - сложный олигомерный фермент. Молекула фермента содержит 4 простетические группы, представленные биотином , который ковалентно связан амидной связью с е-аминогруппами остатков лизина, находящегося в активном центре фермента. Если для цикла лимонной кислоты не хватает оксалоацетата или какого-нибудь другого промежуточного продукта, то карбоксилирование пирувата ускоряется. В этой реакции в качестве источника энергии используется АТФ.
Реакция протекает в 2 стадии.
На первой стадии происходит активация СО2 путём присоединения к одному из атомов азота в молекуле биотина. Эта реакция сопряжена с гидролизом АТФ.
АТФ + СО2+ Е-биотин + Н2О → АДФ + Н3РО4 + Е-биотин-СОО- + 2 Н+.
На второй стадии активированная карбоксильная группа переносится на пируват.
Е-биотин-СОО" + Пируват -" Е-биотин + Оксалоацетат.
Пируваткарбоксилаза - регуляторный фермент. Если концентрация ацетил-КоА увеличивается, то он действует как аллостерический активатор пируваткарбоксилазы, ускоряя образование оксалоацетата. Таким образом, избыток ацетил-КоА способствует активации цитратного цикла. Метаболиты цитратного цикла используются не только как субстраты синтеза углеродного скелета ряда соединений, но и являются донорами водорода для образования восстановленных коферментов, участвующих в реакциях синтеза жирных кислот, стероидов и других веществ ). Два метаболита нитратного цикла могут дегидрироваться при участии NADP-зависимых дегидрогеназ: малата и изоцитрата. Например, малат может поступать из митохондрий в цитозоль клетки. В цитозоле находится NADP-зависимая дегидрогеназа (малик-фермент), катализирующая реакцию:

Малат и изоцитрат обеспечивают образование около половины общего фонда NADPH, используемого в восстановительных синтезах; вторая половина образуется в пентозофосфатном пути превращения глюкозы.
2(26) Аэробный распад глюкозы. Окисление глюкозы до СО2и Н2О (аэробный распад).Аэробный распад глюкозы можно выразить суммарным уравнением:
С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
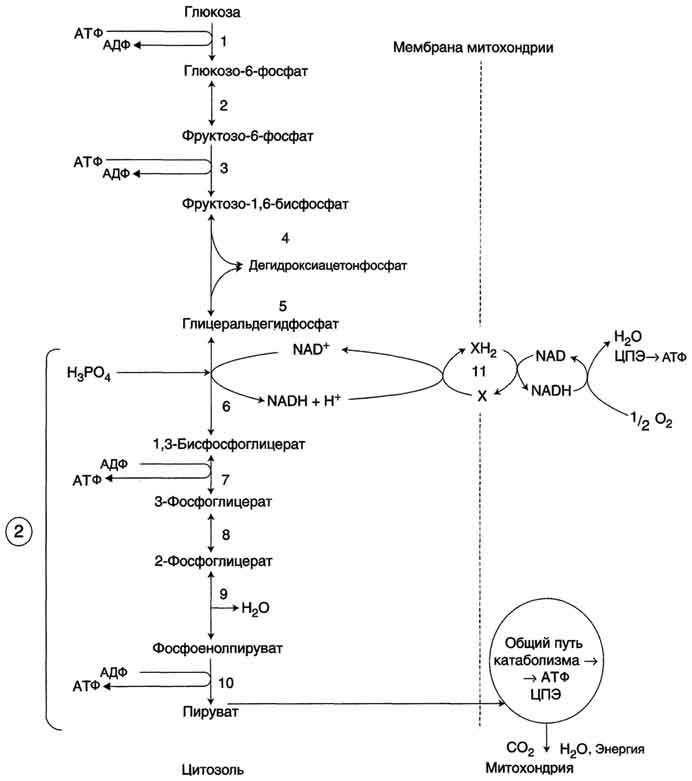
Аэробный распад глюкозы. 1-10- реакции аэробного гликолиза; 11 - малат-аспартатный челночный механизм транспорта водорода в митохондрии; 2 (в кружке) - стехиометрический коэффициент.


3(53) Кетоновые тела. Биосинтез, использование в качестве источника энергии. Биохимический механизм кетонемии и кетонурии.
При голодании, длительной физической работе и в случаях, когда клетки не получают достаточного количества глюкозы, жирные кислоты. используются многими тканями как основной источник энергии. В отличие от других тканей мозг и другие отделы нервной ткани практически не используют жирные кислоты в качестве источника энергии. В печени часть жирных кислот превращается в кетоновые тела, которые окисляются мозгом, нервной тканью, мышцами, обеспечивая достаточное количество энергии для синтеза АТФ и уменьшая потребление глюкозы. К кетоновым телам относят β-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел. Синтез кетоновых тел в печени. При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большем количестве, чем в норме, поэтому увеличивается скорость β-окисления (рис. 8-32). Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Синтез кетоновых тел начинается с взаимодействия двух молекул ацетил-КоА, которые под действием фермента тиолазы образуют ацетоацетил-КоА (рис. 8-33). С ацетоацетил-КоА взаимодействует третья молекула ацетил-КоА, образуя 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА). Эту реакцию катализирует фермент ГМГ-КоА-синтаза. Далее ГМГ-КоА-лиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА.
Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело - β-гидроксибутират путём восстановления.
В клетках печени при активном β-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата в β-гидроксибутират, поэтому основное кетоновое тело в крови - именно β-гидроксибутират. При голодании для многих тканей жирные кислоты и кетоновые тела становятся основными топливными молекулами. Глюкоза используется в первую очередь нервной тканью и эритроцитами.
При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, но выделяется с выдыхаемым воздухом и мочой. Таким путём организм удаляет избыточное количество кетоновых тел, которые не успевают окисляться, но, являясь водорастворимыми кислотами, вызывают ацидоз.
Кетоацидоз. В норме концентрация кетоновых тел в крови составляет 1-3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации кетоновых тел в крови называют кетонемией, выделение кетоновых тел с мочой - кетонурией. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсированному ацидозу), а в тяжёлых случаях - к сдвигу рН (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) являются водорастворимыми органическими кислотами (рК
3,5), способными к диссоциации:
СН3-СО-СН2-СООН ↔ СН3-СО-СН2-СОО- + Н+.
Ацидоз достигает опасных величин при сахарном диабете, так как концентрация кетоновых тел при этом заболевании может доходить до 400-500 мг/дл. Тяжёлая форма ацидоза - одна из основных причин смерти при сахарном диабете. Накопление протонов в крови нарушает связывание кислорода гемоглобином, влияет на ионизацию функциональных групп белков, нарушая их кон-формацию и функцию.

Билет №13
1(6) АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1
Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.
Комплекс F1 выступает в митоховдриальный матрикс. Он состоит из 9 субъединиц (Зα, 3β, γ, ε, δ). Субъединицы аир уложены попарно, образуя "головку"; между α- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ-, ε-, δ- субъединицы связывают комплекс F1 с F0.
Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμH+ заставляет протоны двигаться по каналу АТФ-синтазыв матрикс. Параллельно под действием ΔμH+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из АДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используют для синтеза одной молекулы АТФ.
2(24) Регуляция гликолиза и глюконеогенеза.
в печени могут происходить два противоположно направленных процесса - гликолиз и глюконеогенез. Переключение печени с гликолиза на глюконеогенез и обратно происходит с участием инсулина и глюкозагона и осуществляется с помощью: 1.) аллостерической регуляции активности ферментов; 2.) ковалентной модификации ферментов путём фосфорилирования/дефосфорилирования; 3.)индукции/репрессии синтеза ключевых ферментов.
"Субстратные" циклы - объединение реакций синтеза и распада субстрата.
Направление реакции первого субстратного цикла регулируется главным образом концентрацией глюкозы. При пищеварении концентрация глюкозы в крови повышается (до 8-10 ммоль/л). Активность глюкокиназы в этих условиях максимальна. Вследствие этого ускоряется гликолитическая реакция образования глюкозо-6-фосфата.
|
|
|
 Скачать 1.13 Mb.
Скачать 1.13 Mb.