Билет 1. Вопрос Ингалипт
 Скачать 11.63 Mb. Скачать 11.63 Mb.
|
|
Уничтожение наркотических средств и психотропных веществ. Производится в соответствии с Инструкцией по уничтожению наркотических средств и психотропных веществ, входящих в списки II и III Перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации, дальнейшее использование которых в медицинской практике признано нецелесообразным, утвержденной приказом Минздрава России от 31.01.2002 № 26. Наркотические средства и психотропные вещества, дальнейшее использование которых в медицинской практике признано нецелесообразным органами, осуществляющими их изъятие или конфискацию, подлежат уничтожению в полном объеме. Уничтожение осуществляется в следующих случаях: истек срок годности; вещество подвергалось химическому или физическому воздействию, следствием которого стала непригодность, исключающая возможность восстановления или переработки: неиспользованные наркотические средства, принятые от родственников умерших больных; когда трудно определить, является ли препарат наркотическим средством или психотропным веществом; конфискованное из незаконного оборота наркотическое средство или психотропное вещество, которое не может быть использовано в медицинских, научных или иных целях. Уничтожение этих препаратов можно проводить только в унитарных предприятиях или учреждениях, имеющих лицензию на уничтожение наркотических средств и психотропных веществ. Если юридическое лицо не имеет такой лицензии, но осуществляет Деятельность с их оборотом, то в случае необходимости уничтожения указанных Л С заключается договор с ГУП (учреждением), имеющим лицензию на право уничтожения, куда Л С передаются по приемо-сдаточному акту. Билет 15JBonpoc I. Sulfacetamide Sodium — сульфацетамид натрия (Сульфацил-натрий) 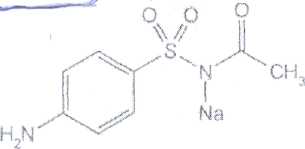 n-аминобензолсульфонилацетамид-натрий моногидрат Белый кристаллический порошок без запаха К ' Натриевые соли сульфаниламидов (сульфацетамид натрия) легко растворимы в воде и метаноле (при комнатной температуре) и практически нерастворимы или мало растворимы в других органических растворителях (этаноле, эфире, хлороформе, ацетоне). Растворимость в кислотах и растворах щелочей обусловлена амфотерными свойствами большинства сульфаниламидов. Они проявляют основные свойства, так как в молекуле имеется ароматическая . аминогруппа. Поэтому сульфаниламиды, как правило, могут растворяться в кислотах с образованием солей (сильно гидролизованных в растворах): 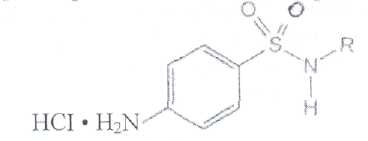 Кислотные свойства у сульфаниламидов выражены сильнее, чем основные. Они обусловлены наличием в молекуле группы -SO2-NH-, содержащей подвижный атом водорода. Вследствие этого сульфаниламиды образуют с щелочами соли: 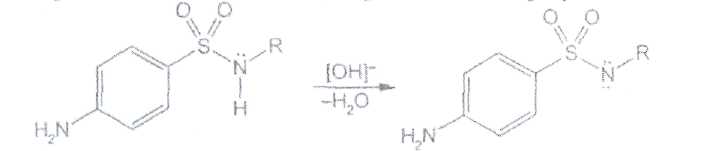 Поэтому все они легко растворяются в растворах щелочей. В ФС включены способы идентификации сульфаниламидов по УФ-спектрам поглощения. УФ-спектр 0,001%-ного раствора сульфацетамида натрия имеет максимум поглощения при 256 км и минимум — при 227 нм. УФ-спектры растворов сульфаниламидов широко применяются для идентификации и количественного спектрофотометрического определения сульфаниламидов с использованием таких растворителей, как вода. 0,01 Ми 0.002 М растворы гидроксида натрия. 0.1 М раствор хлороводородной кислоты и др. Например, в водных растворах определяют при 258 нм сульфацетамид натрия, а сульфадиметоксин спектрофотометрируют при длине волны 270 нм (растворитель 0,002 М раствор гидроксида натрия). Для испытаний подлинности сульфаниламидов используют общие и частные реакции, обусловленные наличием тех или иных функциональных групп в молекулах. Реакция образования азокрасителн. Это общая реакция не только на сульфаниламиды, но и на все соединения, содержащие в молекуле незамещенную первичную ароматическую аминогруппу. Реакция основана на образовании хлорида диазония в результате действия раствором нитрита натрия и разведенной хлороводородной кислотой. Последующее сочетание хлорида диазония в щелочной среде с фенолами приводит к образованию азокрасителя. Известно очень большое число азосоставляющих. ГФ рекомендует для выполнения этой реакции щелочной раствор в-нафтола: 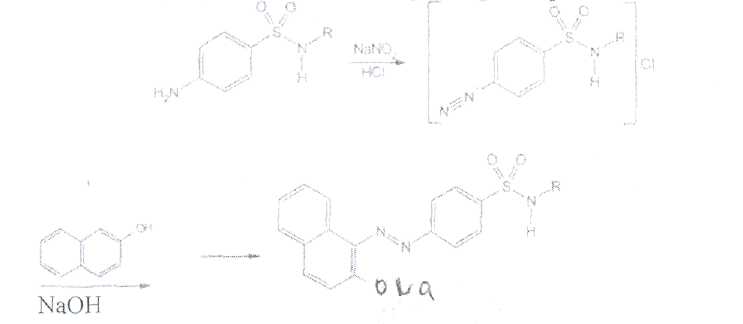 В результате реакции появляется вишнево-красное окрашивание или образуется осадок оранжево-красного цвета. Реакции конденсации. Как и производные п-аминобензойной кислоты, сульфаниламиды образуют в щелочной среде продукты конденсации с 2,4-динитрохлорбензолом (желтого цвета) _ ih  и в кислой среде окрашенные продукты конденсации с альдегидами типа шиффовых оснований. В качестве реактивов используют п"-диметиламинобензальдегид (желтое или оранжевое окрашивание), ванилин (желтое), формальдегид (желто-оранжевое или розовое), уксуснокислый раствор фурфурола (красное или малиново-красное). 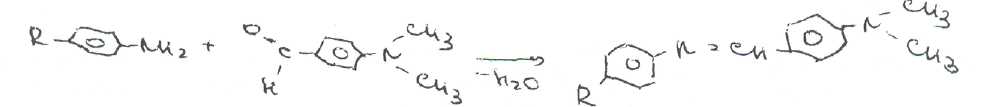 Лигниновая проба. Своеобразной разновидностью реакции образования шиффовых основании является лигнииовая проба, используемая для экспресс-анализа. Она выполняется на древесине или газетной бумаге, при нанесении на которую сульфаниламида (или другого первичного ароматического амина) и капли разведенной хлороводородной кислоты появляется оранжево-желтое окрашивание. Сущность происходящего химического процесса в том, что из лигнина образуются ароматические альдегиды: и-оксибензальдегид, сиреневый альдегид, ванилин (в зависимости от вида лигнина). Альдегиды взаимодействуют с первичными ароматическими аминами, образуя шиффовы основания: 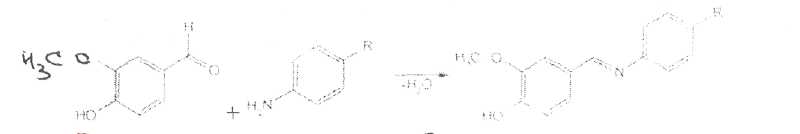 геакции галогенирования. сгги реакции основаны на наличии донорнои группы в ароматическом ядре молекулы сульфаниламида (заместитель первого рода): Г) 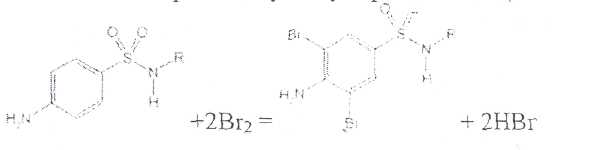 Реакции галогенирования могут быть использованы как для качественного анализа (образование осадков дибром- или дииодпроизводных), так и для количественного (броматометрического, иодометрического, иодхлорометрического) определения сульфаниламидов. Реакция обнаружения серы. Наличие серы в молекуле сульфаниламидов, как и в других содержащих серу соединениях, можно установить после окисления органической части молекулы концентрированной азотной кислотой или сплавления с 10-кратным количеством нитрата калия до сульфат-иона. Последний затем обнаруживают с помощью раствора хлорида бария. 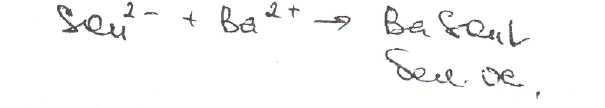 Реакции окисления При окислении сульфаниламидов как ароматических аминов образуются окрашенные соединения. Окисление может проходить под действием кислорода воздуха, особенно в растворах. Так, быстрое пожелтение раствора сульфаци л-натрия свидетельствует о появлении окрашенных продуктов окисления. Степень окисления сульфаниламидов (появление окрашенных соединений) регламентируется ГФ X путем определения цветности растворов. Так, в анализе чистоты сульфацил-натрия проводится определение степени окраски его раствора определенной концентрации, которая не должна превышать окраску эталона цветности № 5а. Реакции окисления (кислород, свет, углекислый газ) При окислении сульфаниламидов как ароматических аминов образуются окрашенные соединения. Окисление может проходить под действием кислорода воздуха, особенно в растворах. Так, быстрое пожелтение раствора сульфацил-натрия свидетельствует о появлении окрашенных продуктов окисления. Степень окисления сульфаниламидов (появление окрашенных соединений) регламентируется ГФ X путем определения цветности растворов. Так, в анализе чистоты сульфацил-натрия проводится определение степени окраски его раствора определенной концентрации, которая не должна превышать окраску эталона цветности № 5а. Установлено, что при этом образуются окрашенные соединения хиноидной структуры типа индофенолов. Лл< S"n*, 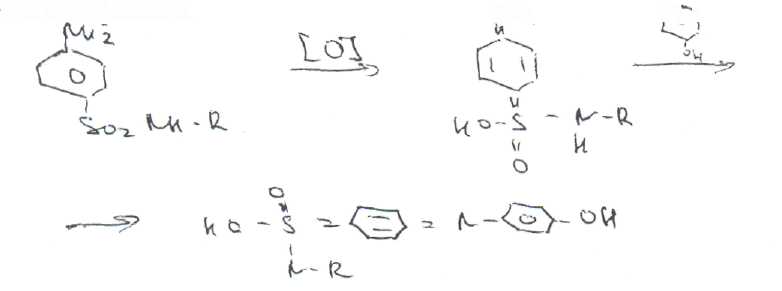 Реакция с растворами солей тяжелых металлов. Ряд ионов тяжелых металлов (меди, кобальта, железа, серебра и др.), замещая подвижный атом водорода сульфамидной группы, образуют с сульфаниламидами внутрикомллексные соединения. Нерастворимые комплексы меди (И) и кобальта (II) имеют различную окраску. Реакции следует выполнять в нейтральной среде, чтобы не допустить образования осадков гидроксидов указанных катионов. Раствор сульфата меди образует с сульфаниламидом (стрептоцидом) зеленоватый с голубым оттенком осадок, с норсульфазолом грязнофиол. комплекс в отличие от стрептоцида. 2CuSO4 + 2NH2OH—--> Cu2SO4 + N2 + H2SO4 + 2Н2О  Частные реакции на сульфаниламиды. К числу таких реакций следует отнести обнаружение (по запаху) уксусной кислоты при кислотном гидролизе сульфацетамида натрия. о  Для отличия натриевых солей от соответствующих сульфаниламидов выполняют реакцию на ион натрия (окраска бесцветного пламени горелки в желтый цвет). Сульфацетамид натрия при действии уксусной кислотой выделяет белый осадок сульфацетамида, который после высушивания должен иметь температуру плавления около 183°С: 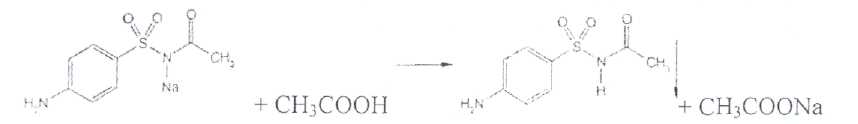 При растворении осадка в этаноле и добавлении концентрированной серной кислоты образуется этилацетат, имеющий характерный запах: 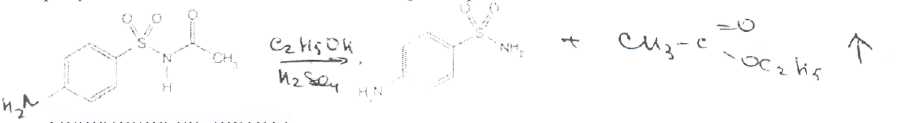 Испытания на чистоту В сульфаниламидах определяют отсутствие или предельное содержание допустимы? ■личеств органических примесей, сульфатов, хлоридов, сульфатной золы и тяжелы? :таллов, контролируют рН среды (кислотность или щелочность), прозрачность, цветност] створов. Гидраты (сульфацетамид натрия), подвергают проверке на потерю в массе upiюушивании. Для испытания на посторонние органические примеси используют ТСХ н; :астинках Силуфол или Армсорб УФ-254. После хроматографирования в условиях введенных в ФС, должно просматриваться только одно пятно, соответствующе* андартному образцу свидетеля. Содержание примесей определяют по величине \ [тенсивности пятен соответствующих свидетелей, нанесенных на ту же пластинку ;танавливают также микробиологическую чистоту сульфаниламидов (ГФ XI, в. 2, с. 193). Методы количественного определения Нитритометрия. Этот метод рекомендован НД для количественного определения сульфаниламидов, являющихся первичными ароматическими аминами. Определение основано на способности первичных ароматических аминов образовывать в кислой среде диазосоединения:  В качестве титранта используют нитрит натрия (0,1 М раствор). Титруют в присутствии бромида калия при 18-20°С или при 0-10°С. Бромид калия катализирует процесс диазотирования, а охлаждение реакционной смеси позволяет избежать потерь азотистой кислоты и предотвратить разложение соли диазония. Точку эквивалентности можно установить одним из трех способов: с помощью внутренних индикаторов (тропеолин 00,нейтральный красный, смесь тропеолина 00 с метиленовым синим); внешних индикаторов (иодкрахмальная бумага) или потенциометрически. Натриевые соли сульфаниламидов можно титровать кислотой в спирто-ацетоновой среде (инд. метиловый оранжевый): 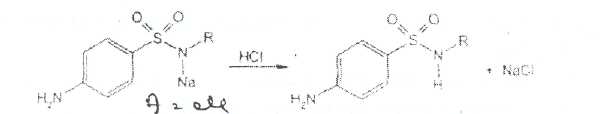 Ьроматометрия. Метод основан на реакции галогенирования сульфаниламидов. 1итруют раствором бромата калия в кислой среде в присутствии бромида калия. Конечную точку устанавливают при прямом титровании по обесцвечиванию (бромом) индикатора метилового оранжевого, а при обратном титровании иодо-метрически: КВЮ + 5КВг + 6HCI-—> ЗВг2 + 6KCI + ЗН2О 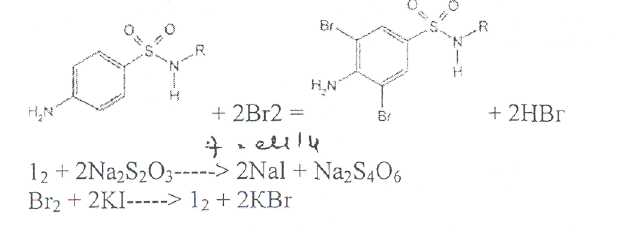 Иодхлорометрия. Как и броматометрия метод основан на реакции галогенирования. Иодирование осуществляют с помощью титрованного раствора иодмонохлорида. Избыток последнего устанавливают иодометрически: 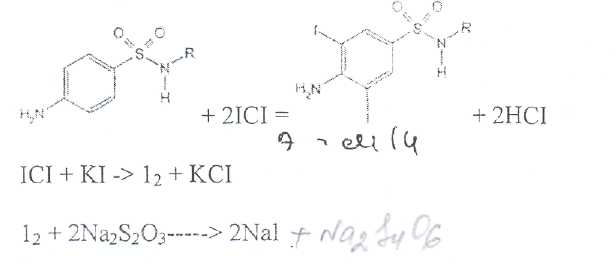 Методы ФЭКМ, основанные на цветных реакциях образования азокрасителей с использованием таких азосоставляющих, как хинозол, резорцин, ° *-^  Для идентификации и количественного определения сульфаниламидов может быть использован один из наиболее информативных методов — спектроскопия ПМР. Оптимальным для получения ПМР-спектров является 5%-ный раствор NaOD в D2O. Для всех сульфаниламидов являются характеристическими дублеты протонов бензольного цикла (п-аминобензолсульфониламидной группы) в области 6,7-8,2 м.д с суммарной интенсивностью 4 Н. В фармацевтическом анализе используют характеристические дублеты протонов бензольного цикла для алифатических (R) производных, а сигналы поглощения протонов гетероциклов и их заместителей — для сульфаниламидов, имеющих гетероциклическую и ароматическую структуру.Для обнаружения и количественного" определения сульфаниламидов, в т.ч. в биологических жидкостях, применяют метод ТСХ и метод ВЭЖХ с использованием подвижной фазы, состоящей из воды, метанола и фосфатного буферного раствора (рН 4,9), Хранение и применение Псе сульфаниламиды хранят по списку Б в хорошо укупоренной таре (стеклянных банках с притертыми пробками). Некоторые из них представляют собой гидраты и при несоблюдении условий хранении постепенно теряют воду, что может привести к изменению физических свойств (сульфацетамид натрия). При хранении сульфаниламидов происходит их разложение под действием света и кислорода воздуха. Чаще всего оно сопровождается реакцией гидролиза с образованием сульфаниловой кислоты и других веществ, которые затем окисляются. При окислении получаются азосоединения: азобензол-4,4'-дисульфонамид, азооксибензол-4,41- дисульфонамид, азооксибензол-дисульфоновая кислота и др. Поэтому сульфаниламиды на свету темнеют, а их растворы желтеют. 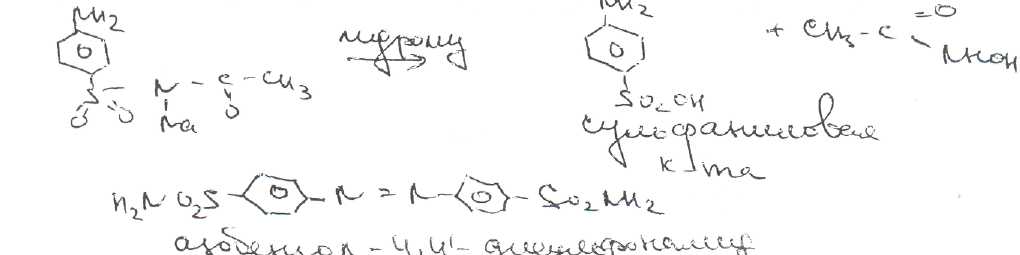 Сульфаниламидные препараты относятся к числу химиотерапевтических (антибактериальных) средств, Их применяют для лечения инфекционных заболеваний, вызываемых стрептококками, гонококками, менингококками, пневмококками, стафилококками, кишечной палочкой и др. Сульфацетамид натрия назначают в офтальмологической практике в виде 20-30%-ных растворов и мазей при конъюктивитах. Стабильность. Тепловая стерилизация и длительное хранение растворов в стеклянной таре могут привести к разрушению многих лекарственных веществ вследствие гидролиза, окисления и других процессов. Стабилизация может быть обеспечена добавлением веществ, регулирующих рН среды, антиоксидантов и консервантов. Основными способами стабилизации глазных капель являются регулирование значений рН и введение в состав растворов, содержащих легкоокисляющиеся вещества, антиоксидантов. Для регулирования значения рН используются буферные растворители. В качестве антиоксидантов: натрия сульфит, натрия метабисульфит и трилон Б. Сульфацил-натрий (20-—30%). Сульфацил-натрий (гаря-аминобензолсульфацетамид натрий) в виде растворов различной концентрации (10—30%) используется в офтальмологической практике в качестве высокоэффективного средства при стрептококковых, гонококковых и колибациллярных инфекциях. Однако нестойкость сульфацил-натрия в водных растворах создает значительные трудности при широком его применении в клинике в жидких лекарственных формах и представляет серьезную технологическую проблему в случае необходимости широкомасштабного заводского производства препарата в виде глазных капель. Повышая устойчивость препарата при хранении в водные растворы сульфацил-натрия вводят специальные стабилизаторы и антиокислители. Однако такой путь не позволяет полностью решить проблему серийного выпуска этого препарата,- поскольку на процессы деструкции сульфацил-натрия значительное влияние оказывают различные факторы внешней среды (температура, радиация, наличие кислорода воздуха и т,. д.), интенсивность воздействия которых часто находится в определенной зависимости от вида упаковки и ее материала.В качестве растворителя для приготовления 20% раствора сульфацил-натрия была использована вода для инъекций. Растворы готовили весообъемным способом как с добавлением, так и без добавления стабилизаторов. Фильтровали растворы через стерильные фильтры. Для определения необходимой чистоты раствора проводили предварительную осветляющую, а затем стерилизующую фильтрации через пластины ЕК-1 в стерильный сосуд из нержавеющей стали, где раствор сохранялся до розлива в стерильные тюбик-капельницы на герметически закрытой автоматической линии. Определение соответствия партий препарата требованиям фармакопейной статьи проводили как сразу после их выработки, так и в процессе хранения. Наиболее оптимальный способ, обеспечивающий стабильность 20% раствора сульфацил-натрия — использование в качестве стабилизатора трилона Б (0,05%). В этом случае раствор препарата остается стабильным, независимо от вида обработки тюбик-капельниц. В целях более надежной стабилизации 30% раствора сульфацил-натрия в тюбик-капельницах используют следующий стабилизатор: 0,15% тиосульфата натрия и 3,5 мл 1 н раствора соляной кислоты на 1 л раствора.
О.1н раствор кислоты хлористоводородной, нейтрализующей щелочь, выделяемую стеклом, и смещает рН раствора в кислую сторону. Это создает условия, препятствующие гидролизу, омылению сложных эфиров, окислению фенольных и альдегидных групп. Количество кислоты, необходимое для стабилизации раствора, зависит от свойств лекарственного вещества. Натрия тиосульфат-антиоксидант, относится к веществам, разрушающим гидро пер оксиды. Не останавливают цепной процесс окисления, но, снижая скорость разветвления цепей, замедляют окислительные реакции. Тормозящее действие таких восстановителей тем сильнее, чем выше скорость реакции этих веществ с гидропероксидами. Вопрос 2. Качество глазных капель, изготовляемых в аптеке регламентированы приказом №214, изготовляемых в промыш. уел - правила GMP. Наиважнейшие показатели качества глазных капель: 1) стерильность; 2) стабильность (химическая и антимикробная); 3) достаточно длительная терапевтическая активность; 4) комфортность применения; 5) отсутствие механических включений; 6) определенные условия и методы хранения и упаковки, гарантирующие сохранение стерильности, стабильности, а также удобство применения. |
