биодоступность. Биологическая доступность почти готово. Биологическая доступность это скорость и степень, с которой лекарственный
 Скачать 178.04 Kb. Скачать 178.04 Kb.
|
Способы изучения биодоступностиФармакокинетика использует различные методы изучения закономерностей всасывания лекарственных веществ в желудочно-кишечном тракте, которые подраз- деляют на методы in vivo, in situ, in vitro. Следует подчеркнуть, что как скорость всасывания, так и степень биодоступ- ности относятся к процессу поступления лекарственного вещества в системный кровоток, а не к процессу высвобождения лекарственного вещества из лекарственой формы. Это особенно важно учитывать в случае энтерального введе- ния лекарственного вещества, когда процесс поступления в системный кровоток яв- ляется сложным и многостадийным. Он включает в себя дезинтеграцию лекарствен- ной формы, растворение действующего начала в жидком содержимом, проникнове- ние через слизистую, транспортировку в печень и прохождение через нее. В связи с этим можно с полной определенностью сказать, что методы тестирование препара- тов in vitro не могут в принципе рассматриваться как универсальные методы изуче- ния биодоступности. Наблюдаемые во многих случаях корреляции между парамет- рами БД и характеристиками, полученными in vitro, носят, как правило, частный ха- рактер. Аналогично исследования «всасывания» препаратов в желудочно-кишечном тракте in situ не могут дать информации о поведении лекарственного вещества в ре- альных условиях in vivo, так как эти экспериментальные модели не учитывают первого прохождения лекарственного через печень, которое влияет как на степень, так и на скорость поступления лекарственного вещества в системный кровоток. Методы “in vivo”а)Определениестепенибиодоступности Количество лекарственного веществаа, всосавшееся за все время Аа () в идеале должно быть равно введенной дозе D. Однако в действительности возможны потери, например, вследствии ферментных процессов в печени, экскреции с калом и др. В результате количество всосавшегося вещества за все время t - Аа (), как правило, меньше D: Аа () = F D, где F<1. Таким образом, фактор F характеризует степень биодоступности. Для исследуемой лекарственной формы количество всосавшегося препарата в кровь: А=FхDх Для стандартной лекарственной формы количество препарата, всосавшегося в кровь: А=FсDс Степень биологической доступности выражается уравнением: CБД Fx 100% . FC Наиболее часто биологическую доступность определяют как процентное от- ношение количества неизменного лекарственного вещества, поступившего в системный кровоток за определенный интервал времени из исследуемой лекарственной формы, к количеству вещества, поступившего в кровь за такое же время из стандартной лекарственной формы. При этом условия проведения биологического эксперимента и дозы лекарственного вещества должны быть одинаковыми или близкими. Наиболее точная оценка степени биодоступности может быть получена лишь при одновременном введении изучаемой лекарственной формы и внутрисосудистом введении. При этом одна из доз метится радиоактивным или стабильным изотопом, что дает возможность, применяя специально аналитическую технику (например, масс-спектрометрию), определять раздельно концентрации, создаваемые той или иной дозой. Однако этот метод не универсален, поскольку получение меченого лекарственного вещества не всегда возможно и сложно. б)Оценкастепенибиодоступности сприменениемоднократнойдозы 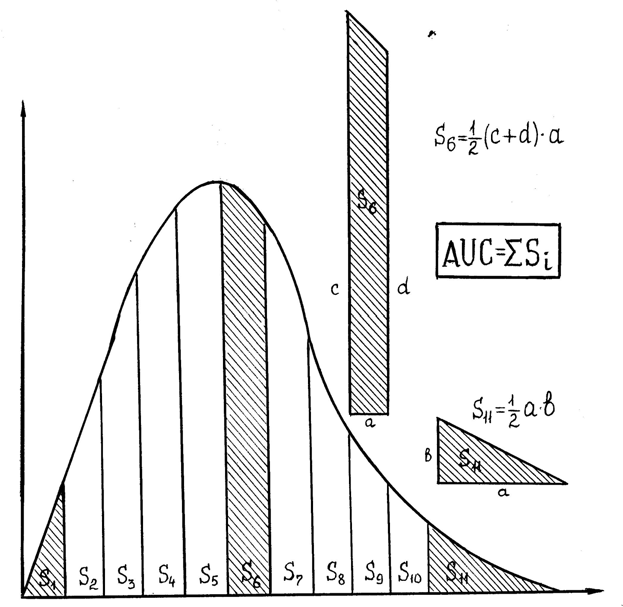 Рис. 7. Определение площади кривой фармакокинетики. При различных путях внесосудистого введения лекарственного вещества при оценке степени биодоступности определяют величину отношения площади под фармакокинетической кривой исследуемой лекарственной формы к площади под кривой стандартной лекарственной формы (рис. 6): СБД DCAUCX100% , где DX AUCC Dc и Dx – соответственно дозы веществ в исследуемой и стандартной лекарст- венных формах; AUCx – площадь под фармакокинетической кривой для исследуемого вещества и изучаемой лекарственной форме; AUCc - площадь под фармакокинетической кривой для этого же вещества в стандартной лекарственной форме. При равных дозах степень биодоступности: СБД AUCX100% . AUCC Проводя два полных фармакокинетических исследования: одно – после введе- ния изучаемого препарата, другое – после внесосудистого введения стандартной ле- карственной формы рассчитывают относительную биодоступность. Абсолютную степень биодоступности определяют по тем же уравнениям, под- ставляя в них вместо данных, относящихся к введению стандартной лекарственной формы, данные, полученные после внутрисосудистого введения (когда это возмож- но) лекарственной формы. в)Оценкастепенибиодоступностисприменениемповторяющихсядоз Для правильной оценки степени БД лекарств, предназначенных для длитель- ного применения, проводят исследование с повторными дозами. Этот метод пред- почтительнее в условиях клиники. Пробы на анализ при этом методе можно получать лишь после того, как будет достигнута устойчивая концентрация вещества в крови, обычно после введения 5-10 доз и зависит от полупериода нахождения вещества в организме. В этом случае оп- ределяют максимальную концентрацию для стандартной лекарственной формы, а затем, через установленный интервал времени назначают вещество в исследуемой лекарственной форму и определяют максимальную концентрацию в крови. Расчет степени бидоступности ведут по формуле: CБД CXmaxDCTX100% , где CCT max DX TC Сх- максимальная концентрация для исследуемого препарата; Сст – максимальная концентрация для стандартного препарата; Dх и Dс – дозы соответствующих препаратов; Тх и Тс – время достижения максимальной концентрации после назначения ис- следуемой и стандартной формы. Степень биологической доступности здесь может быть рассчитана и с исполь- зованием площади под кривой или значений максимальных концентраций. Площаль под кривой в этом случае измеряется в течение только одного интервала между до- зами после достижения устойчивой концентрации, например, на рис. 7 - S6. Положительной стороной назначения повторяющихся доз вещества является сравнительно высокое содержание вещества в крови, что облегчает проведение ана- литических определений и повышает их точность. г)Оценкастепенибиодоступностипоопределениюсодержаниявыделяемого смочой веществаили егометаболитов Определение степени биологической доступности по содержанию выделяемо- го с мочой вещества предусматривает выполнение ряда условий: выделение хотя бы части вещества в неизмененном виде; полное и тщательное опорожнение мочевого пузыря при каждом заборе проб; время сбора мочи, как правило, равняется 7-10 полупериодам нахождения препарата в организме. Именно за этот период успевает выделиться из орг- низма 99,9% введенного лекарственного вещества. Желательны наиболее частые заборы проб на анализ, так как это позволяет более точно опреде- лить концентрацию вещества, расчет степени биодоступности ведут по формуле: СБД BX DC 100% , где BC DX В - количество выделенного с мочой неизмененного вещества после назначения ис- следуемой (х) и стандартной (с) лекарственной формы; Dх и Dс – дозы соответствующих препаратов. |
