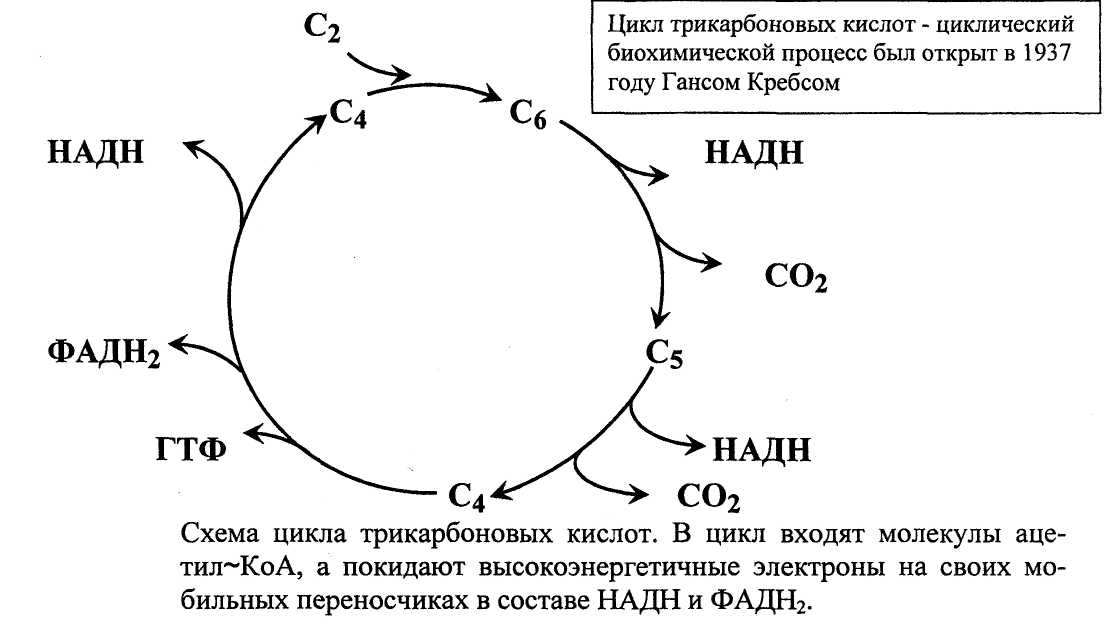
Цикл трикарбоновых кислот
В 1953 г. Кребсу была присуждена Нобелевская премия по физиологии и медицине «за открытие цикла лимонной кислоты» (1937г.). В поздравительной речи было сказано: «Цикл Кребса объясняет два одновременно происходящих процесса: реакции распада, при которых высвобождается энергия, и синтетические процессы, при которых эта энергия расходуется». Ученый, завершая речь «экскурсом в общую биологию», проанализировал более широкое значение этих открытий: «Наличие одного и того же механизма образования энергии у всех живых существ позволяет сделать еще два вывода, – сказал он. – Во-первых, этот механизм возник на очень ранних этапах эволюции, и, во-вторых, жизнь в ее настоящем виде зародилась лишь однажды».

Образующийся в ПВК-дегидрогеназной реакции ацетил-SКоА далее вступает в цикл трикарбоновых кислот (ЦТК, цикл лимонной кислоты, цикл Кребса). Кроме пирувата, в цикл вовлекаются кетокислоты, поступающие из катаболизма аминокислот или каких-либо иных веществ.
Цикл протекает в матриксе митохондрий и представляет собой восемь последовательных реакций: связывание ацетила и оксалоацетата (щавелевоуксусной кислоты) с образованием лимонной кислоты, изомеризация лимонной кислоты и последующие реакции окисления с сопутствующим выделением СО2. После восьми реакций цикла вновь образуется оксалоацета.
Основная роль ЦТК:
генерации атомов водорода для работы дыхательной цепи, а именно трех молекул НАДН и одной молекулы ФАДН2.
Кроме этого, в ЦТК образуется
одна молекула АТФ,
сукцинил-SКоА, участвующий в синтезе гема,
кетокислоты, являющиеся аналогами аминокислот – α-кетоглутарат для глутаминовой кислоты, оксалоацетат для аспарагиновой.
Цикл лимонной кислоты — заключительный этап катаболизма, локализованный в матриксе митохондрий. В нем 4-х углеродное соединение оксалоацетат конденсируется с 2-х углеродным ацетильным компонентом, которое вносит в процесс молекула ацетил-КоА, с образованием 6-ти углеродной трикарбоновой кислоты - цитрата. Далее изомер цитрата подвергается окислительному декарбоксилированию. Образующееся при этом 5-ти углеродное соединение а-оксоглутарат (а-кетоглутарат) при окислительном декарбоксилировании превращается в 4-х углеродное соединение сукцинат. Дальнейшие превращения сукцината приводят к регенерированию 4-х углеродного оксалоацетата.
Поэтому одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков.
2 атома углерода включаются в цикл в виде ацетильного компонента и 2 атома углерода покидают цикл в виде 2 молекул СО2.
Таким образом, двухуглеродный фрагмент молекулы ацетил-КоА подвергается полному окислению. Электроны, ранее принадлежащие молекуле ацетилКоА, покидают цикл в связанной форме: в виде 3 молекул НАДН и
1 ФАДН2. Затем они переносятся в процесс окислительного фосфорилирования, где энергия каждой пары электронов переносимых НАДН, преобразуется в энергию макроэргических связей до 3 молекул АТФ. А энергия пары электронов переносимых ФАДН2, ведет к образованию до 2 молекул АТФ. Всего в процессе окислительного фосфорилирования при окислении этих переносчиков электронов образуется до 11 молекул АТФ.
1 макроэргическая связь генерируется в самом цикле в форме молекулы ГТФ или АТФ.
Итого, теоретически до 12 молекул АТФ может быть генеририровано при окислении 2-х углеродного фрагмента ацетил-КоА в цикле трикарбоновых кислот сопряженном с процессом окислительного фосфорилирования.
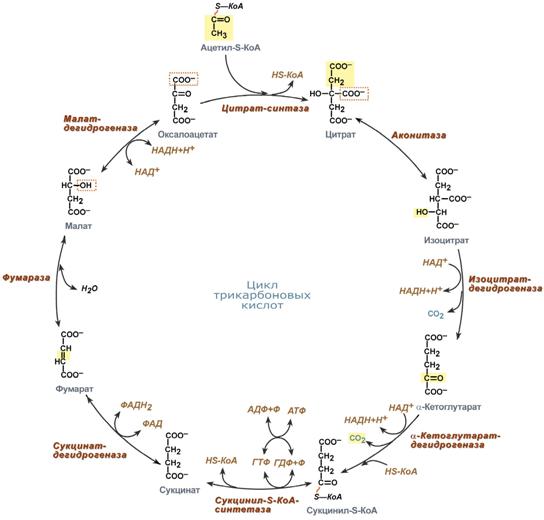
Реакции цикла трикарбоновых кислот
Р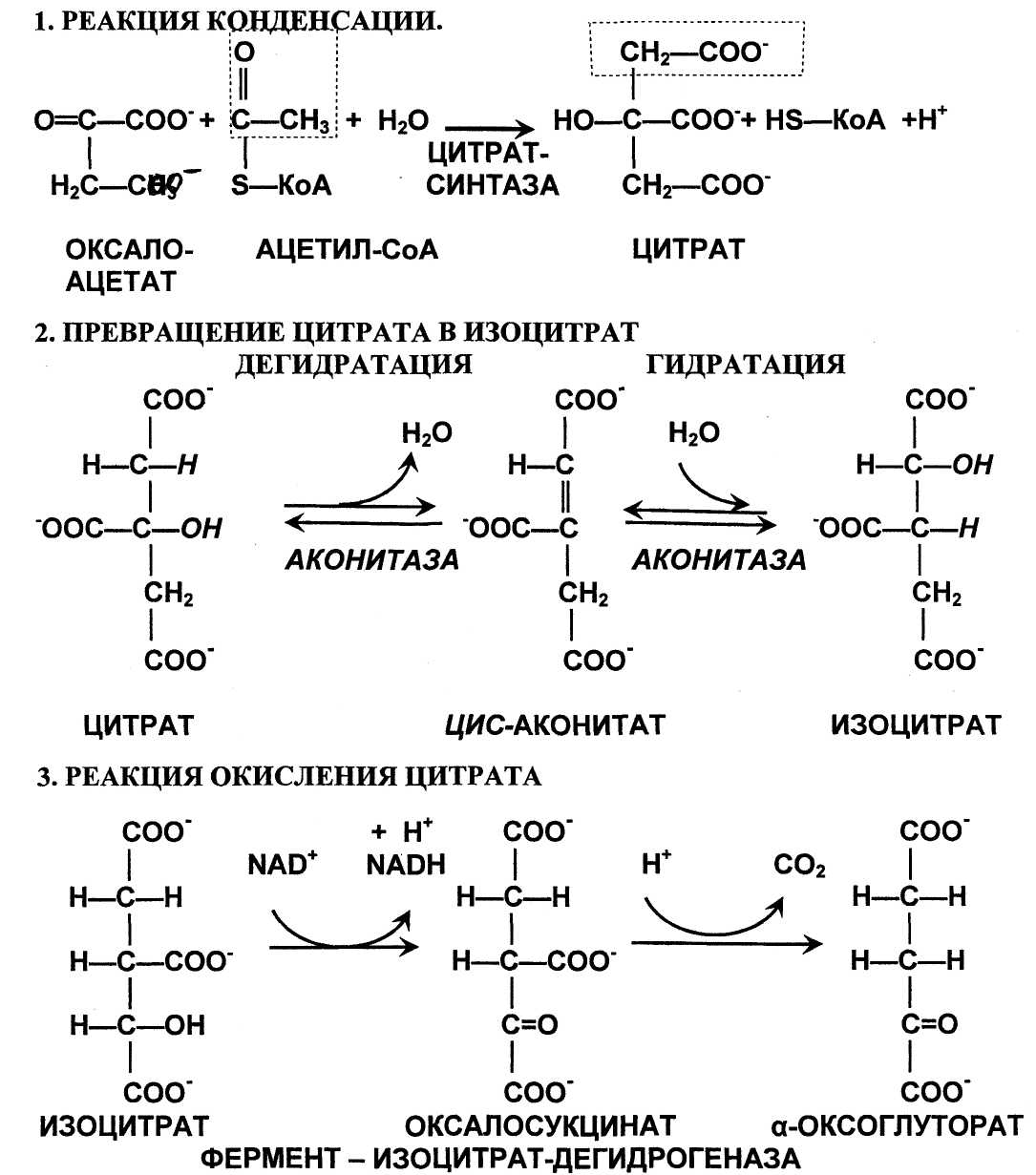

еакция образования цитрата (лимонной кислоты): альдольная конденсация с последующим гидролизом, катализирует цитрат-синтаза. При расщеплении тиоэфирной связи освобождается коэнзим А, и выделяется значительная тепловая энергия. Равновесие в реакции сильно сдвинуто вправо.

Превращение цитрата в изоцитрат. Изомеризация цитрата осуществляется
путем дегидратации с последующей гидратацией. В результате происходит
взаимоперемещение Н и ОН. Фермент назван аконитазой, поскольку промежуточное соединение цис-аконитат не покидает активный центр фермента.

Реакция окислительного декарбоксилирования изоцитрата катализируется изоцитрат-дегидрогеназой и ведет к образованию а-оксоглутарата (а-кетоглутарата). НАД+ в реакции играет роль второго субстрата, захватывая пару высокоэнергетичных электронов, и в форме НАДН вовлекает их в процесс окислительного фосфорилирования. Самая медленная реакция цикла. Аллостерически активируется АДФ.
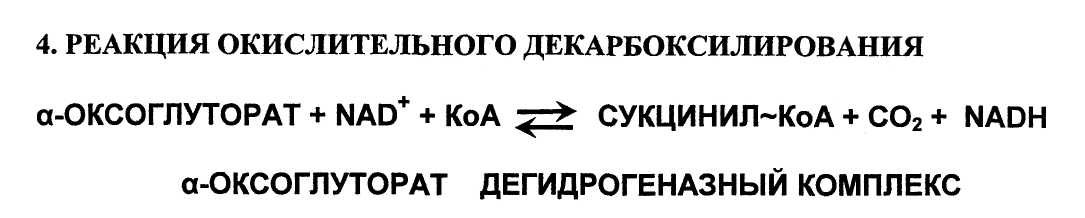
Реакция катализируется а-оксоглутарат дегидрогеназным комплексом (мультиферментный комплекс), который структурно и функционально сходен с пируват дегидрогеназным комплексом. Механизм этой реакции сходен с механизмом превращения пирувата в ацетил-КоА. В состав комплекса также входят 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота, ФАД, НАД+ и КоА. а-Оксоглутарат дегидрогеназный комплекс отличается от пируват дегидрогеназного комплекса тем, что в нем отсутствует сложная система регуляции активности. Равновесие реакции сильно сдвинуто вправо, в сторону образования сукцинил
КоА. Биохимическое значение реакции состоит в удалении карбоксильной группы (—СОО-) поскольку атом углерода в ней почти полностью окислен, и извлечь из неё электроны высокой энергии невозможно. Из неё можно извлечь всего 2е".
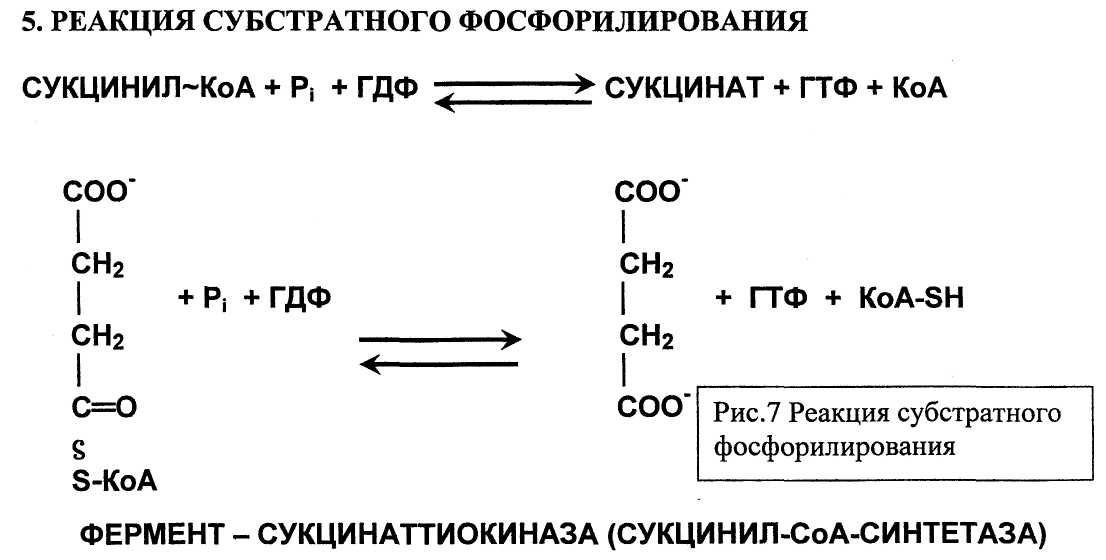
ФЕРМЕНТ – СУКЦИНАТТИОКИНАЗА (СУКЦИНИЛ-Со-СИНТЕТАЗА)
В этой реакции для синтеза ГТФ используется энергия молекулы сукцинил-КоА. Энергия разрыва тиоэфирной связи в молекуле сукцинил-КоА на 9% превышает ту энергию, которая необходима для фосфорилирования ГДФ с образованием ГТФ. Поэтому реакция легко обратима. Однако равновесие процесса сдвинуто вправо, поскольку ГТФ далее входит в реакцию переноса своей фосфатной группы на АДФ с образованием АТФ, который расходуется в клеточных процессах.
ГТФ + АДФ «-> ГДФ + АТФ
Эту реакцию катализирует нуклеозидфосфаткиназа. На этом заканчивается первая стадия цикла трикарбоновых кислот.
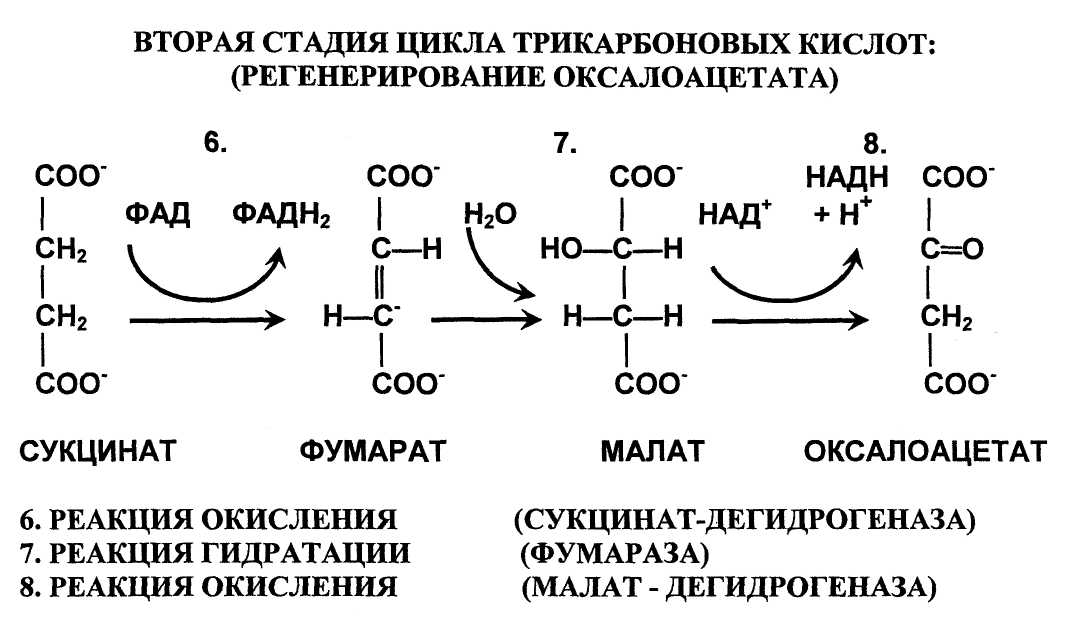


Фермент сукцинат-дегидрогеназа, действующий в 6 реакции - флавопротеин,
содержащий ковалентно присоединенный ФАД в своем активном центре. В отличие от других ферментов цикла трикарбоновых кислот сукцинат-дегидрогеназа прочно закреплена во внутренней митохондриальной мембране. Фермент состоит из двух субъединиц, одна из которых содержит ФАД. В состав двух субъединиц включены железо-серные центры. В одной субъединице в форме - Fe2S2, а в другой в форме - Fe4S4. Оба железо-серных центра сопряжены с компонентами дыхательной цепи и участвуют в транспорте электронов.
Реакцию гидратации катализирует фермент фумарат-гидратаза (фумараза), локализованный в матриксе митохондрий. Особенностью реакции является абсолютная субстратная специфичность этого фермента. Фермент катализирует гидратацию только транс-формы фумарата.
 Заключительную реакцию цикла трикарбоновых кислот катализирует НАД-зависимая малат-дегидрогеназа, локализованная в митохондриальном матриксе. Особенность реакции состоит в том, что в ней равновесие сильно сдвинуто влево. Поскольку оксалоацетат, синтезируемый в этой реакции постоянно расходуется на образование цитрата (цитрат-синтазная реакция), то в интактных клетках равновесие в этой реакции сдвинуто вправо. Заключительную реакцию цикла трикарбоновых кислот катализирует НАД-зависимая малат-дегидрогеназа, локализованная в митохондриальном матриксе. Особенность реакции состоит в том, что в ней равновесие сильно сдвинуто влево. Поскольку оксалоацетат, синтезируемый в этой реакции постоянно расходуется на образование цитрата (цитрат-синтазная реакция), то в интактных клетках равновесие в этой реакции сдвинуто вправо.
Зависимость цикла трикарбоновых кислот от недостатка кислорода
Несмотря на то, что ни в одну реакцию ЦТК кислород не входит, существует очень сильная зависимость цикла трикарбоновых кислот от недостатка кислорода. В основе этой зависимости прочная функциональная связь между циклом трикарбоновых кислот и процессом окислительного фосфорилирования. Цикл трикарбоновых кислот производит электроны высокой энергии для процесса окислительного фосфорилирования, которые отправляет в него на мобильных переносчиках - молекулах НАДН и ФАДН2. В процессе окислительного фосфорилирования электроны от НАДН и ФАДН2 движутся по дыхательной цепи и в конце пути достигают своего конечного акцептора — молекулу кислорода. При недостатке кислорода нарушается процесс передачи электронов в дыхательную цепь и молекулы НАДН и ФАДН2 не превращаются в НАД+ и ФАД. Резкое торможение скорости ЦТК при недостатке кислорода объясняется недостатком молекул НАД+ и ФАД, выполняющих роль вторых субстратов в реакциях цикла.
Регуляция общего пути катаболизма
Скорости функционирования пируватдегидрогеназного комплекса (ПДК) и цикла трикарбоновых кислот (ЦТК) точно соответствуют потребности клеток в молекулах ацетил-КоА (необходимых для синтеза липидов) и АТФ (используемых в качестве универсального источника энергии). Регуляция ПДК(1) и ЦТК (2,3,4):
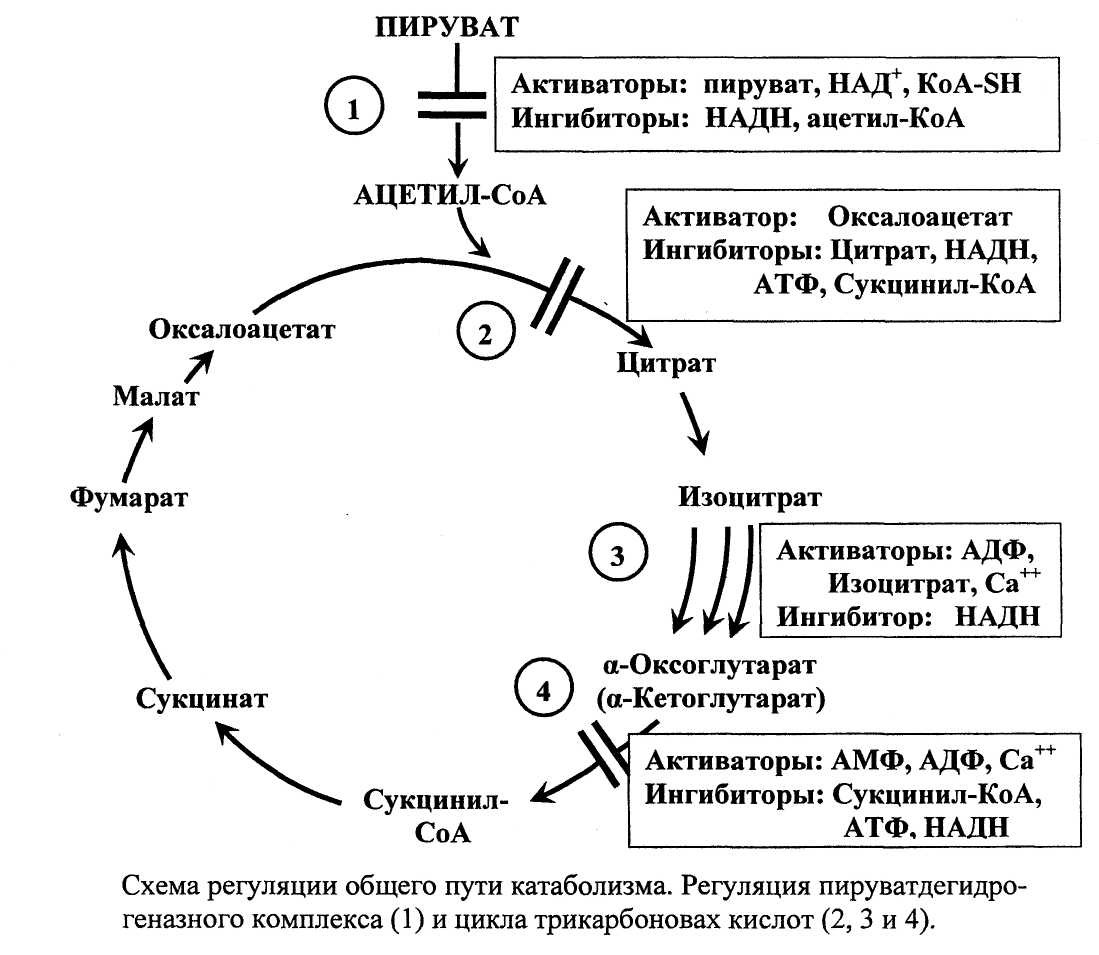
Общим принципом регуляции пируватдегидрогеназного комплекса (ПДК) и цикла трикарбоновых кислот (ЦТК), процессов независимых, но функционально тесно связанных, является то, что они совместно активируются при низком энергетическом потенциале клетки. И совместно ингибируются при высоком энергетическом клеточном потенциале.
Энергетический потенциал клетки определяется концентрацией молекул АТФ, НАДН, ацетил-КоА. Это такие молекулы, которые готовы отдать энергию в различных процессах (АТФ), или отдать электроны высоких энергий для синтеза АТФ (НАДН), или готовы к отдаче высокоэнергетических электронов как ацетил-КоА (для образования НАДН, а впоследствии АТФ).
При высоком энергетическом потенциале клетки велики внутриклеточные концентрации молекул АТФ и НАДН. Это вызывает торможение ПДК и ЦТК. При низком энергетическом потенциале клетки внутриклеточные концентрации АТФ и НАДН снижаются и увеличиваются концентрации таких молекул как АДФ, НАД+. Они активируют оба процесса (ПДК и ЦТК). Происходит ускоренный распад глюкозы до пирувата (активируется специфический катаболизм) и ускоряется преобразование пирувата в ацетил-КоА, происходит ускоренное образование молекул НАДН и ФАДН2, переносящих электроны в процесс окислительного фосфорилирования для синтеза АТФ (активируется общий путь катаболизма). Энергетический потенциал клетки характеризует отношение АТФ/АДФ и НАДН/над+.
Механизмы регуляции цитратного цикла
Главным и основным регулятором ЦТК является оксалоацетат, а точнее его доступность. Наличие оксалоацетата вовлекает в ЦТК ацетил-SКоА и запускает процесс.
Обычно в клетке имеется баланс между образованием ацетил-SКоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата в анаплеротической реакции), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты в результате трансаминирования.
Первая цитратсинтазная реакция образования цитрата из оксалоацетата и
ацетилтил-КоА - важнейшая регуляторная реакция всего цикла. Реакция активируется оксалоацетатом - субстратом реакции, и ингибируется продуктом - цитратом. Увеличение энергетического потенциала клетки (увеличение отношения НАДН/ НАД+, концентрация АТФ) тормозит образование цитрата. АТФ - аллостерический ингибитор цитратсинтазы. Его действие заключается в повышении Км для ацетил-КоА. Поэтому с увеличением содержания АТФ снижается насыщение фермента ацетил-КоА и в результате уменьшается образование цитрата. Ингибируют реакцию Сукцинил-КоА и длинноцепочечные жирные кислоты.
Изоцитрат-дегидрогеназная реакция аллостерически активируется АДФ,
изоцитратом, субстратом реакции и Са++ (3 на рис.). Фермент состоит из 8 каталитических субъединиц и при связывании первой молекулы субстрата в одной субъединице за счет конформационных изменений в других резко ускоряется присоединение последующих молекул субстрата, что ускоряет ферментативную реакцию (положительный кооперативный эффект).
Фермент аллостерически активируется АДФ и Са++, поскольку имеет аллостери-ческие центры связывания АДФ и Са на каждой субъединице. НАДН имеет более высокое сродство к каталитическому центру фермента, чем НАД+ и вытесняет его, что ингибирует ферментативную активность (механизм конкурентного ингибирования).
3. а-Оксоглутарат дегидрогеназный комплекс (4 на рис.) катализирующий преобразование а-оксоглутарата (а-кетоглутарата) в сукцинил-КоА, структурно подобен и гомологичен пируват-дегидрогеназному комплексу, но в отличие от ПДК, не имеет регуляторных белков в своем составе. а-Оксоглутарат дегидрогеназный комплекс активируется АМФ, АДФ, Са++, но ингибируется Сукцинил-КоА, АТФ, НАДН.
АМФ, АДФ - положительные аллостерические регуляторы ферментативного комплекса. Так, связывание АМФ ферментативным комплексом уменьшает Км для а-кетоглутарата в 10 раз. В области физиологических концентраций и сукцинил-КоА и НАДН (продукты реакции) обладают ингибирующим эффектом, действуя по механизму конкурентного ингибирования. Главным регулятором активности а-оксоглутарат дегидрогеназного комплекса является сукцинил-КоА.
Анаболические функции цикла лимонной кислоты
Другая роль цикла трикарбоновых кислот состоит в том, что он поставляет промежуточные продукты для процессов биосинтеза:
Из а-оксоглутарата (а-кетоглутарата) синтезируется 5-ти углеродная аминокислота глутамат, а затем из глутамата синтезируются глутамин, аргинин и пролин.
Из оксалоацетата (в нем 4 углеродных атома) синтезируется аспартат. Затем из аспартата синтезируется аспарагин.
Из сукцинил-КоА синтезируются порфирины и гем. Первая реакция синтеза порфирина - реакция конденсации сукцинил-КоА и аминокислоты глицина. В этой реакции конденсации, сопряженной с декарбоксилированием, образуется важный промежуточный продукт синтеза гема - 8-аминолевуленовая кислота.
Из оксалоацетата синтезируется глюкоза (процесс глюконеогенеза). Этот путь активируется при недостаточности глюкозы в клетке.
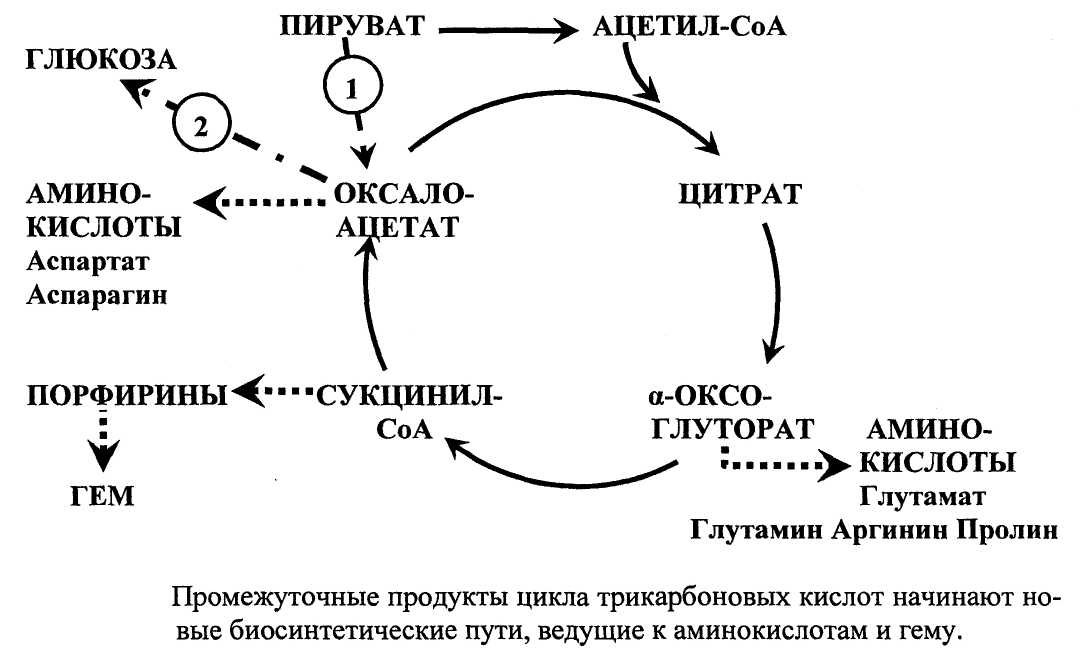
Амфиболические функции цикла трикарбоновых кислот
Цикл трикарбоновых кислот занимает центральное место в клеточном метаболизме. Этот циклический путь выполняет как катаболическую, так и анаболическую функцию, т.е. является амфиболическим. Цикл трикарбоновых кислот процесс с выраженной катаболической функцией. Двууглеродные фрагменты, которые вносит молекула ацетил-КоА, подвергаются в нем полному окислению до СО2. Вместе с тем, промежуточные продукты цикла трикарбоновых кислот начинают новые биосинтетические пути. Из промежуточных продуктов ЦТК синтезируются некоторые заменимые аминокислоты, порфирины и гем, а также глюкоза.
Реакции, пополняющие нитратный цикл (анаплеротические реакции)
Анаплероз - процесс восполнения, пополнения резерва. К снижению концентрации промежуточных продуктов цикла трикарбоновых кислот приводят анаболические (биосинтетические процессы). Они быстро истощают пул промежуточных продуктов цикла. Поэтому их запас постоянно пополняется за счет молекул из других источников. При деградации большинства аминокислот образуются пируват или промежуточные продукты цикла. Эти ферментативные процессы называют анаплеротическими реакциями. Особенно важной анаплеротической реакцией в организме человека является превращение пирувата в оксалоацетат. Эта реакция поддерживает необходимую высокую концентрацию оксалоацетата в митохондриях и обеспечивает субстратом первую цитратсинтазную реакцию цикла.
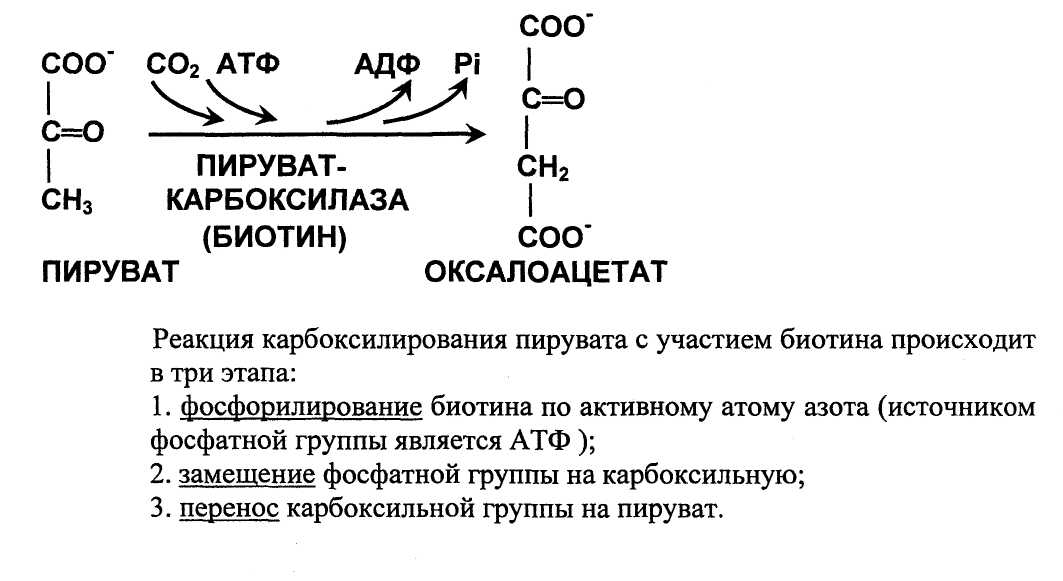
У здоровых людей эта АТФ-зависимая реакция позволяет включать в глюконеогенез лактат и аминокислоты, распадающиеся до пирувата.
В отличие от пирувата ацетил-КоА не является анаплеротическим метаболитом, поскольку полностью окисляется до СО2.
Нарушение образования оксалоацетата ведет к взаимной конденсации молекул ацетил-КоА друг с другом и вызывает образование кетоновых тел, главным образом - ацетоацетата (СН3-СО-СН2-СООН), и кетоацидоз плазмы крови при недостаточном количестве оксалоацетата в печени. Такое состояние наблюдается при инсулинзависимом сахарном диабете, при голодании, алкогольном отравлении или длительной физической нагрузке.
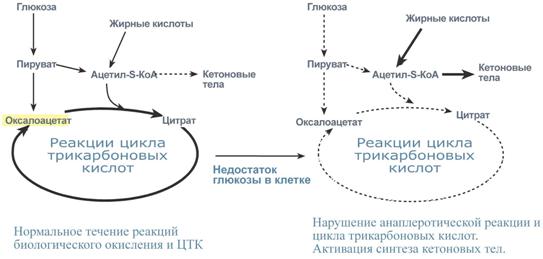
Изменение скорости реакций ЦТК и причины накопления кетоновых тел при некоторых состояниях
Связь между общим путем катаболизма и цепью переноса электронов и протонов.
Общий путь катаболизма, включающий пируватдегидрогеназный комплекс (ПДК) и цикл трикарбоновых кислот (ЦТК), локализованные в митохондриальном матриксе, с одной стороны, и цепь переноса электронов локализованная во внутренней митохондриальной мембране, с другой, функционально связаны между собой через общие молекулы НАД+ и НАДН.
При увеличении расхода энергии в клетке уменьшается концентрация молекул АТФ и увеличивается АДФ. При этом увеличивается количество электронов поступающих в цепь переноса электронов от молекул НАДН, поэтому их доля снижается, но увеличивается количество молекул НАД+. Эти изменения активируют ПДК и ЦТК. В цикле активируются изоцитрат-дегидрогеназная реакция и функционирование а-оксоглутарат дегидрогеназного комплекса, которые чувствительны к концентрации АДФ.
Напротив, снижение энергопотребления в клетках влечет за собой увеличение концентраций АТФ и НАДН. При этом активность ПДК и ЦТК снижается. Снижение активности общего пути катаболизма вызвано тем, что для всех регуляторных этапов увеличение концентраций АТФ и/или НАДН ингибирует ферментативные реакции.
ОБРАЗОВАНИЕ ТОКСИЧНЫХ ФОРМ КИСЛОРОДА
В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием кислорода, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2. Оксидазы образуют пероксид водорода по схеме:
О2 + SH2 → S + Н2О2,
где SH2 - окисляемый субстрат.
Примеры таких оксидаз - оксидазы аминокислот, супероксид дисмугаза, оксидазы, локализованные в пероксисомах. Оксидазы пероксидом окисляют, в частности, жирные кислоты с очень длинной углеродной цепью (более 20 углеродных атомов) до более коротких, которые далее подвергаются β-окислению в митохондриях.
Оксигеназы включают один (монооксигеназы, например, цитохром Р450 ) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот, синтезе жёлчных кислот и стероидов, в реакциях обезвреживания чужеродных веществ в печени. В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
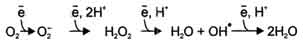
Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции.
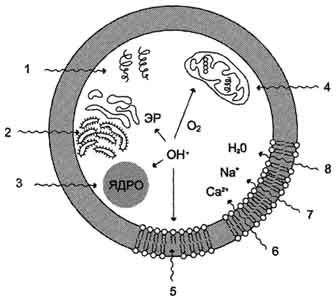
Повреждающее действие свободных радикалов на компоненты клетки.
1 - разрушение белков; 2 - повреждение ЭР; 3 - разрушение ядерной мембраны и повреждение ДНК; 4 - разрушение мембран митохондрий; 5 - ПОЛ клеточной мембраны; 6, 7, 8 - проникновение в клетку воды и ионов.
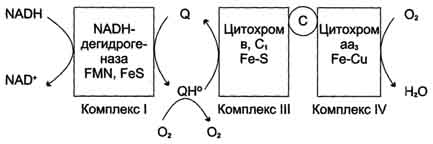
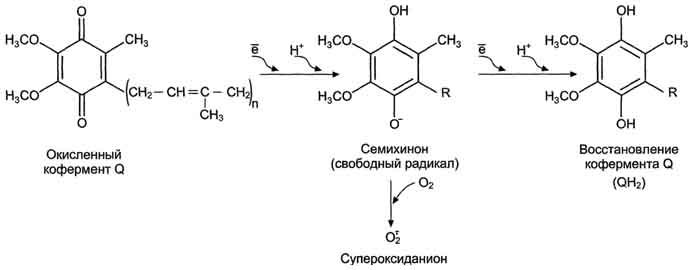
Образование супероксида в ЦПЭ. "Утечка" электронов в ЦПЭ может происходить при переносе электронов с участием коэнзима Q. При восстановлении убихинон превращается в анион-радикал семихинона. Этот радикал неферментативно взаимодействует с О2 с образованием супероксидного радикала. Комплекс II на рисунке не указан.
В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов.
В фагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов (с участием активных форм кислорода разрушают фагоцитированные клетки бактерий). Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода.
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов.
Перекисное окисление липидов
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
Стадии перекисного окисления липидов
1) Инициация: образование свободного радикала (L•)
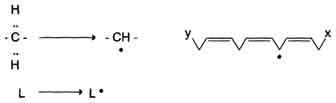
Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи:
L • + О2 → LOO •
LOO• + LH → LOOM + LR•
Развитие цепи происходит при присоединении О2, в результате чего образуется липопероксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Разрушение структуры липидов
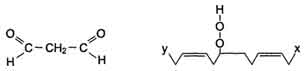
Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи - взаимодействие радикалов между собой:
LOO• + L• → LOOH + LH
L• + vit E → LH + vit E•
vit E• + L• → LH + vit Еокисл.
Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
Повреждение клеток в результате ПОЛ
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.
Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.
ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов - всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты - вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи.
Системы защиты клеток от активных форм кислорода
Ферменты антиоксидантного действия:
- супероксиддисмутаза,
- каталаза,
- глутатионпероксидаза.
Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико.
Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода:
2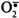 + 2H+ → H2O2 + O2 + 2H+ → H2O2 + O2
Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи.
СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление.
Пероксид водорода, который может инициировать образование самой активной формы ОН•, разрушается ферментом каталазой:
2Н2О2 → 2 Н2О + О2.
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий "респираторного взрыва".
Глутатионпероксидаза - важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ-глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSH) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу.
Н2О2 + 2 GSH → 2 Н2О + G-S-S-G.
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н+ → 2 GSH + NADP+.
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамины, обладающие антиоксидантным действием
Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH), и таким образом останавливает развитие ПОЛ. Витамин Е превращается в стабильный, полностью окисленный токоферолхинон.
Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода - 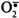 , Н2О2, ОН• и инактивирует их. , Н2О2, ОН• и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантаьш действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, каротиноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты - помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток.
Продукты, богатые антиоксидантами
Антиоксиданты в первую очередь содержатся в различных свежих фруктах, а также продуктах, изготовленных из них: черника, виноград, клюква, рябина, черноплодная рябина, смородина, гранаты, мангостин, асаи. Все они имеют кислый или кисло-сладкий вкус и красный (красновато-синий, синий) цвет. Среди других продуктов, содержащих антиоксиданты выделяют какао, красное вино, зелёный чай и в меньшей степени чёрный чай.
Антиоксиданты, используемые как пищевые добавки:
Пектин
Аскорбиновая кислота
Лимонная кислота и др.
Современные антиоксиданты применяются в составе комбинированной терапии при лечении рака молочной железы, рака легких, рака печени, рака мозга, рака половых органов, рака органов пищеварения. При проведении лучевой и химиотерапии у больных с различными злокачественными новообразованиями на фоне действия некоторых антиоксидантов отмечено значительное снижение токсических и иных нежелательных эффектов. Длительный прием антиоксидантов продлял сроки жизни онкологических больных, предотвращал развитие и прогрессирование отдаленных метастазов, ослаблял болевой синдром, способствовал улучшению качества жизни этих больных.
Использование протекторных свойств антиоксидантов позволяло проводить в полном объеме антибактериальное и противотуберкулезное лечение, так как при этом существенно уменьшалось побочное действие лекарственных препаратов. Доказана их высокая эффективность при лечении интоксикаций любой этиологии: при пищевых, алкогольных, наркотических отравлениях, ожоговых и лекарственных токсикозах. Систематическое применение некоторых антиоксидантов приводило к устранению угнетения функциональной активности иммунокомпетентных клеток, повышало устойчивость иммунной системы и приводило к полному подавлению многих хронических инфекций.
Таким образом, антиоксиданты вызывают нормализацию важнейших биохимических показателей крови, обладает гепато-протекторными, противовоспалительными, противоопухолевыми, иммуностимулирующими свойствами.
Синтетические антиоксиданты
Ионол (2,6-дитретбутил-4-метилфенол, бутилгидрокситолуол, дибунол) является жирорастворимым фенолом. Его окисленная форма представляет радикал, стабилизированный двумя боковыми третбутильными группировками, а поэтому более стабильный, чем у токоферолов. Ионол успешно применяется для профилактики острых ишемических повреждений органов и постишемических расстройств. Препарат высоко эффективен при лечении лучевых и трофических поражений кожи и слизистых оболочек, успешно используется в терапии больных дерматозами, способствует быстрому заживлению язвенных поражений желудка и двенадцатиперстной кишки.
Фенозаны (К+- или Li+-соли 4-гидрокси-3,5-дитретбутилфенилпропионовой кислоты) синтезированы в ИХФ РАН, являются водорастворимыми производными ионола.
Оксипиридины - группа азотсодержащих гетероциклических фенолов, синтетических аналогов витамина В6. Существенным удобством препаратов является их растворимость в воде. К группе синтетических антиоксидантов относятся так же селен-неорганические и селен-органические соединения, механизм антирадикального действия которых связан, в основном, с активацией селен-зависимой глутатионпероксидазы, являющейся первой линией защиты клеток организма от накопления токсических гидропероксидов и свободных радикалов.
Структурные аналоги природных антиоксидантов
В последние годы предпринимаются многочисленные попытки добиться повышения эффективности действия антиоксидантов путем той или иной их структурной модификации. Так, например, имеются сведения о более эффективном действии ферментного препарата СОД в соединении с дериватным носителем, синтезирована большая группа водорастворимых производных витамина Е и бета-каротина.
Самое пристальное внимание уделяется соединениями, близким к витамину Е. Так, наряду с самим витамином Е антиоксидантными свойствами обладают его водорастворимые аналоги: тролокс-С и альфа-токоферола полиэтиленгликольсукцинат (ТПГС). Тролокс-С действует как эффективный тушитель свободных радикалов по тому же механизму. что и витамин Е, а ТПГС даже превосходит витамин Е по эффективности. |
 Скачать 1.06 Mb.
Скачать 1.06 Mb.