билет № 15
Теория электролитической диссоциации. Сильные и слабые электролиты. Степень диссоциации. Равновесие в растворах слабых электролитов. Константа диссоциации (ионизации) слабого электролита. Закон разведения Оствальда.
Вывести произведение растворимости сульфата бария ( ) и написать условия образования осадка. ) и написать условия образования осадка.
Дано равновесное состояние: Zn2+ + НОН ⇄ ZnОH+ + Н+
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) ZnCl2; б) H2SO4; в) NaOH; г) при нагревании и при разбавлении раствора?
Для улучшения процесса свёртываемости крови применяют раствор хлорида кальция. Рассчитать массу ионов кальция (в мг) получаемую в курсе лечения, если больному внутривенно вводят по 3 мл 0,20% раствора (пл.= 1) 3 раза в день в течение 10 дней.
Найти Н+ , ОН- и рН 0,05 М раствора пропановой кислоты (Кд =1,3.10-5).
Сколько мл 0,4 н NH4Cl надо добавить к 1 л 0,1 н раствора NH4OH, чтобы [OH-] в полученном буферном растворе была 5,6.10-5 моль/л? (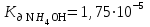 ). Показать механизм буферного действия. ). Показать механизм буферного действия.
Дать определение алкалоза, рассмотреть причины его возникновения и виды (компенсированный и некомпенсированный, метаболический и респираторный).
Написать молекулярные и ионные уравнения гидролиза соли KNO2 и выражение для Кг. Рассчитать рН 0,01 н раствора этой соли ( ). ).
Написать уравнение диссоциации тетрабромокадмиата(II) калия и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) NaCN; б) NH3; в) KBr? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Cd(NH3)4]2+ =10-8, Кн[Cd(CN)4]2- =10-17, Кн[CdBr4]2- =10-4?
Молярная масса вещества 80 г/моль. Ккриоск. =1.86. Температура замерзания раствора, состоящего из 300 г воды и 40 г растворенного вещества, составляет:
1) –2.70С
2) –1.70С
3) –3.10С
4) –0.930С
Внутренняя энергия изолированной системы является
1) равной нулю
2) переменной
3) постоянной
4) уменьшающейся с ростом температуры
|
 Скачать 169.49 Kb.
Скачать 169.49 Kb.