билет № 13
Механизм буферного действия кислотных и основных буферных систем. Расчет изменения рН буферных растворов при добавлении сильной кислоты и щелочи. Факторы, влияющие на это изменение.
Вывести ионное произведение води и указать следствия из него. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: СаСО3(тв) ⇄ Са2+(р-р) + CО32-(р-р).
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) К2СO3; б) СaCl2; в) при нагревании и при разбавлении раствора?
Для улучшения эритропоэза железодефицитной анемии назначают раствор хлорида железа (II). Рассчитайте массовую долю в растворе хлорида Fe (II), чтобы при назначении по 5 мл раствора на приём больной получал по 25м г хлорида Fe (II). Найти массу ионов железа в растворе в мг в одной пробе ( = 1 г/мл).
Найти Н+ , ОН- и рН 0,06 М раствора муравьиной кислоты, если Кд=1,8.10-4.
Как изменится рН раствора, если к 1 л буферного раствора, содержащего 0,9 н растворы HCN и KCN, прибавили 0,3 моль-экв. щелочи? Кд HCN=7,2.10-10.
Рассчитать, избытку кислых или основных продуктов лучше противодействует фосфатная буферная система при физиологическом значении рН (7,36).
Написать молекулярные и ионные уравнения гидролиза соли NH4CN и выражение для Кг. Рассчитать рН 0,036 М раствора этой соли, если 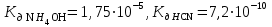 . .
Написать уравнение диссоциации тетратиоцианато кобальтата(II) лития и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) KCN; б) NH3; в) H2SO4? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Co(CNS)4]2- =10-3, Кн[Co(NH3)4]2+ =10-5, Кн[Co(CN)6]4- =10-19?
Температура замерзания децимоляльного раствора NaCl по сравнению с децимоляльным раствором АlCl3
1) ниже
2) не может быть определена
3) одинакова
4) выше.
Какие процессы называют экзотермическими?
1) для которых ΔH положительно
2) для которых ΔG отрицательно
3) для которых ΔH отрицательно
4) для которых ΔG положительно
|
билет № 14
Активная, потенциальная и общая кислотность растворов сильных и слабых электролитов. Биологическая роль ионов водорода и гидроксила (в энергетике клетки, в кислотно-основном равновесии). рН биологических жидкостей: крови, плазмы крови, желудочного сока, сока поджелудочной железы, слезной жидкости и др.
Вывести константу диссоциации муравьиной кислоты и показать ее связь со степенью диссоциации (закон разведения Оствальда). Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: СН3СОО- + НОН ⇄ СН3СООH + ОН-.
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) HCl; б) KOH; в) CH3COONa; г) при нагревании и при разбавлении раствора?
К 250 мл. 32% кислоты плотностью 1,2 г/мл добавили 500мл воды .Вычислить массовую долю и молярную концентрацию полученного раствора.
Найти Н+ , ОН- и рН раствора NH4OH, если в 0,03 М растворе = 2,4% .
Какой из электролитов лучше выбрать для приготовления буферного раствора с наибольшей буферной емкостью при рН = 3,75: рК (СН3СНОНСООН) = 3,06; рК (СН3СООН) = 4,75; рК(Н2СО3)= 6,35? Как приготовить 1 л такого раствора из 1 н компонентов?
Рассмотреть явление ацидоза, причины его возникновения и виды (компенсированный и некомпенсированный, метаболический и респираторный).
Написать молекулярные и ионные уравнения гидролиза соли NH4NO3 и выражение для Кг. Рассчитать рН 0,02 М раствора этой соли, если 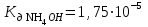 . .
Написать уравнение диссоциации бромида диамминзолота(I) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) KCl; б) KCN; в) NH3 ? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Au(CN)2]1- =10-38, Кн[Au(NH3)2]+ =10-27, Кн[AuCl2]1- =10-9?
Осмос – это
явление в истинном растворе
перенос вещества через мембрану
явление перехода растворителя в область больших концентраций растворенного вещества
явление в идеальных растворах
Тепловой эффект реакции, протекающей при постоянном объеме, называется изменением
1) энтальпии
2) энтропии
3) внутренней энергии
4) температуры
| |
 Скачать 169.49 Kb.
Скачать 169.49 Kb.