билет № 16
Осмотическое и онкотическое давление крови. Роль онкотического давления в водно-солевом обмене. Голодные и почечные отеки. Роль осмоса в биологических системах.
Вывести константу диссоциации фтороводородной кислоты и показать ее связь со степенью диссоциации (закон разведения Оствальда). Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: СО32- + НОН ⇄ НСО3- + ОН-.
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) Na2CO3; б) KCl; в) HCl; г) при нагревании и при разбавлении раствора?
Сколько воды нужно прилить к 200 мл. 25% раствора серной кислоты (плотность раствора 1,15 г/мл.), чтобы получить 12% раствор серной кислоты ?
Найти Н+, ОН- и рН 0,006 н раствора Ba(OН)2.
Определить рН буферного раствора, приготовленного из 100 мл 0,5 н раствора NaH2PO4 и 400 мл 0,3 н раствора Na2HPO4 ( рК2= 7,20). Как изменится рН этого раствора при добавлении к нему 40 мл 0,2 н раствора NaOH?
Определить, к избытку каких эквивалентов (кислых или основных) гидрокарбонатная буферная система крови более устойчива? Ответ подтвердить расчётами. Показать механизм буферного действия.
Написать молекулярные и ионные уравнения гидролиза соли Pb(NO3)2 и выражение для Кг. Рассчитать рН 0,01 М раствора соли , считая, что гидролиз протекает по I ступени (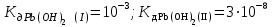 ). ).
Написать уравнение диссоциации бромида тетраамминцинка(II) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) KI; б) KCN; в) NH3 ? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Zn(CN)4]2- =10-19, Кн[Zn(NH3)4]2+ =10-9, Кн[ZnI4]2- =10-1?
8.5 %-ный раствор NaCl является по отношению к плазме крови
1) гипотоническим
2) гипертоническим
3) изотоническим
4) осмоляльным
Какое уравнение является математическим выражением 1-го закона термодинамика для закрытых систем?
1) ΔU = 0
2) ΔS > 0
3) ΔG = ΔH – T∙ΔS
4) ΔU = Q – p∙ΔV
|
билет № 17
Ацидиметрия и алкалиметрия. Рабочие растворы и определяемые вещества. Расчет массы и массовой доли определяемого вещества по данным титриметрического анализа. Определение кислотности желудочного сока.
Вывести константу гидролиза соли KF и показать ее связь с константой диссоциации слабой кислоты. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: H2SO3 ⇄ H+ + HSO3-
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) HCl; б) NaOH; в) KHSO3; г) при нагревании и при разбавлении раствора?
Жидкость Бурова, содержащая соль ацетата алюминия, оказывает вяжущее действие. Рассчитайте массовую долю растворенного вещества и молярную концентрацию раствора , полученного растворением 20 г ацетата алюминия в 200 мл воды (плотность раствора =1) . Какая масса ионов алюминия (в мг) содержится в 15 мл жидкости Бурова?
Найти Н+ , ОН- и Рн 0,06 М раствора пропановой кислоты, если Кд=1,35.10-5.
Какой из электролитов надо выбрать для приготовления буферного раствора с Рн=9,5: NH4OH (Pkосн=4,75), CH3COOH (Pk=4,75), H2CO3 (Pk1=6,37)? Как приготовить 400 мл такого раствора из 1 н растворов компонентов?
Какой вид имеет уравнение Гендерсона-Гассельбаха для гидрокарбонатной буферной системы плазмы крови? Рассчитать соотношение компонентов этой буферной системы в норме при Рн=7,40 и показать механизм буферного действия.
Написать молекулярные и ионные уравнения гидролиза соли К2CO3 и выражение для Кг. Рассчитать Рн 0,01 М раствора этой соли (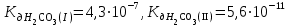 ). ).
Написать уравнение диссоциации гексахлорохромата(III) калия и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) KSCN; б) KOH; в) KF? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Cr(SCN)6]1- =10-6, Кн[Cr(OH)6]1- =10-3, Кн[CrF6]1- =10-12, Кн[CrCl6]1- =10-7,?
Сравнить поведение эритроцитов в 2%-ном и 5%-ном растворе глюкозы.
Какое уравнение является математическим выражением 1-го закона термодинамики для изолированных систем?
1) ΔS > 0
2) ΔU = Q – p∙ΔV
3) ΔG = ΔH – T∙ΔS
4) ΔU = 0
| |
 Скачать 169.49 Kb.
Скачать 169.49 Kb.