билет № 22
Буферная емкость: определение, размерность. Факторы, влияющие на буферную емкость. Сравнительная величина буферной емкости буферных систем крови.
Вывести общую константу нестойкости комплексного иона [AgF2]1-. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: PbCl2(тв) ⇄ Pb2+(р-р) + 2Cl-(р-р).
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) Pb(NO3)2; б) NaCl; в) HNO3; г) при нагревании и при разбавлении раствора?
Хлорид цинка используется в медицине в качестве вяжущего и антисептического средства. Вычислите ω % хлорид-ионов в 7 %-ном растворе соли и их массу (г) в 150 мл этого раствора (ρ = 1,045 г/мл).
Найти концентрацию кислоты и рН в растворе СН3СООН, если = 2%, Кд= 1,75.10-5.
Какой объем 2 М раствора ацетата натрия надо добавить к 150 мл 0.15 М раствора уксусной кислоты, чтобы получить раствор с рН = 5? (Кд кислоты = 1,75·10-5).
Рассчитать, в каком молярном соотношении находятся компоненты гидрокарбонатной буферной системы в плазме крови при рН=7,40. Показать механизм действия этой буферной системы при добавлении а) HCl; б) КОН.
Написать молекулярные и ионные уравнения гидролиза соли Pb(NO3)2 и выражение для Кг. Рассчитать рН 0,08 М раствора соли , считая, что гидролиз протекает по I ступени (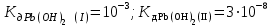 ). ).
Написать уравнение диссоциации нитрата гексаамминкобальта(III) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) KCN; б) KOH; в) NH3? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Co(CN)6]3- =10-64, Кн[Co(NH3)6]3+ =10-35, Кн[Co(OH)6] 3- =10-30?
Зимой посыпают солью дороги для того, чтобы
1) повысить температуру таяния льда
2) понизить температуру таяния льда
3) не менять температуру таяния льда
4) сначала повысить температуру таяния льда, затем уменьшить
В каком соотношении находится энтропии трех агрегатных состояний одного вещества газа, жидкости, твердого тела?
1) S(r) > S(ж) > S(тв)
2) S(тв) > S(ж) > S(r)
3) S(ж) > S(r) > Sтв)
4) S(ж) > Sтв) > S(r)
|
билет № 23
Коллигативные свойства растворов. Давление насыщенного пара над раствором. Криометрия и эбулиометрия: использование для определения молекулярной массы веществ, значение в медико-биологических исследованиях.
Вывести ионное произведение води и указать следствия из него. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: Н2CО3 ⇄ Н+ + НCО3-
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) NaHCO3; б) NaOH; в) HCl; г) при нагревании и при разбавлении раствора?
Показаниями к применению хлорида калия являются гипокалиемия, аритмия различного происхождения. Вычислите ω % и титр хлорида калия в 2М растворе (ρ = 1,12г/мл). Какая масса ионов калия (мг) содержится в 15 мл этого раствора?
В растворе уксусной кислоты [OH -] = 2.10 –12 М. Найти [H+], рН и концентрацию кислоты, если Кд= 1,75.10-5.
Определить рН буферного раствора, приготовленного из 300 мл 0,1 н раствора СН3СООН и 150 мл 0,5 н раствора NaCH3COO , если Кд= 1,75.10-5. Определить буферную емкость раствора по кислоте при добавлении 10 мл 0,05 н HCl.
Рассчитать, в каком молярном соотношении находятся компоненты фосфатной буферной системы в плазме крови при рН=7,40. Показать механизм действия этой буферной системы при добавлении а) HCl; б) КОН.
Написать молекулярные и ионные уравнения гидролиза соли Na2СO3 и выражение для Кг. Рассчитать рН 0,02 н раствора этой соли, если 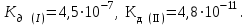
Написать уравнение диссоциации тетрагидроксокупрата(II) калия и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) NH3; б) KCN; в) KOH? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Cu(OH)4]2- =10-19, Кн[Cu(CN)4]2- =10-31, Кн[Cu(NH3)4]2+=10-12 ?
Рабочие «горячих» цехов должны пить подсоленную воду, так как в результате повышенного потоотделения осмотическое давление у них:
1) понижается
2) повышается
3) не меняется
4) сначала повышается, затем понижается
В изолированной системе все самопроизвольные процессы протекают в сторону увеличения беспорядка. Как при этом изменяется энтропия?
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала уменьшается, затем увеличивается
|
билет № 24
Титриметрический анализ. Основные понятия: титрование, точка эквивалентности, индикаторы, титранты, стандартные вещества и растворы. Требования к реакциям в титриметрическом анализе. Классификация методов. Расчеты в титриметрическом анализе.
Вывести константу диссоциации пропановой кислоты и показать ее связь со степенью диссоциации (закон разведения Оствальда). Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: NH4+ + Н2О ⇄ NH4OH + Н+.
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) HCl; б) KCl; в) NaOH; г) при нагревании и при разбавлении раствора?
Для повышения осмотического давления плазмы крови при глаукоме назначают 5 %-ный раствор ацетата калия. Найдите молярную концентрацию соли в этом растворе. Сколько мг ионов калия содержат 20мл полученного раствора? (ρ=1 г/мл).
Найти Н+ , ОН- и 0,01 М раствора HCN, если рОН= 8,35.
Какие объемы 1 н растворов NaH2PO4 и Na2HPO4 надо взять для приготовления 1 л буферного раствора с рН = 7,8? Показать механизм буферного действия этого раствора.
Какая из двух кислотных буферных систем: а) рН= рК+1; б) рН=рК-1 обладает большей буферной емкостью по щелочи? Сравнить величины буферной емкости буферных систем крови.
Написать молекулярные и ионные уравнения гидролиза соли Na2SO3 и выражение для Кг. Рассчитать рН 0,008 М раствора этой соли , считая, что гидролиз протекает по I ступени и 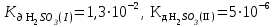 . .
Написать уравнение диссоциации нитрата тетраамминкобальта(II) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) HCl; б) CuSO4; в) окислителя? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Сo(NH3)6]3+=10-35, Кн[Cu(NH3)4]2+ =10-14, Кн[Co(NH3)4]2+=10-6?
Солевые слабительные средства (сульфаты натрия, магния) в кишечнике осмотическое давление:
1) уменьшают
2) увеличивают
3) не изменяют
4) сначала уменьшают, затем увеличивают
Какими одновременно действующими факторами определяется направленность химического процесса?
1) энтальпийным и температурным
2) энтальпийным и энтропийным
3) энтропийным и температурным
4) энтропийным и давлением
|
билет № 25
Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов. Гипо- гипер- и изотонические растворы. Изотонический коэффициент. Понятия об изоосмии (электролитном гомеостазе).
Вывести константу гидролиза соли NH4Cl и показать ее связь с константой диссоциации слабого основания. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: AgCl(тв) Ag+(р-р) + Cl-(р-р).
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) AgNO3; б) NaCl; в) HNO3; г) при нагревании и при разбавлении раствора?
Для оттока раневого содержимого наружно используют 5 %-ный раствор хлорида натрия. Сколько мл воды надо добавить к 30%-ному раствору, чтобы получить 100 мл 5 %-ного раствора NaCI? Какая масса ионов хлора содержится в 15 мл 5%раствора (ρ=1 г/мл).
Найти Н+ , ОН- и рН 0,05 М раствора азотистой кислоты, если Кд=5.10-4.
На основе фосфорной кислоты (рК1=2,12; рК2=7,20; рК3=12,4) можно приготовить несколько буферных систем. Напишите соответствующие компоненты для буферной системы с рН=7,4. Рассчитайте объемы 1 н растворов, необходимых для приготовления 1 л такого буферного раствора. Покажите механизм действия этой буферной системы.
Какой анион: Hb- или HbO2- - способен активнее связывать протон, если 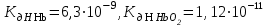 ? Напишите уравнения реакций. ? Напишите уравнения реакций.
Написать молекулярные и ионные уравнения гидролиза соли КHCO3 и выражение для Кг. Рассчитать рН 0,03 М раствора этой соли (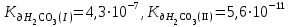 ). ).
Написать уравнение диссоциации сульфата тетраамминмеди(II) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) KCN; б) КOH; в) HCl? В каком случае произойдет разрушение исходного комплексного иона, если КД[NH4]+ = 5,6·10–10
10-19 Кн[Cu(OH)4]2- =10-19, Кн[Cu(NH3)4]2+ =10-13, Кн[Cu(CN)4]2- =10-31?
Экзергоническими называют процессы, в которых
1) ΔH < 0
2) ΔG < 0
3) ΔH > 0
4) ΔG > 0
|
|
 Скачать 169.49 Kb.
Скачать 169.49 Kb.