билет № 10
Гидролиз солей - обратимый процесс. Степень гидролиза. Константа гидролиза и ее связь с константой диссоциации (рассмотреть на примере гидролиза солей слабых однокислотных оснований и сильных одноосновных кислот). Смещение равновесия гидролиза.
Вывести произведение растворимости карбоната кальция (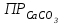 ) и написать условия образования осадка. ) и написать условия образования осадка.
Дано равновесное состояние: [Co(CNS)4]2- ⇄ Co2+ + 4CNS-.
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) KCNS; б) CoCl2; в) K2SO4; г) при нагревании и при разбавлении раствора?
Для повышения осмотического давления плазмы крови при глаукоме назначают 5% раствор CH3COOK по 5 мл внутривенно два раза в день. Найти молярную концентрацию раствора, массовую долю ионов калия и массу введенного К+ (в мг) за курс лечения 7 дней.
Найти Н+ , ОН- и рН 0,12 М раствора хлорноватистой кислоты (Кд НСlО =5.10-8).
Определить рН гидрокарбонатного буферного раствора, приготовленного из 18 мл 0,2 н раствора угольной кислоты и 9 мл 0,3 н раствора гидрокарбоната натрия.
Рассмотреть механизм действия белковой буферной системы крови и её буферную ёмкость.
Рассчитать молярную концентрацию раствора соли ацетата натрия, если рН раствора 8,8. Написать молекулярное и ионное уравнения гидролиза этой соли (Кдcн3соон= 1,75.10-5).
Написать уравнение диссоциации хлорида диамминсеребра(I) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) HCl; б) KCN; в) KI? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Ag(NH3)2]+ =10-7, Кн[Ag(CN)2]- =10-21, Кн[AgI2]- =10-12?
Раствор, содержащий 10 г неэлектролита (М = 236 г/моль ) в 200 г воды (Кэ(H2O) = 0,52 К·кг/моль), кипит при температуре (подтвердить расчётами) 1).100,44 °С 2) 100,33 °С 3) 100,11 °С 4) 100,22 °С
Энтропия идеального кристалла при абсолютном нуле равна
1) 0
2) 2
3) -1
4)1
|
билет № 11
Ионное произведение воды. Понятие кислой, нейтральной и щелочной среды. Водородный и гидроксильный показатели. Расчет рН в растворах сильных и слабых электролитов. Границы изменения рН в водных растворах в зависимости от концентрации электролита и от температуры.
Вывести общую константу нестойкости комплексного иона [CuCl2]1-. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: HCOOH ⇄ H+ + HCOO-
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) HCl; б) KOH; в) NaHCOO; г) при нагревании и при разбавлении раствора?
Больному введена смесь из 180 мл физиологического раствора и 20 мл 10% раствора (пл.= 1,1) сульфата магния. Сколько мг ионов Mg2+ и SO42- содержит 5 мл полученного раствора?
Написать уравнение диссоциации и рассчитать [H+], [OH-] и рН 0,01 М раствора молочной кислоты (Кд= 1,4.10-4).
Определить рН буферного раствора, приготовленного из 200 мл 0,4 н раствора NH4OH (рК=4,76) и 300 мл 0,3 н раствора NH4Cl. Как изменится рН этого раствора при добавлении к нему 30 мл 0,1 н раствора NaOH?
Рассмотреть механизм буферного действия гидрокарбонатной буферной системы и взаимодействие гидрокарбонатной и гемоглобиновой буферных систем в организме.
Написать молекулярные и ионные уравнения гидролиза соли FeCl2 и выражение для Кг. Рассчитать рН 0,03 М раствора этой соли , считая, что гидролиз протекает по I ступени (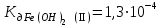 ). ).
Написать уравнение диссоциации хлорида тетраамминникеля(II) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) ZnCl2; б) KCN; в) H2SO4? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Zn(NH3)4]2+ =10-9, Кн[Ni(CN)4]2- =10-31, Кн[Ni(NH3)4]2+-=10-7?
В 5.4 %-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
Ответ объяснить.
Изменение энергии Гиббса (при постоянных температуре и давлении) составляет ΔG = ΔН – ТΔS. Условия самопроизвольного протекания процесса в закрытой системе при любых температурах
1) ΔН < 0, ΔS < 0
2) ΔН < 0, ΔS > 0
3) ΔН > 0, ΔS > 0
4) ΔН > 0, ΔS < 0
| |
 Скачать 169.49 Kb.
Скачать 169.49 Kb.