билет № 3
Необратимый гидролиз. Особенности гидролиза кислых солей (рассмотреть на примере солей фосфорной кислоты). Роль гидролиза в биохимических процессах. Гидролиз АТФ как универсальный источник энергии в организме.
Вывести общую константу диссоциации комплексного иона [Ag(CN)2]1-.Как она называется? (Вывод константы проводить, используя закон действия масс и основное условие равновесия:  ). ).
Дано равновесное состояние: СN- + Н2О ⇄ НСN + ОН-.
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) NaCN, б) NaOH, в) HCl, г) при нагревании и при разбавлении раствора?
Для повышения осмотического давления плазмы крови используют 1% раствор ацетата калия. Найти объем воды, который надо добавить к 150 мл 25% раствора ацетата калия (пл.=1,15) для получения раствора требуемой концентрации. Сколько мг ацетата калия и ионов калия содержит 1 мл такого раствора?
Найти Н+, ОН- и рН 0,02 М раствора NH4OH, если Кд =1,75.10-5.
В каком отношении надо смешать 0,1 н растворы NaH2PO4 и Na2HPO4, чтобы получить фосфатный буферный раствор с рН= 7,00?. КдH2HO4- = 6?23∙10-8.
Рассмотреть гемоглобиновую буферную систему крови: состав, механизм буферного действия и его особенности.
Написать молекулярные и ионные уравнения гидролиза соли Na2S и выражение для Кг. (по I ступени). Рассчитать рН 0,05 М раствора этой соли (по I ступени). 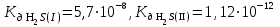
Написать формулу тетрацианокупрата(II) натрия , указать степень окисления и координационное число комплексообразователя. Используя электронную конфигурацию центрального атома, определить тип гибридизации атомных орбиталей и геометрию комплексного иона.
1) осмотический шок
2) повышение рН крови
3) изменения осмотического давления не происходит
4) осмотический конфликт
Ответ обосновать.
Для необратимых процессов изменение свободной энергии
1) всегда равно нулю
2) всегда отрицательно
3) всегда положительно
4) положительно или отрицательно в зависимости от обстоятельств
|
билет № 4
Гидролиз солей, содержащих многовалентные ионы. Образование кислых и основных солей при гидролизе. Константы гидролиза. Случаи необратимого гидролиза.
Вывести ионное произведение воды и указать следствия из него. Вывод проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: [Zn(OH)4]2- ⇄ Zn2+ + 4OH-
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) NaOH ; б) KCN ; в) ZnCl2 ; г) при нагревании и при разбавлении раствора?
( Кн[Zn(OH)4]2- =10-15, Кн[Zn(CN)4]2- =10-18)
При инфекционных заболеваниях для обезвреживания токсинов назначают 0,055 М раствор сульфата Fe (III). Найти массовую долю растворенного вешества и массу иона железа (в мг) в шприце объёмом 5 мл ( = 1 г/мл).
Найти Н+ , ОН- и рН 0,4 М раствора гидроксида бария.
Как изменится рН ацетатного буферного раствора, если к 1 л этого буферного раствора, составленного из равных объемов 1 н компонентов, прибавить 0,1 моль-эквивалент HCl? Написать уравнения ,протекающих при этом реакций и определить буферную ёмкость по кислоте.
Рассмотрите состав и механизм действия белковой буферной системы. Почему она является самой мощной буферной системой организма в целом?
Раствор ацетата калия – осмотический диуретик. рН его раствора равен 8,40. Рассчитайте См соли, если Кд кислоты = 1.75 ·10-5.
Написать уравнение диссоциации и константу нестойкости комплексного соединения тетрахлоропалладата(II) натрия. Как изменится равновесие диссоциации комплексного иона при добавлении: а) КI; б) NaCl; в) KCN? В каком случае произойдет разрушение исходного комплексного иона, если Кн[PdCl4]2- =10-13, Кн[PdI4]2- =10-25, Кн[Pd(CN)4]2- = 10-42?
Молярная масса вещества 40 г/моль. Ккр(Н2О) = 1,86 К·кг/моль. Температура замерзания раствора, состоящего из 600 г воды и 40 г растворенного неэлектролита, составляет __°C.
1) -2,7
2) -1,7
3) -0,93
4) -3,1
Эндергоническими называют процессы, в которых
1) ΔH < 0
2) ΔG < 0
3) ΔH > 0
4) ΔG > 0
| |
 Скачать 169.49 Kb.
Скачать 169.49 Kb.