билет № 6
Гидролиз солей: определение, сущность процесса, причина и следствие. Гидролиз солей слабых одноосновных кислот и сильных оснований: степень и константа гидролиза, связь ее с константой диссоциации слабого электролита, образующегося при гидролизе. Расчет рН среды. ( на примере NaNO2)
Вывести общую константу нестойкости комплексного иона [Au(CN)2]1-. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: Н2СО3 ⇄ НСО3- + Н+.
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) HCl; б) KBr; в) NaHCO3; г) при нагревании и при разбавлении раствора?
При аритмии используют раствор КCl. Рассчитать массу хлорида калия и массу ионов К⁺ (мг) в 200 мл 0,25М раствора КCI (ρ = 1 г/мл).Чему равна массовая доля КCI в этом растворе?
Найти Н+ и ОН- в крови человека, если рН крови в норме 7,36 .
Определить рН фосфатного буферного раствора, содержащего 50 мл 0,1 н. дигидрофосфата натрия и 25 мл 0,2 н. раствора гидрофосфата натрия. Показать механизм буферного действия.
Рассчитать соотношение компонентов гидрокарбонатной буферной системы в плазме крови при рН= 7,40? К избытку каких эквивалентов (кислых или основных) система наиболее устойчива?
Написать молекулярные и ионные уравнения гидролиза соли CuCl2. Рассчитать рН 0,01 н раствора соли , считая, что гидролиз протекает по I ступени (КД2= 3,4.10-7).
Написать уравнение диссоциации гексацианоферрата(II) калия и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) KOH; б) окислителя; в) KCN? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Fe(OH)4]2- =10-9, Кн[Fe(CN)6]4- =10-37, Кн[Fe(CN)6]3-=10-44?
Температура замерзания децимоляльного раствора NaCl по сравнению с децимоляльным раствором АlCl3
1) ниже
2) не может быть определена
3) одинакова
4) выше
Ответ объяснить.
Термодинамической функцией состояния системы не является
1) внутренняя энергия
2) энтальпия
3) работа
4) энтропия
|
билет № 7
Буферные растворы: определение и свойства. Вывод формулы рН для основных буферных растворов (уравнение Гендерсона-Гассельбаха). Зона буферного действия.
Вывести константу гидролиза соли NH4Cl и показать ее связь с константой диссоциации слабого основания. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: AgCl(тв) ⇄ Ag+(р-р) + Cl-(р-р).
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) AgNO3; б) NaCl; в) HNO3; г) при нагревании и при разбавлении раствора?
Сколько г магнезии (MgSO4∙7H2O используется в качестве слабительного) нужно взять для приготовления 100 мл 4,5%-ного раствора MgSO4 (ρ = 1 г/мл)? Рассчитать массу ионов магния ( в мг) в полученном растворе.
Найти концентрацию кислоты и рН в растворе СН3СООН, если = 2%, Кд= 1,75.10-5.
Определить буферную емкость фосфатного буферного раствора, если после добавления 10 мл 0,5 н раствора щелочи к 20 мл буферного раствора рН его изменилось от 7,20 до 8,00.
Показать механизм действия гидрокарбонатной буферной системы крови. Каким образом она сохраняет физиологическое значение рН, если в системе:
а) возрастает активная концентрация ионов водорода.
б) уменьшается активная концентрация ионов водорода.
Написать молекулярные и ионные уравнения гидролиза соли Pb(NO3)2 и выражение для Кг. Рассчитать рН 0,02 М раствора соли, полагая, что гидролиз протекает по I ступени (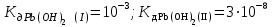 ). ).
Написать уравнение диссоциации дицианоаргентата(I) лития и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) ацетата калия; б) FeCl3; в) KCN? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Ag(CH3COO)2]- =2.10-1, Кн[Fe(CN)6]3- =10-44, Кн[Ag(CN)2]- =10-21?
В 5.4 %-ном растворе глюкозы эритроциты будут:
1) находиться в равновесном состоянии
2) подвергаться гемолизу
3) подвергаться плазмолизу
4) подвергаться лизису
Ответ объяснить.
Живая клетка является термодинамической системой:
1) изолированной
2) закрытой
3) открытой
4) замкнутой
| |
 Скачать 169.49 Kb.
Скачать 169.49 Kb.