билет № 8
Метод кислотно-основного титрования (метод нейтрализации). Основные положения. Применение. Титранты, стандартные и определяемые вещества. Кислотно-основные индикаторы и их характеристики. Кривые кислотно-основного титрования.
Вывести ионное произведение води и указать следствия из него. Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: Н3ВО3 Н+ + Н2ВО3-
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) HCl; б) NaOH; в) KCl; г) при нагревании и при разбавлении раствора?
Рассчитать молярную концентрацию 0,9% раствора NaCI (физиологического раствора), массовую долю ионов натрия и ионов хлора. Сколько мг этих ионов содержится в капельнице объёмом 200 мл ?
В 0,07 М растворе плавиковой кислоты [OH-] = 1,6.10-12 моль/л. Найти рОН, рН и .
Определить рН буферного раствора, приготовленного из 300 мл 0,1 н раствора СН3СООН и 150 мл 0,05 н раствора NaCH3COO , если Кд= 1,75.10-5.
Рассчитать, в каком молярном соотношении находятся компоненты фосфатной буферной системы в плазме крови при рН=7,40. Показать механизм действия этой буферной системы при добавлении а) HCl; б) КОН.
Написать молекулярные и ионные уравнения гидролиза соли Na3PO4 и выражение для Кг. Рассчитать рН 0,08 н раствора этой соли. 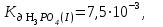 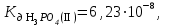 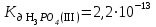
Написать уравнение диссоциации тетратиоцианатoкупрата(II) калия и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) NaOH; б) KCN; в) KCNS? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Cu(OH)4]2- =10-19, Кн[Cu(CN)4]2- =10-31, Кн[Cu(CNS)4]2- =10-7 ?
У морских животных по сравнению с пресноводными животными осмотическое давление крови
1)одинаково
2) ниже
3) выше
4) не может быть определено.
Ответ обосновать.
Первый закон термодинамики отражает связь между
1) работой, теплотой и внутренней энергией
2) свободной энергией Гиббса, энтальпией системы
3) работой и тепловой энергией
4) работой и внутренней энергией
|
билет № 9
Комплексные соединения. Диссоциация. Константы нестойкости и устойчивости комплексов. Устойчивость и разрушение комплексных соединений в растворах. Рассмотреть на конкретных комплексных соединениях. Токсическое действие солей тяжелых металлов. Антидоты.
Вывести константу диссоциации уксусной кислоты и показать ее связь со степенью диссоциации (закон разведения Оствальда). Вывод константы проводить, используя закон действия масс и основное условие равновесия:  . .
Дано равновесное состояние: NH4+ + Н2О ⇄ NH4OH + Н+. Какой процесс отражает это уравнение?
Используя принцип Ле-Шателье, указать, куда и почему сместится равновесие при добавлении:
а) NH4NO3; б) KCl; в) NaOH; г) при нагревании и при разбавлении раствора?
Для улучшения эритропоэза назначают 0,065 М раствор сульфата хрома (III). Найти массовую концентрацию этого раствора и число мг ионов Cr3+ в шприце объемом 5 мл (пл.= 1).
Муравьиную кислоту (Кд =1,8·10–4) в медицине применяют в хирургии в качестве предоперационного антисептического средства. pH раствора муравьиной кислоты 2,25. Рассчитать молярную и массовую концентрацию кислоты в этом растворе.
Какие объемы 1 н растворов NaH2PO4 и Na2HPO4 надо взять для приготовления 1 л буферного раствора с рН = 7,8? Показать механизм буферного действия этого раствора.
Какая из двух кислотных буферных систем: а) рН=рК+1; б) рН=рК-1 обладает большей буферной емкостью по щелочи? Почему? Сравните буферные системы крови по величине их буферной ёмкости.
Написать молекулярные и ионные уравнения гидролиза соли K2SO3 и выражение для Кг. Рассчитать рН и h 0,003 М раствора этой соли , считая, что гидролиз протекает по I ступени и 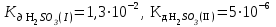 . .
Написать уравнение диссоциации хлорида тетраамминкобальта(II) и выражение для константы нестойкости комплексного иона. Как изменится равновесие диссоциации комплексного иона при добавлении: а) CuSO4; б) HCl; в) окислителя? В каком случае произойдет разрушение исходного комплексного иона, если Кн[Сo(NH3)6]3+=10-35, Кн[Cu(NH3)4]2+ =10-14, Кн[Co(NH3)4]2+=10-6?
Описать поведение эритроцитов в 0.7%-ном растворе NaCl. Каким будет этот раствор по отношению к плазме крови?
1) гемолиз, гипотоническим
2) плазмолиз, гипотоническим
3) гемолиз, гипертоническим
4) плазмолиз, гипертоническим
Закрытой называют такую систему, которая
1) не обменивается с окружающей средой ни веществом, ни энергией
2) обменивается с окружающей средой и веществом, и энергией
3) обменивается с окружающей средой энергией, но не обменивается веществом
4) не обменивается с окружающей средой энергией, но обменивается веществом
| |
 Скачать 169.49 Kb.
Скачать 169.49 Kb.