АНЕМИИ. Диагностические критерии анемии (воз Cappellini, 2015)
 Скачать 1.71 Mb. Скачать 1.71 Mb.
|
|
АНЕМИИ Анемия - состояние, характеризующееся уменьшением количества эритроцитов и уровня гемоглобина в единице объема крови. Диагностические критерии анемии (ВОЗ; Cappellini, 2015*): Для мужчин (18 лет и старше): RBC < 4,0 млн/мкл, Hb < 130 г/л, Ht < 40 % Для женщин (небеременные, 18 лет и старше) RBC <3,8 млн/мкл, Hb < 120 г/л, Ht < 36 % Изменение Hb, RBC у беременных Увеличение объёма плазмы на 25-50%; Повышение количества эритроцитов на 15-30% от исходного уровня; Соотношение эритроциты/объем плазмы снижается, что ведет к уменьшению Ht и и уровня Hb. Нефизиологическая анемия у беременных I и III триместр – Hb<110 г/л II триместр – Hb<105 г/л Эпидемиологические данные Женщины – 29 случаев анемии на 1000; Мужчины 6 случаев анемии на 1000 до 45 лет, 18,5:1000 для лиц старше 75 лет. Анемия хронических заболеваний является второй по распространенности после ЖДА. Основные клинических проявления анемий слабость; бледность; головокружение; возможны обмороки; желтуха – более характерный признак именно для гемолитических анемий. Вопросы классификации Общепризнанной единой классификации анемий не существует. Анемии деляют по величине среднего объема (МСV): микроцитарные МСV<80 фл; макроцитарные МСV>95 фл; нормоцитарные МСV 80÷95 фл По значению цветового показателя или при современном подходе значению MCH делятся на: гипохромные MCH<26 пг; гиперхромные MCH>32 пг; нормохромные MCH 26÷32 пг По степени тяжести анемии делятся на: Тяжелые – уровень Нb<70 г/л; Средней степени тяжести – уровень Нb 70÷100 г/л; Легкие анемии – Нb>100 г/л. Патогенетическая классификация анемий I. вследствие недостаточного образования эритроцитов или гемоглобина (ретикулоциты не увеличены: 2 - 12‰) II. вследствие усиленного разрушения эритроцитов (ретикулоцитоз: выше 20‰) III. вследствие острой кровопотери (характерная клиническая картина, ретикулоцитоз начиная с 3-5 дня) Диагностика анемий 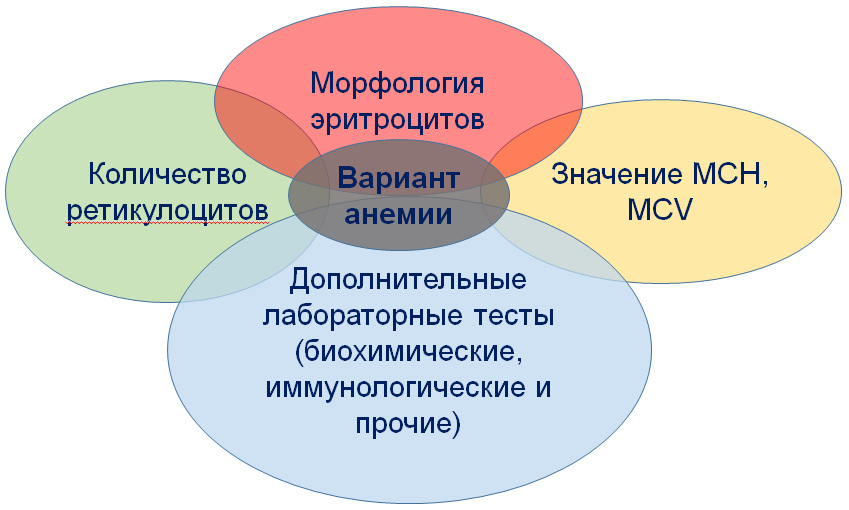 Ретикулоцитарные параметры  Классические параметры ретикулоцитов: RET% - относительное количество ретикулоцитов в % или ‰; RET# - абсолютное количество ретикулоцитов х109/л Референсный интервал 2-12‰ (при микроскопическом методе подсчета в окрашенных мазках) Референсный интервал автоматизированного метода может отличаться, верхняя граница обычно 20‰ При гемолитических анемиях число ретикулоцитов >100х109/л или >20‰ Индекс продукции ретикулоцитов RPI = (RET%xHt/45)/время созревания ретикулоцитов RET – число ретикулоцитов в % Нt – гематокрит больного, л/л Время созревания ретикулоцитов - дни дозревания ретикулоцитов в периферической крвои 0,45 – нормальный гематокрит RPI >3 свидетельствует о повышенной пролиферативной активности костного мозга, анемия носит гемолитический характер. Изменение длительности созревания ретикулоцитов при анемии
Если система кроветворения функционирует нормально, то степень стимуляции костного мозга обратно пропорциональна степени анемии, увеличиваясь максимально в 6-8 раз по сравнению с нормой. Для более точной оценки эритроцитарной продукции рассчитывается индекс продукции ретикулоцитов. Ретикулоцитарный ответ на анемию при нормальной функции костного мозга
Параметры, характеризующие степень зрелости ретикулоцитов LFR% - популяция ретикулоцитов с низкой флуоресценцией (87-99%); MFR% - популяция ретикулоцитов со средней флуоресценцией (2-12%); HFR% - популяция ретикулоцитов с высокой флуоресценцией. MFR%+ HFR% = IFR (immaturereticulocytefraction) – фракция незрелых ретикуоцитов (норма 2-14%) Служит индикатором активности эритропоэза. Фракция незрелых ретикулоцитов (IFR,%). Клиническое значение Повышена при гемолитических анемиях. При терапии анемий увеличивается на несколько дней раньше, чем относительное количество ретикулоцитов Ранний индикатор ответа на терапию витаминами, препаратами железа, эритропоэтином. Анемии вследствие недостаточного образования эритроцитов или гемоглобина (ретикулоциты не увеличены: 2 - 12‰) Железодефицитная Гипохромные нежелезодефицитные Мегалобластные Гипо- и апластические Метапластические Анемии вследствие усиленного разрушения эритроцитов (ретикулоцитоз: выше 20‰) Гемолитические наследственные приобретенные ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ Основные пути обмена железа 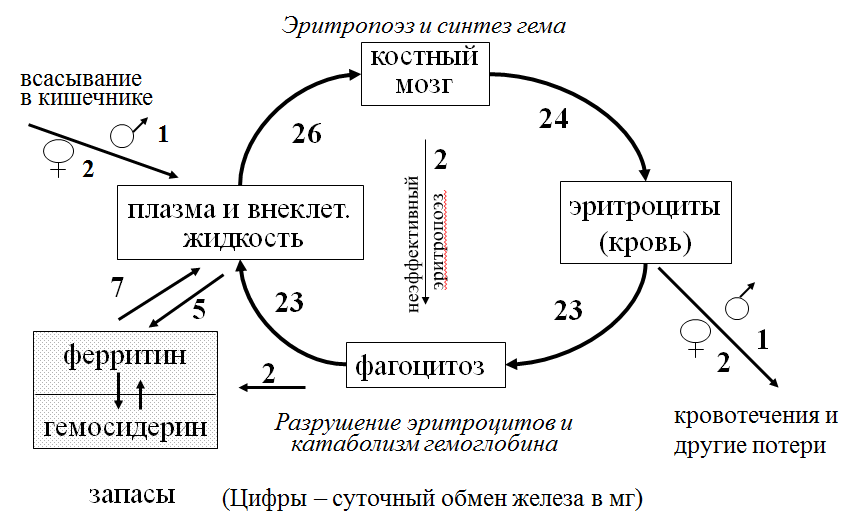 Распределение железа в организме
Суточный обмен железа
Потери железа Ежедневная потеря 1 мг железа складывается из: 0.6 - 0.7 мг с калом, 0.1 – с мочой, 0.2- 0.3 – с потом/ С 1 мл крови теряется 0.5 мг железа При физиологической менструации (3-4 дня, необильная, без сгустков) кровопотеря составляет 35-80 мл (0.7-1.3 мг/сут). У 11-18% здоровых женщин кровопотеря достигает 120-150 мл (2-2.5 мг/сут). Во время нормальной беременности суммарные «затраты» 800-1200 мг: Безвозвратно утрачивается 800 мг (плоду 300 мг, в плаценту 200 мг, кровопотеря в нормальных родах 50-75 мг, лактация 6 мес 150 мг) Реутилизируется после родов 600-700 мг (увеличение числа эритроцитов и гемоглобина на 20-25%) «Экономия» из-за отсутствия менструаций 300-600 мг (15 мес по 20-40 мг/мес) Поступление железа из пищи ВСАСЫВАЕТСЯ, В ОСНОВНОМ, ИЗ ГОВЯДИНЫ И ТЕЛЯТИНЫ (10%) ПОЛНОЦЕННАЯ ДИЕТА (80-100 г МЯСА) СОДЕРЖИТ 15 мг ЖЕЛЕЗА, ИЗ КОТОРЫХ ВСАСЫВАЕТСЯ МЕНЕЕ 1.5 мг ИЗ ЗЛАКОВОЙ ДИЕТЫ УСВАИВАЕТСЯ МЕНЕЕ 0.7 мг ЖЕЛЕЗА, ЧЕГО ХВАТАЕТ ЛИШЬ НЕКОТОРЫМ МУЖЧИНАМ УВЕЛИЧИВАЮТ ВСАСЫВАНИЕ ЖЕЛЕЗА АСКОРБИНОВАЯ КИСЛОТА И САХАРА, УГНЕТАЮТ - ЗЛАКИ, ТАНИНЫ (ЧАЙ), ОРЕХИ, БОБЫ, СОЯ 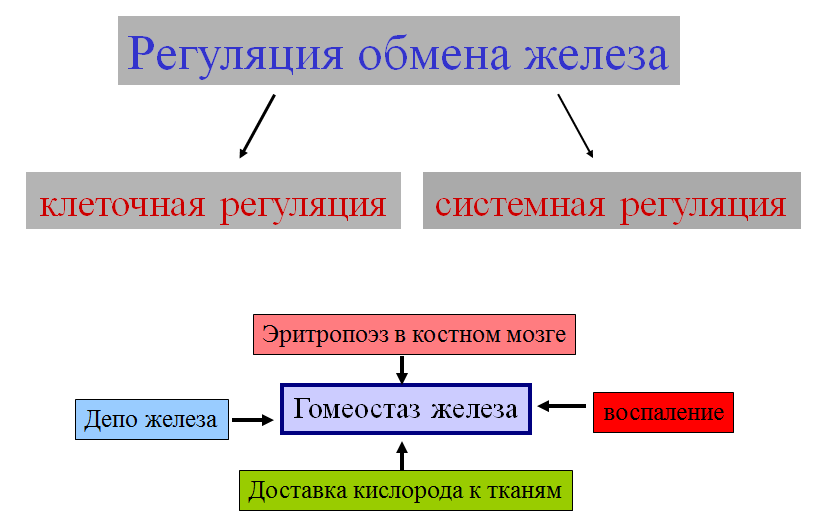 Всасывание железа в желудочно-кишечном тракте Основные процессы: Пищевое железо Fe3+ превращается в Fe2+ под действием ферроксидазы на апикальной мембране клеток слизистой оболочки тонкой кишки. Fe2+ может транспортироваться внутрь энтероцита переносчиком DMT-1. Внутри энтероцита железо может хранится, связавшись с белком ферритином. Транспортируется железо в плазму с помощью белка ферропортина. Чтобы связаться с трансферрином железо Fe2+ вновь превращается Fe3+ под действием ферроксидазы (гефаэстин) на базальной мембране. Трансферрин переносит железо к тканям. Транспорт железа Трансферрин Транспортный белок (-1-глобулин), гликопротеин, 2 центра связывания, 88 кДа. Переносит Fe из ЖКТ к эритрокариоцитам и в тканевые депо (печень и др.). Нормальный уровень: 2,60,05 г/л. Насыщение трансферрина железом: 30-75%. Поступает в клетку путем эндоцитоза: захват клеткой комплекса Fe-трансферрин. Взаимодействие внутри- и внеклеточного пулов железа. Регуляция Чем выше пролиферативная активность, тем значительнее экспрессия рецепторов трансферрина (до 800.000 на поверхности эритрокариоцита). Чем ниже содержание Fe в клетке, тем выше экспрессия рецепторов трансферрина. При высокой скорости синтеза рецепторов трансферрина происходит угнетение синтеза молекул ферритина. Депонирование железа: ферритин и гемосидерин Ферритин (500 кДа; содержит 15-20% от общего Fe) Внутриклеточный протеин — показатель величины запасов железа: кратковременное и длительное депонирование Fe2+ в тканях. 1 нг/мл сывороточного ферритина соответствует приблизительно 8 мг железа в депо. Показатель степени острофазового ответа и деструктивных процессов: повышение продукции ферритина (инфекция, иммунные комплексы, опухоли). Основные источники сывороточного ферритина: 1. Моноциты крови 2. Купферовские клетки печени 3. Макрофаги селезенки. Гепсидин – гормон, которому принадлежит ключевая роль в системной регуляции обмена железа С 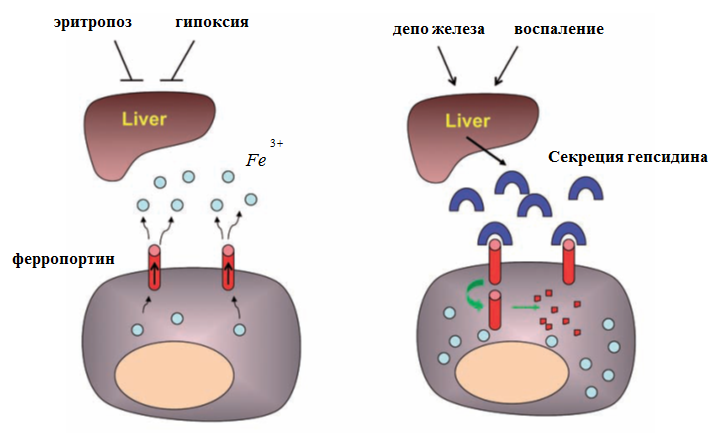 интезируется гепсидин главным образом гепатоцитами. Синтезируется в виде прекурсора (пре-прогепсидина), который состоит из 84 аминокислот. Путем двух энзиматических расщеплений превращается в активную форму. интезируется гепсидин главным образом гепатоцитами. Синтезируется в виде прекурсора (пре-прогепсидина), который состоит из 84 аминокислот. Путем двух энзиматических расщеплений превращается в активную форму.Биоактивная форма гепсидина состоит из 25 аминокислот. Существуют также 2 формы гепсидина, состоящие из 20 и 22 аминокислот. Биологическая роль их пока неясна. Гепсидин действует главным образом на энтероциты 12-перстной кишки и макрофаги. Гепсидин взаимодействует с ферропортином, единственным экспортером железа у позвоночных. Гепсидин вызывает интернализацию, а потом и деградацию ферропортина, что блокирует высбождение железа из клеток. Гепсидин блокирует всасывание железа и освобождение его из макрофагов. Растворимые рецепторы к трансферрину Транспорт железа в клетку осуществляется при взаимодействии комплекса железо-трансферрин со специфическим рецептором (TfR). Приблизительно 80% TfR находится на плазматической мембране эритропоэтических клеток. Плотность TfR повышается по мере дифференцировки эритрокариоцитов вплоть до ретикулоцита, но на зрелых эритроцитах TfR отсуствуют. Внеклеточная часть рецептора TfR может подвергаться расщеплению внеклеточными протеазами. В результате от рецептора отделяется и попадает в кровь стабильный фрагмент – пептид с м.м. 95 кДа, называемый «растворимым рецептором к трансферрину» (sTfR). При дефиците железа уровень растворимых рецепторов к трансферрину повышается, поскольку возрастает уровень TfR на мембране эритрокариоцитов, так как клетка испытывает «железное голодание». ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ - САМОЕ РАСПРОСТРАНЕННОЕ НА ЗЕМЛЕ ЗАБОЛЕВАНИЕ. ЕЙ БОЛЕЮТ ОКОЛО 50% ЖЕНЩИН И 40% МУЖЧИН. НАИБОЛЕЕ ЧАСТО ОНА ВСТРЕЧАЕТСЯ СРЕДИ НЕОБЕСПЕЧЕННЫХ СЛОЕВ НАСЕЛЕНИЯ, ЖЕНЩИН И ДЕТЕЙ Частота ЖДА в России: Женщины: в среднем 20-30% в возрасте 12-50 лет 40-60% (в странах, где есть пищевые добавки железа 8-13%) у беременных 70-100% Дети раннего возраста (до 3-6 лет) 45-60% Мужчины 1-3% ЖДА у детей В детском возрасте 90% всех анемий составляют ЖДА (М. Хертл,1990). Таким образом, назначая препараты железа, врач «угадает» в 9 случаях из 10. Остальные 10% анемий включают врожденные и приобретенные гемолитические и апластические анемии, анемии хронических болезней. Этиология железодефицитной анемии
Клиническая картина жда Анемия - бледность кожи и слизистых, одышка и сердцебиение при физическойнагрузке, стенокардия напряжения (Hb<70 г/л) Сидеропенический синдром (часто при Hb>120 г/л) Немотивированная слабость, апатия, хроническая усталость Уплощение ногтей, их ломкость, трещины, поперечные борозды; резкое выпадение, сухость и ломкость волос, ранняя седина; сухость и зуд кожи; гиперкератоз; болезненные незаживающие трещины в углах рта, на языке, на пальцах рук и ног, пятках; атрофия слизистых (язык, пищевод, желудок, половые органы). Извращения вкусовых и обонятельных пристрастий Мышечная слабость, слабость сфинктеров (недержание мочи), запоры, сутулость, шаркающая походка, длительные менструации, миокардиодистофия Частые инфекции, увеличение аденоидов Отеки Лихорадка Пожелтение кожи ладоней, подошв, носогубного треугольника, ушей Окрашивание мочи после съедания свеклы Потливость и холодные конечности Клинические проявления тканевого дефицита железа 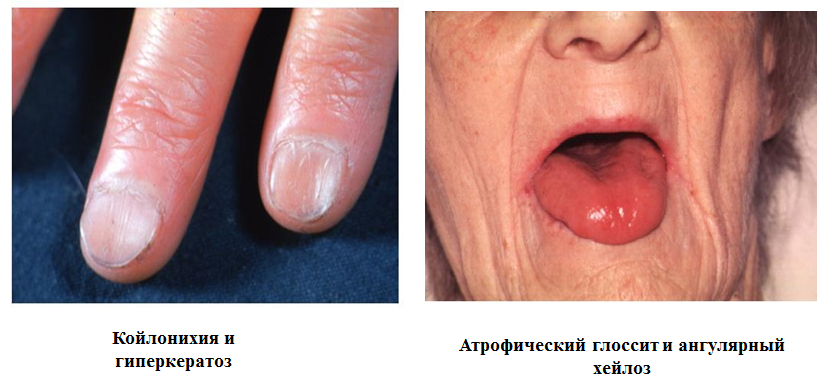 Изменения морфологии эритроцитов при ЖДА А 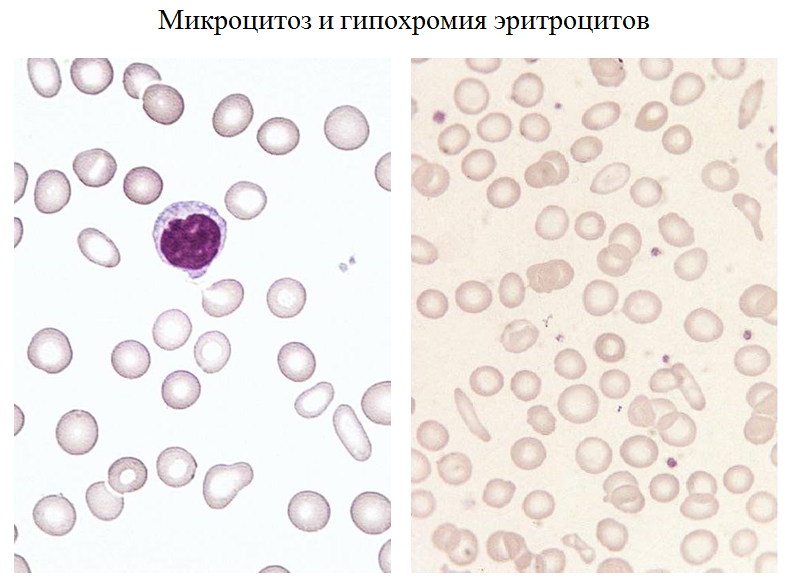 низоцитоз – различной степени выраженности (зависит от тяжести анемии), преобладают микроциты. При тяжелой анемии (гипорегенераторной стадии) может быть смешанный анизоцитоз (микроциты и макроциты). низоцитоз – различной степени выраженности (зависит от тяжести анемии), преобладают микроциты. При тяжелой анемии (гипорегенераторной стадии) может быть смешанный анизоцитоз (микроциты и макроциты).Пойкилоцитоз чаще всего слабо выраженный: могут быть в небольшом количестве овалоциты и мишеневидные эритроциты. ДИАГНОСТИКА ЖДА Клиническая картина (сидеропенический синдром) + наличие источника кровопотери + снижение Hb Гематологическая (общий анализ крови) анемия Нb 120 г/л; микроцитарная MCV 80 фл; гипохромная МСН 26 (27) пг; гетерогенная RDW14.5% ( анизоцитоз) гипорегенераторная ретикулоциты 20‰ Биохимическая Железо сыворотки Общая/латентная железосвязывающая способность сыворотки Насыщение трансферрина железом Повышение концентрации sTfR Ферритин Показатели обмена железа
Изменяются не только при дефиците железа, но и при АХЗ. Биохимическая диагностика ЖДА Ферритин ниже 12 мкг/л (референсные интервалы сильно зависят от пола и возраста пациента!!!). В клинических рекомендациях по диагностике и лечению ЖДА снижение ферритина – менее 30 мкг/л свидетельство ЖДА! Железо сыворотки ниже нижнего референсного интервала (10,6-28,6 мкмоль/л) Латентная железосвязывающая способность выше верхней границы референсного интервала ( 27,8 - 53,7 мкмоль/л) Общая железосвязывающая способность сыворотки выше верхней границы референсного интервала (45,3 - 77,1 мкмоль/л) или >69 мкмоль/л Увеличение концентрации трансферрина (референсный интервал 2 - 3,6 г/л) Насыщение трансферрина железом ниже 17% Повышение концентрации растворимых рецепторов к трансферрину (sTfR), более 2,9 мкг/мл 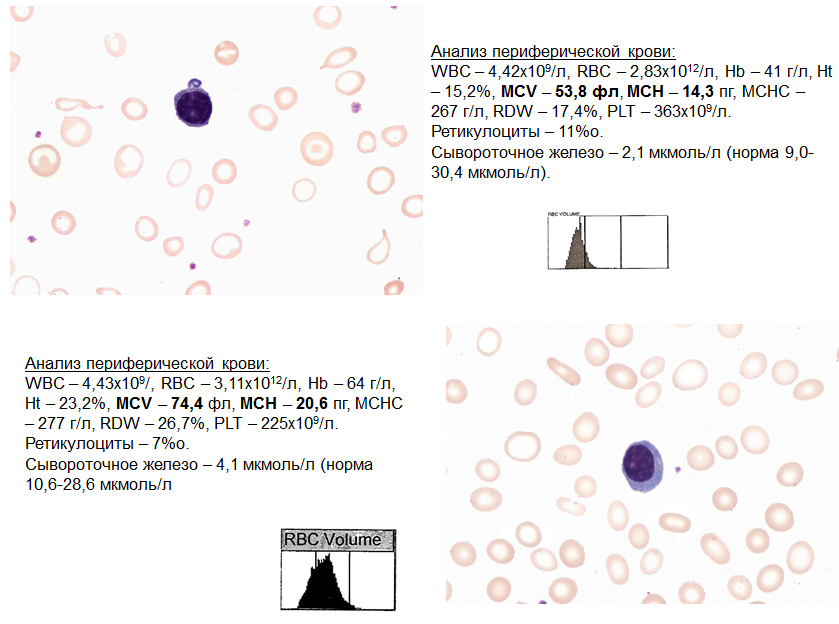 Последовательность возникновения лабораторных проявлений по мере усугубления дефицита железа ферритин анизоцитоз (RDW ) микроцитоз (MCV ) эллиптоцитоз гипохромия (MCH ) гемоглобин сывороточное железо Классификация дефицита железа по эритроцитарным индексам
1, 2 и 3 стадии – «латентный» дефицит железа Критерии анемии у детей раннего возраста Для детей 3 месяцев нижняя граница нормы гемоглобина 95 г/л; Повторное определение в возрасте 6 месяцев – нижняя граница 110 г/л; Показано профилактическое назначение препаратов железа в дозе 50% от лечебной детям из многоплодной беременности, рожденным с низкой массой тела, недоношенным. Современные принципы лечения железодефицитной анемии Устранение причины кровопотери Невозможность вылечить продуктами питания Отказ от переливаний крови использованиe только препаратов железа в адекватной дозе: 100 мг/сутки элементарного железа (детям – 5 мг/кг в сутки) Пероральное применение препаратов железа (парентеральное только при доказанном нарушении всасывания) Длительное применение препаратов (до восполнения депо) Препараты железа При лечении больных ЖДА с применением солевых препаратов железа могут возникать следующие проблемы: Возможность передозировки, и даже отравлений, вследствие негибкого дозирования, пассивного, неконтролируемого всасывания; Выраженный металлический вкус и окрашивание эмали зубов и десен, иногда стойкое; Взаимодействие с пищей и другими препаратами; Частый отказ пациентов от лечения (30-35% от начавших лечение больных. Свойства и преимущества препаратов на основе гидроксидпальмитозного комплекса («мальтофер», «феррум-лек»): Высокая эффективность; Высокая безопасность – нет риска передозировки, интоксикации и отравления; Отсутствие потемнения зубов и десен; Приятный вкус, который нравится детям; Отличная переносимость; Отсутствие взаимодействия с медикаментами и продуктами питания; Наличие антиоксидантных свойств; Существование лекарственных форм для всех возрастных групп (капли, сироп, жевательные таблетки, разовые ампулы, препарат железа с фолиевой кислотой для беременных женщин). Контроль эффективности терапии препаратами железа Увеличение фракции незрелых ретикулоцитов, нормализация показателей среднего объема ретикулоцитов и содержания гемоглобина в них (2-4 день); Ретикулоцитоз на 7-10 день от начала терапии препаратами железа; Начало повышения гемоглобина после 4 недель лечения препаратами железа; возможно использование следующих критериев – повышение Hb на 10 г/л и повышение Ht на 3% по отношению к уровню до лечения (США); Исчезновение клинических проявлений заболевания через 1-2 мес. лечения; Преодоление тканевой сидеропении, определяемое по уровню сывороточного ферритина (возвращение в границы референсного интервала). Длительность курса лечения препаратами железа Критерием излечения от ЖДА считается преодоление тканевой сидеропении, а не достижение нормального уровня гемоглобина. Это можно зафиксировать по нормализации уровня сывороточного ферритина. Клинический опыт показал, что для этого требуется не менее 3-6 месяцев в зависимости от тяжести анемии. Терапевтический план лечения ЖДА в зависимости от степени ее тяжести
НЕЭФФЕКТИВНОСТЬ ПРЕПАРАТОВ ЖЕЛЕЗА МОЖЕТ БЫТЬ ОБУСЛОВЛЕНА НЕПРАВИЛЬНО ПОСТАВЛЕННЫМ ДИАГНОЗОМ! Наиболее часто причиной этого могут быть недиагностированные: 1. КРОВОПОТЕРЯ ИЗ ЖКТ - наличие опухоли (!) 2. НЕЖЕЛЕЗОДЕФИЦИТНЫЕ МИКРОЦИТАРНЫЕ ГИПОХРОМНЫЕ АНЕМИИ 3. РЕДКИЕ ФОРМЫ ЖЕЛЕЗОДЕФИЦИТА - эндометриоз, гемосидероз легких 4. НАРУШЕНИЕ ВСАСЫВАНИЯ В КИШЕЧНИКЕ - амилоидоз и т.п МИКРОЦИТАРНАЯ И ГИПОХРОМНАЯ АНЕМИЯ - НЕ ВСЕГДА ЖЕЛЕЗОДЕФИЦИТНАЯ! ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА МИКРОЦИТАРНЫХ И ГИПОХРОМНЫХ АНЕМИЙ
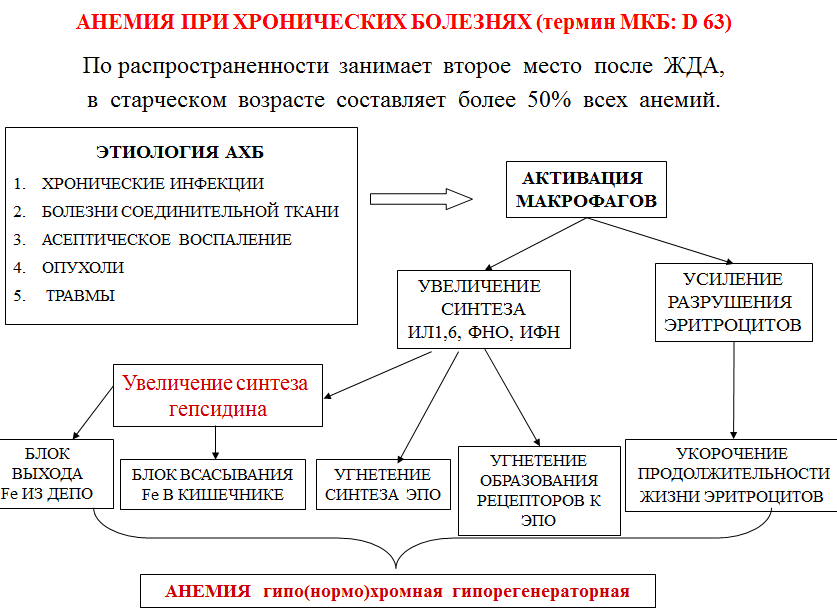 Эффекты провосполительных цитокинов ФНОα увеличивает эритрофагоцитоз через стимуляцию таргетных рецепторов. ИФНγ и липополисахариды усиливают экспрессию рецептора ДМТ-1 и увеличивают транспорт сывороточного железа в активированные макрофаги. ИФНγ и липополисахариды снижают экспрессию мРНК ферропортина (а значит и синтез белка), что ведет к задержке железа в макрофагах. ИЛ-4, ИЛ-10, Л-13 увеличивают трансферрин-опосредованный транспорт железа в активированные макрофаги Уменьшение синтеза и биологической активности ЭПО – один из основных факторов развития АХБ Уровень ЭПО неадекватен уровню анемии у больных АХБ. ИЛ-1, ФНОα индуцируют образование токсичных радикалов, которые повреждают клетки, продуцирующие ЭПО, что ведет к снижению образования ЭПО. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА АХБ И ЖДА
Диагностика АХБ Основа – наличие у пациента длительно текущего хронического заболевания. Природа заболевания обычно опухолевая, инфекционно-воспалительная или аутоиммунная. Исследование уровня ферритина, трансферрина, растворимых рецепторов к трансферрину. Подходы к дифференциальной диагностике ЖДА и АХЗ 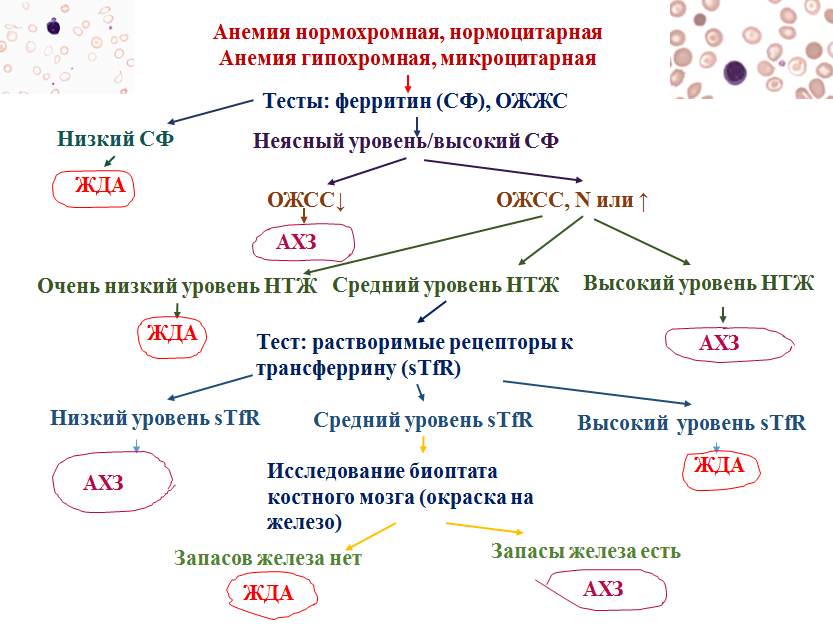 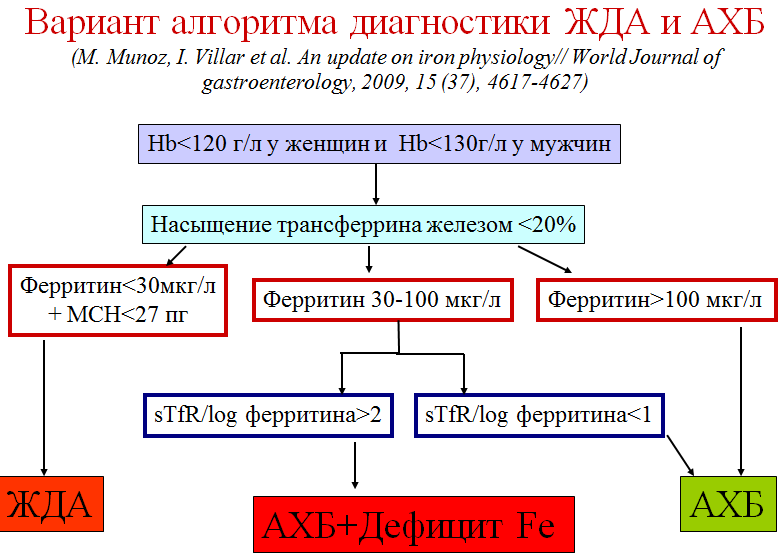 Особенности интерпретации показателей обмена железа при анемии на фоне ХПН ЖДА диагностируется у пациентов с уровнем ферритина ниже 100 мкг/л.* Если у пациентов % гипохромных эритроцитов >6%, НТЖ<20%, уровень ферритина выше 100 мкг/л, то имеется функциональный дефицит железа.* Лабораторный контроль проводится с интервалом от 1 до 3 месяцев в зависимости от клинической ситуации. ЛЕЧЕНИЕ АНЕМИИ ПРИ ХРОНИЧЕСКИХ БОЛЕЗНЯХ Терапия железом неэффективна и нежелательна. Устраняет анемию адекватная терапия основного заболевания. Эффективно назначение рекомбинантного эритропоэтина Показания к назначению рекомбинантных эритропоэтинов, целевые уровни Уровень Hb<100 г/л; Необходимо лечение ЭПО, если Hb<80 г/л; Целевой уровень гемоглобина при лечении ЭПО все время обсуждается, последние данные – концентрация Hb 110 г/л. Данный уровень Hb позволяет избежать неконтролируемого роста Hb, продолжающегося после отмены препарата. У больных АХБ избыточный уровень Hb сочетается с увеличением тромбозов и эмболий. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
