мм дипломная. Дипломная. Дипломная работа По специальности 060301 фармация Пятигорск, 2017 Работа выполнена на кафедрах
 Скачать 1.29 Mb. Скачать 1.29 Mb.
|
2.3. Изучение антимикробного действия гелей и мази .Антимикробную активность определяли методом диффузии в агар (способ «колодцев»). Данный метод основан на оценке угнетения роста тест-штаммов микроорганизмов под воздействием исследуемых веществ. В качестве тест-культур были выбраны следующие виды бактерий: Staphylococcus aureus (Type), Escherichia coli 055, Escherichia coli М17, Bacillus cereus – 96, Pseudomonas aeruginosa, Proteus vulgaris. Антимикробную активность доксициклиновых мазей на различных основах сравнивали с действием 1% раствора доксициклина, приготовленного на 0,9% хлориде натрия. Оценку результатов определения антимикробной активности проводили путём измерения диаметра зоны задержи роста тест-культур микроорганизмов вокруг «колодца», включая диаметр самого «колодца» [1]. Критерии оценки: 1) отсутствие зоны задержки роста – испытуемая культура не чувствительна к данной концентрации препарата; 2) диаметр зоны задержки роста 10 мм – умеренная чувствительность культуры к данной концентрации препарата; 3) диаметр зоны задержки роста более 10 мм – высокая чувствительность испытуемой культуры к данной концентрации препарата. 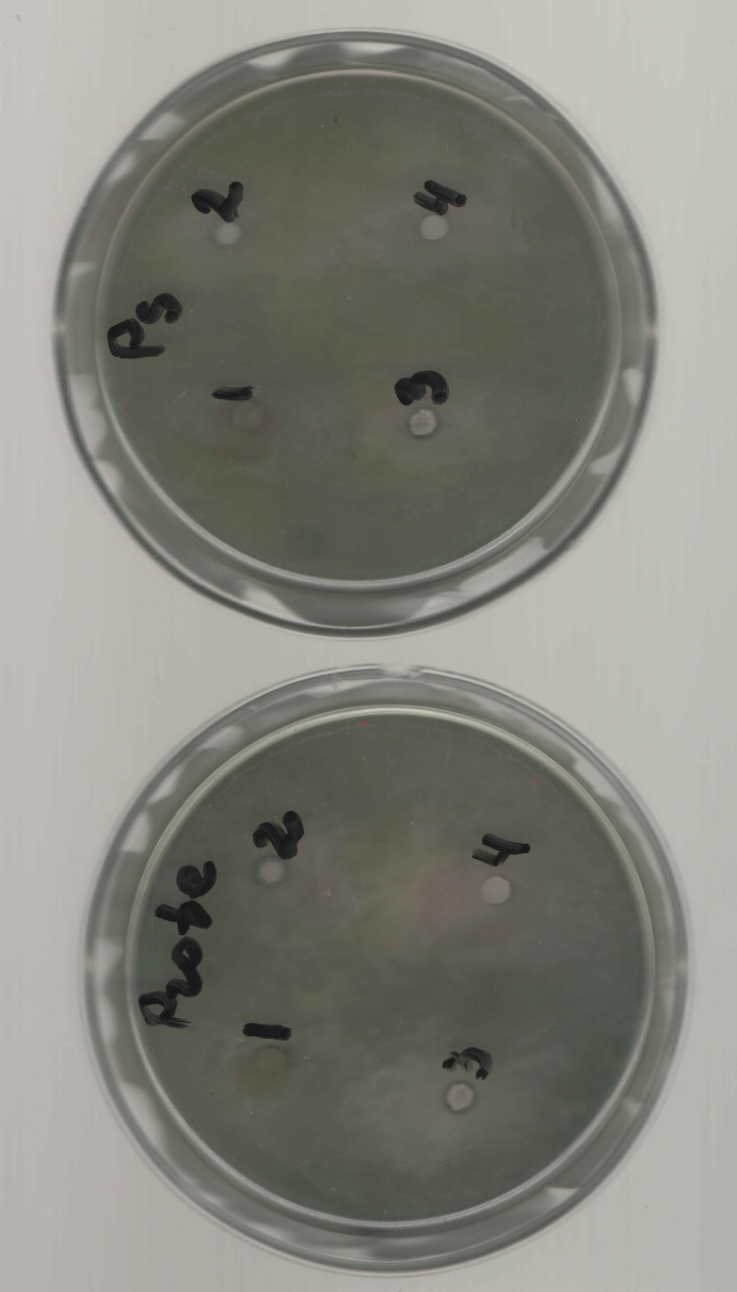 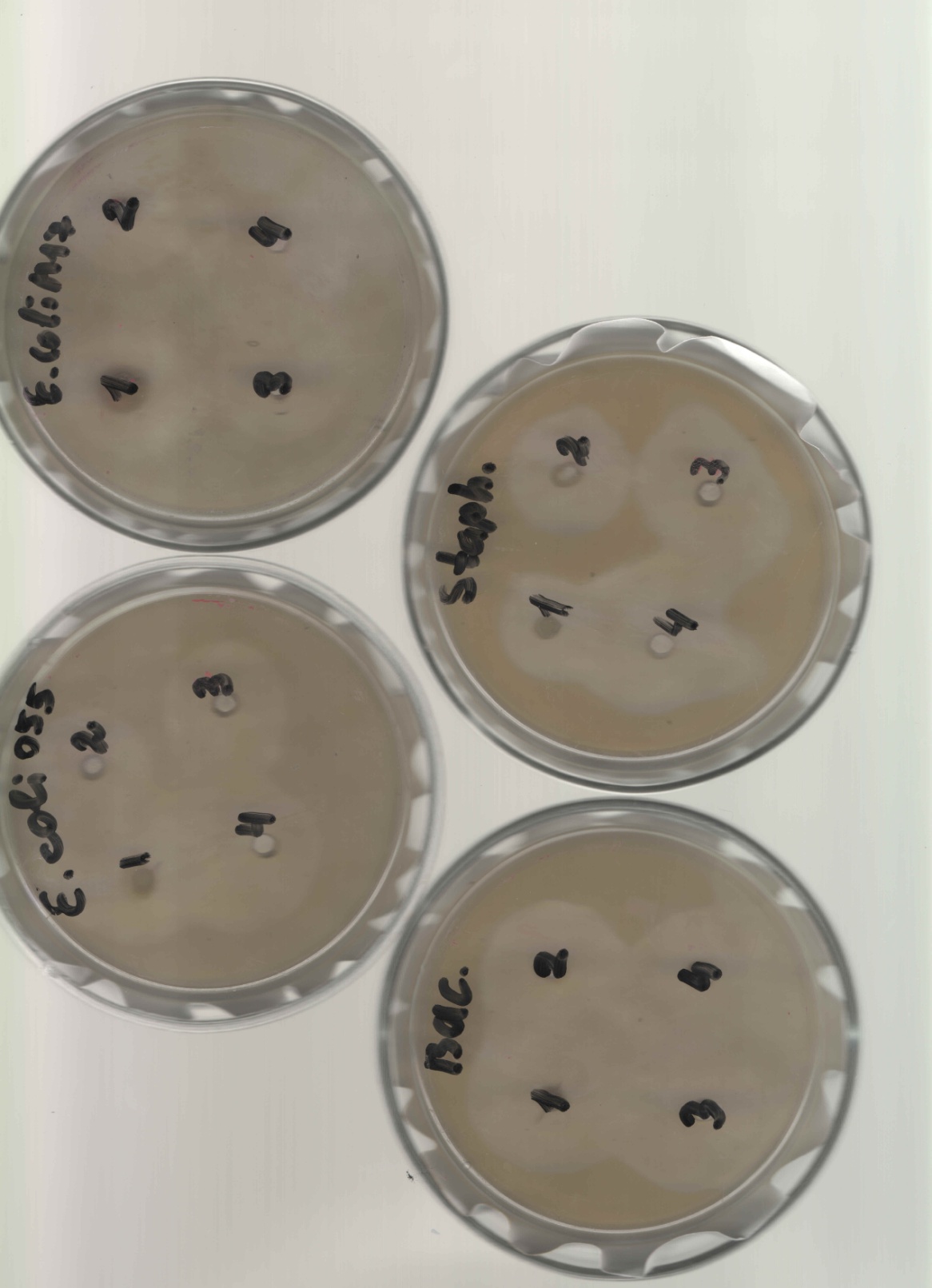 Результаты и обсуждение. Результаты определения антимикробной активности исследуемых веществ представлены в таблице 1. Таблица 1 Оценка диаметров зон подавления роста тест-культур микроорганизмов.
1-Staphylococcus aureus (Type), 2- Escherichia coli 055, 3- Escherichia coli М17, 4- Bacillus cereus – 96, 5- Pseudomonas aeruginosa, 6- Proteus vulgaris, Результаты и обсуждение. Из данных, приведённых в таблице 1, видно, что препарат сравнения - 1% раствор доксициклина, обладает выраженной антимикробной активностью, поскольку во всех тест-культурах диаметр зон подавления роста оказался больше 10 мм. При этом действие препарата на основе КМС анвилон было выражено в равной степени и сравнимо с таковым для 1% раствора доксициклина в отношении Proteus vulgaris, но превышало действие препарата сравнения в отношении Escherichia coli 055 и Bacillus cereus – 96. Действие препарата на основе КМС анвилон на Staphylococcus aureus (Type) и Pseudomonas aeruginosa оказалось несколько ниже в сравнении с 1% раствором доксициклина. Антимикробный эффект в тест-культуре Escherichia coli М17 значительно уступал препарату сравнения. Антимикробное действие препарата на основе ланолин-вазелин несколько превышало антибактериальный эффект 1% раствора доксициклина на Escherichia coli 055 и существенно превышало его в отношении Bacillus cereus – 96. Действие на Staphylococcus aureus (Type) и Escherichia coli М17 было наименее выраженным. Подавление роста Pseudomonas aeruginosa было незначительно снижено в сравнении с 1% раствором доксициклина. Антимикробный эффект отсутствовал на тест-культуру Proteus vulgaris, так как зона подавления роста составила меньше 10 мм. Антимикробное действие препарата на основе Beneceel TYPE: K4M-PH-CR 1% оказалось максимальным и превысило эффект 1% раствора доксициклина в отношении Bacillus cereus – 96. Зоны подавления роста тест-культур Staphylococcus aureus (Type), Escherichia coli М17 и Pseudomonas aeruginosa оказались значительно меньше в сравнении с 1% раствором доксициклина и сопоставимы с таковым в отношении Escherichia coli 055. Антимикробное действие на Proteus vulgaris отсутствовало. Таким образом, можно сделать вывод, что наибольшим антимикробным действием из исследуемых лекарственных средств обладает препарат на основе КМС анвилон. 2.5. Выводы по главе Изучены 4 состава геля и 1 мази. Определение скорости и степени высвобождения доксициклина гидрохлорида методом диализа через полунепроницаемую мембрану показало, что наибольший процент высвобождения доксициклина гидрохлорида обеспечивают композиция КМС аквилон и ланолин с вазелином. Установлено, что все изученные составы гелей и мази обладают широким спектром антибактериального действия. Выраженность антимикробного действия у гелей и мази аналогично контролю, если судить о размерах зон задержки роста микроорганизмов. Хранение гелей в различных условиях позволило избрать в качестве оптимального носителя доксициклина гидрохлорида композицию ГЭЦ, КМЦ аквилон и ланолин с вазелином, что подтверждено методом диализа через полупроницаемую мембрану. Разработана технологическая схема получения глазного геля и мази. Глава 3. Разработка методик анализа глазной мази с доксициклина гидрохлоридом 3.1. Определение подлинности доксициклина гидрохлорида в мази 3.1.1. Цветные качественные реакции. Для подтверждения подлинности доксициклина гидрохлорида, с учетом особенностей их химического строения, использовали качественные реакции, рекомендованные НД. При разработке методик качественного анализа глазной мази, руководствовались тем, что доксициклина гидрохлорид способен образовывать цветные качественные реакции. Известно, что для идентификации доксициклина гидрохлорида используют качественные реакции с хлоридом железа (III) и нипропруссидом натрия. Кроме того, это лекарственное вещество содержит ион хлора, который можно определить реактивом – раствором нитрата серебра. Для испытания на подлинность готовили модельную смесь мази. 5 г геля растворяли в 20 мл воды (раствор А). При анализе мази на липофильной основе 5 г мази растворяли в 20 мл воды при нагревании на водяной бане, охлаждали и фильтровали. Для определения подлинности доксициклина гидрохлорида в мази поступали согласно следующим методикам: Реакция с хлоридом железа (III) К 1 мл раствора А добавляли 0,5 мл 0,1 М гидроксида натрия и 0,2 мл раствора хлорида железа (Ш). Наблюдали образование темно-красно-коричневого окрашивания. Реакция на хлориды К 1 мл раствора А добавляли 0,5 мл разведенной азотной кислоты, и после растворения веществ прибавляли 0,5 мл раствора нитрата серебра, наблюдали образование белого творожистого осадка. Реакция с нитропруссидом натрия К1 мл раствора А прибавляли 0,5 мл 0,1 М раствора гидроксида натрия и 0,5 мл нитропруссида натрия. Наблюдали образование фиолетового окрашивания. Установлена специфичность для качественных реакций. Качественные реакции были проведены на сопутствующие вещества и сделан вывод об отсутствии положительного эффекта. Таким образом, с помощью цветных качественных реакций можно подтвердить подлинность доксициклина гидрохлорида в глазной мази. 3.1.2. Метод тонкослойной хроматографии Подлинность доксициклина гидрохлорида определяли с помощью ТСХ. 1,0 г модельной смеси мази растворяли в 10 мл этанола. 4 мкл раствора наносили на хроматографическую пластинку и растворы стандартного образца (СО) доксициклина гидрохлорида. В качестве подвижной фазы использовали хлороформ – спирт этиловый – кислоту уксусную ледяную ( 5:1:4 ). Хроматографирование осуществляли восходящим методом, проявляли в йодной камере. На хроматограмме (рисунок 5) наблюдались 2 пятна испытуемого раствора, соответствующих по величине 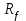 и интенсивности окрашивания пятнам стандартного образца доксициклина гидрохлорида. и интенсивности окрашивания пятнам стандартного образца доксициклина гидрохлорида. Для обнаружения пятен вычисляли величину 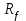 по уравнению: по уравнению: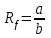 , ,где а – расстояние от линии старта до центра пятна; b– расстояние от линии старта до фронта подвижной фазы. Значения Rf, вычисленные по результатам трех определений составили: для доксициклина гидрохлорида 0,29 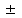 0,03. 0,03.Известно, что методику считают специфичной, если при хроматографировании анализируемого образца и свидетеля наблюдается совпадение зон адсорбции по значениям Rf. При выполнении анализа наблюдали совпадения по значениям Rf зон адсорбции стандартных образцов с пятнами лекарственных препаратов. Таким образом, метод тонкослойной хроматографии можно использовать для подтверждения подлинности доксициклина гидрохлорида в мази. 3.2. Количественное определение доксициклина гидрохлорида в глазных мазях Так как основное лекарственное вещество, входящее в состав глазной мази: доксициклина гидрохлорид имеет в своей структуре хромофорные группировки, то для его анализа может быть использован спектрофотометрический метод анализа. Были снят спектр поглощения 0,001% раствора доксициклина гидрохлорида в воде (рис 1) и установлено, что имеются две области интенсивного максимума при длинах волн 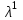 =277 нм и =277 нм и 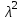 = 348нм.Это согласуется с данными литературы, а значит данный образец субстанции может быть использован в качестве СО при определении доксициклина гидрохлорида.в мазях спектрофотометрическим методом. = 348нм.Это согласуется с данными литературы, а значит данный образец субстанции может быть использован в качестве СО при определении доксициклина гидрохлорида.в мазях спектрофотометрическим методом.МЕТОДИКА Для приготовления раствора навеску 0,001 доксициклина гидрохлорида помещали в мерную колбу вместимостью 100 мл., растворяли в воде и доводили до метки тем же растворителем. 1мл полученного раствора помещали в мерную колбу вместимостью 100 мл, доводили водой до метки и перемешивали. Рисунок 1 - Спектр поглощения 0,001% раствора доксициклина гидрохлорида в воде 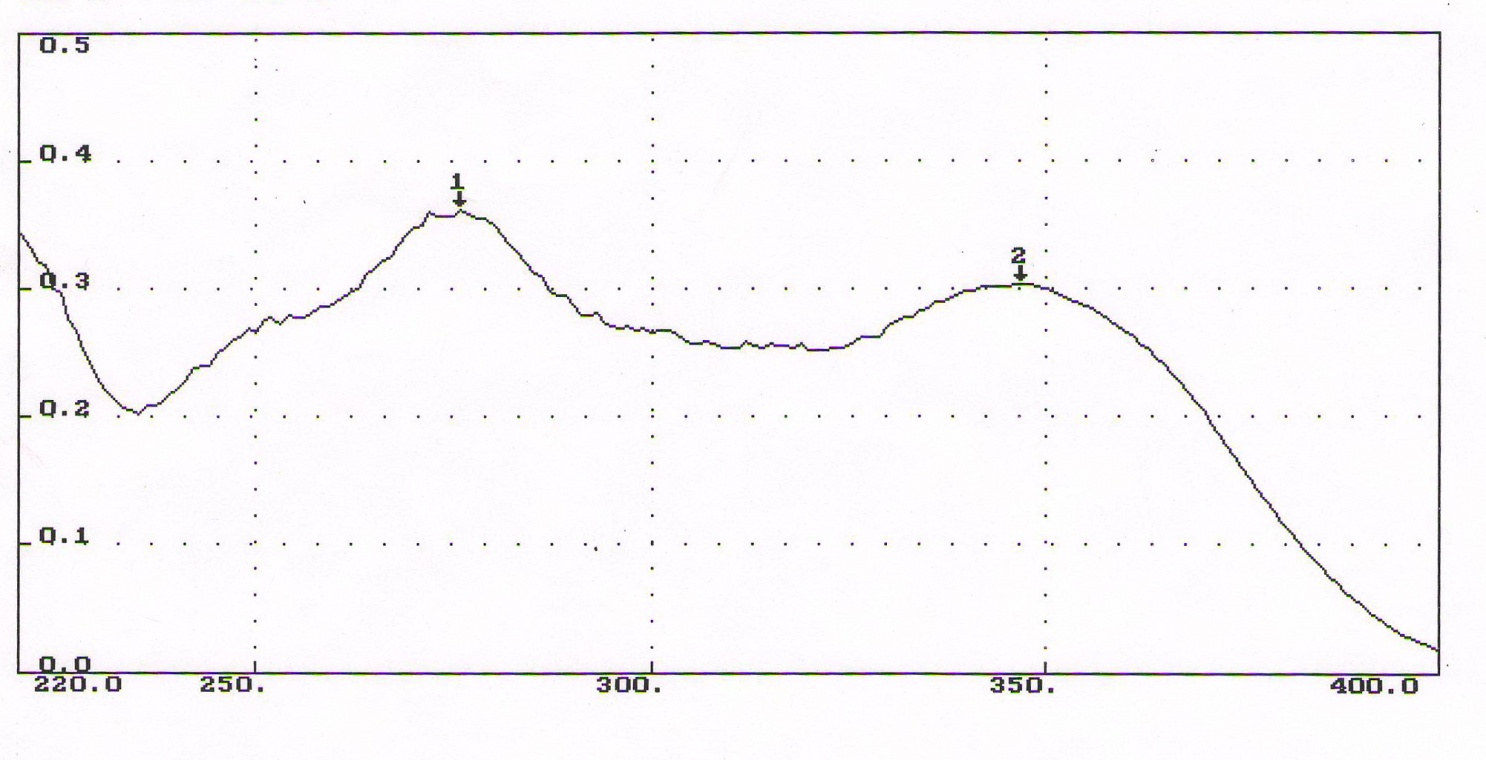 Следующим этапом исследования явилось изучение спектров поглощения доксициклина гидрохлорида в изучаемых образцах мазей. МЕТОДИКА: Точную навеску – 1 г модельной смеси мази помещали в мерную колбу вместимостью 100 мл, прибавляли 20 мл воды, перемешивали, доводили тем же растворителем до метки. 10 мл полученного раствора помещали в мерную колбу вместимостью 100 мл, доводили до метки, перемешивали. Снимали спектры поглощения водных растворов образцов гелей на спектрофотометре СФ-56 (рис 2) . В качестве раствора сравнения использовали воду. Для приготовления раствора доксициклина гидрохлорида в мази на липофильной основе точную навеску – 1 г модельной смеси мази помещали в колбу вместимостью 100 мл, прибавляли 20 мл воды, ставили на кипящую водяную баню и нагревали до расплавления основы. Охлаждали до застывания основы. Жидкость сливали в мерную колбу вместимостью 100 мл. Извлечение повторяли еще 2 раза по 20 мл. Все извлечения объединяли в мерной колбе вместимостью 100 мл, доводили водой до метки, перемешивали. Содержимое колбы фильтровали, отбрасывали первые 15 мл фильтрата . 10 мл полученного раствора помещали в мерную колбу вместимостью 100 мл, доводили до метки, перемешивали. Снимали спектры поглощения водных растворов образцов гелей на спектрофотометре СФ-56 (рис 3) . В качестве раствора сравнения использовали воду. Рисунок 2 - Спектры поглощения 0,001% раствора доксициклина гидрохлорида в мазях на гидрофильных основах 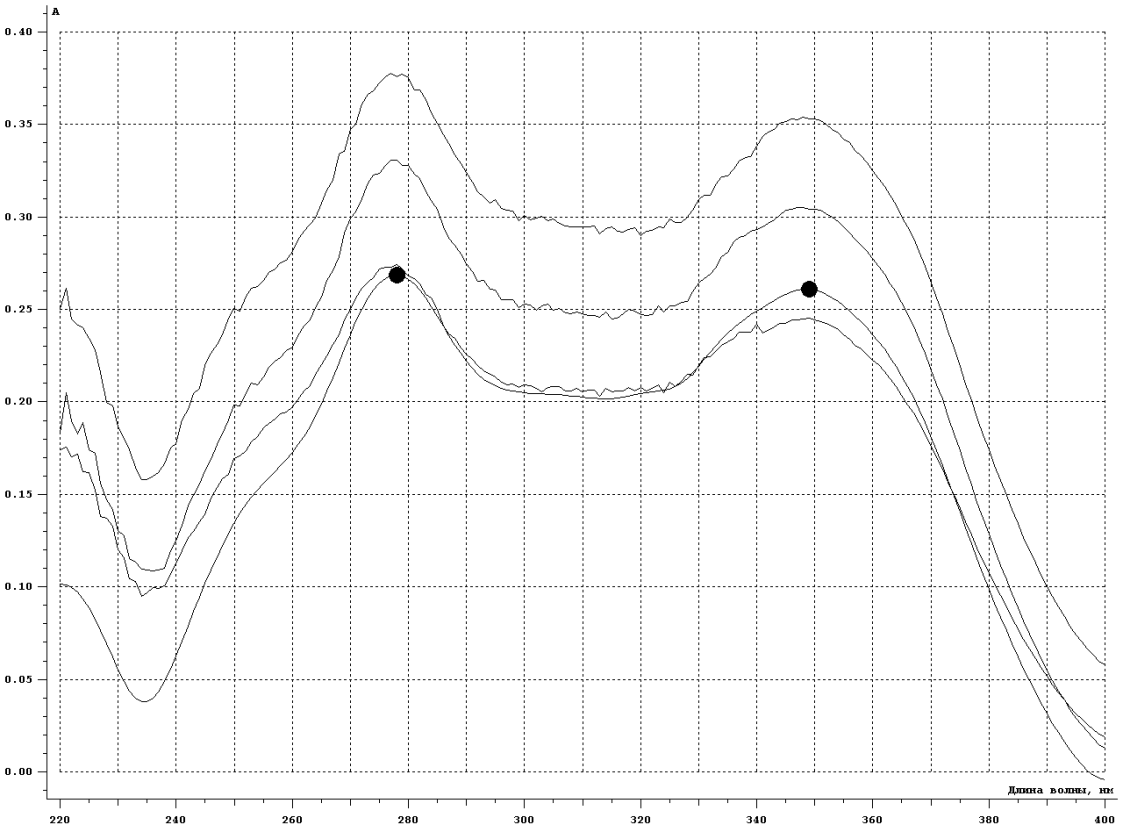 1.ГЭЦ 2.Карбопол 3.Beneceel TYPE: K4M-PH-CR 4.KMC аквилон Рисунок 3 - Спектры поглощения 0,001% раствора доксициклина гидрохлорида в мазе на липофильной основе 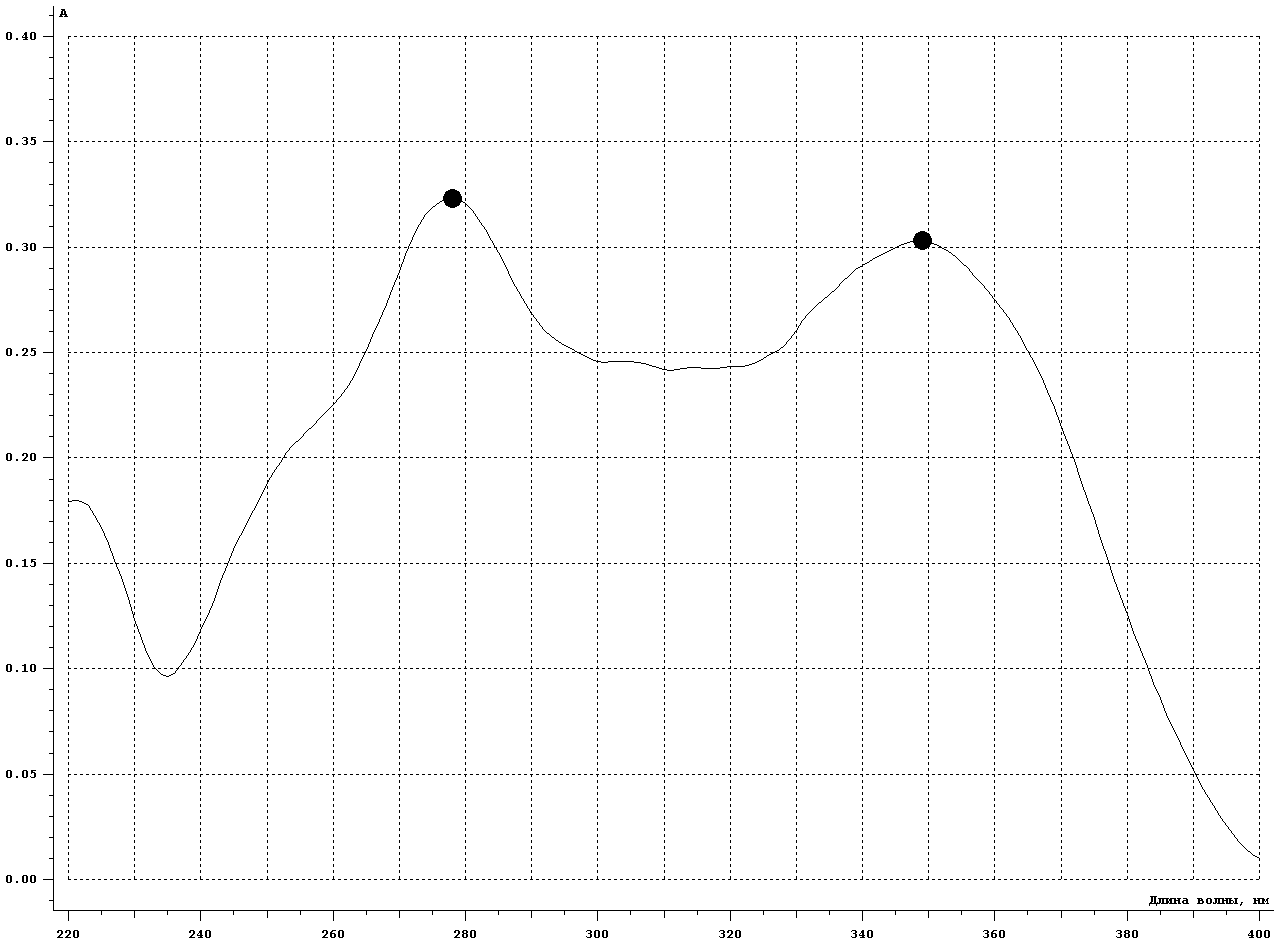 Вывод: Как видно из рисунков спектры поглощения доксициклина гидрохлорида в мазях имеют те же значения максимума светопоглощения что ,что и СО доксициклина гидрохлорида . Поэтому их можно использовать для подтверждения подлинности доксициклина гидрохлорида в мазях. Однако как видно из рисунка 2 интенсивность поглощения различаются у мазей значительно, в зависимости от используемой основы. Так наибольшее светопоглощение наблюдали у доксициклина гидрохлорида в мази, приготовленной на КМС аквилон, а наименьшее на ГЭЦ. Что связанно с различной степенью высвобождения действующего вещества из основы. Поэтому дальнейшее исследование проводили на образцы геля доксициклина гидрохлорида приготовленные на основе КМС аквилон, Beneceel TYPE: K4M-PH-CR и мази на липофильной основе. Методика количественного определения доксициклина гидрохлорида и геле Точную навеску – 1 г геля помещали в мерную колбу вместимостью 100 мл, прибавляли 20 мл воды, перемешивали, доводили тем же растворителем до метки. 10 мл помещали в мерную колбу вместимостью 100 мл, доводили до метки, перемешивали. Измеряли оптическую плотность раствора А при длине волны 348 нм. Количественное содержание доксициклина гидрохлорида рассчитывали по формуле: 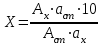 Аx оптическая плотность анализируемого раствора аx навеска геля (г) аx навеска СО доксициклина гидрохлорида (г) Аст оптическая плотность стандартного раствора Результаты количественного определения доксициклина гидрохлорида в геле приведены в таблице 4. Таблица 4 – Результаты количественного определения доксициклина гидрохлорида в геле спектрофотометрическим методом Аст=0,370
Как видно из данных таблицы относительная погрешность количественного определения доксициклина гидрохлорида методом непосредственной спектрофотометрии не превышает 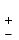 2,46 %. 2,46 %.Методика количественного определения доксициклина гидрохлорида в мазе на липофильной основе Для приготовления раствора доксициклина гидрохлорида в мази на липофильной основе точную навеску – 1 г модельной смеси мази помещали в колбу вместимостью 100 мл, прибавляли 20 мл воды, ставили на кипящую водяную баню и нагревали до расплавления основы. Охлаждали до застывания основы. Жидкость сливали в мерную колбу вместимостью 100 мл. Извлечение повторяли еще 2 раза по 20 мл. Все извлечения объединяли в мерной колбе вместимостью 100 мл, доводили водой до метки, перемешивали. Содержимое колбы фильтровали, отбрасывали первые 15 мл фильтрата . 10 мл полученного раствора помещали в мерную колбу вместимостью 100 мл, доводили до метки, перемешивали. Измеряли оптическую плотность раствора А при длине волны 348 нм. Количественное содержание доксициклина гидрохлорида рассчитывали по формуле: 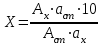 Аx оптическая плотность анализируемого раствора аx навеска геля (г) аx навеска СО доксициклина гидрохлорида (г) Аст оптическая плотность стандартного раствора Результаты количественного определения доксициклина гидрохлорида в мази приведены в таблице 5. Таблица 5 – Результаты количественного определения доксициклина гидрохлорида в мази спектрофотометрическим методом Аст=0,370
Как видно из данных таблицы относительная погрешность количественного определения доксициклина гидрохлорида методом непосредственной спектрофотометрии не превышает 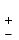 2,59 %. 2,59 %. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||

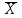 = 1,005
= 1,005