Физическая химия (1-15 вопросы). Дисциплина Физическая химия
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
  Дисциплина: Физическая химия Дисциплина: Физическая химия1. Первой закон термодинамики, основные формулировки и математическое выражение первого закона термодинамики. Применение его к термодинамическим процессам. Работа расширения идеального газа в изохорном, изобарном, изотермическом и адиабатном процессах. 2. Теплоемкость. Виды теплоемкости. Связь между средней и истинной теплоемкостью. Теплоемкость при постоянном давлении и объеме и связь между ними. Температурная зависимость теплоемкости от температуры. 3. Закон Гесса и следствия из него. Применение первого закона термодинамики к химическим процессам. Связь между qp и qv. Расчет тепловых эффектов химических реакций по теплотам образования и теплотам сгорания веществ (на примере реакции). 4. Зависимость теплового эффекта от температуры. Уравнение Кирхгоффа в дифференциальной и интегральной форме. 5. Обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Второй закон термодинамики, его формулировки и математическое выражение. Цикл Карно. 6. Энтропия как мера неупорядоченности системы. Свободная и связанная энергия. Расчет изменения энтропии при различных термодинамических процессах и при протекании химических реакций. 7. Основные соотношения между термодинамическими функциями. Уравнение Гиббса-Гельмгольца. 8. Применение второго закона термодинамики к фазовым превращениям. Вывод дифференциальной формы уравнения Клаузиуса - Клапейрона для процесса кипения. Интегрирование уравнения Клаузиуса - Клапейрона и его анализ. 9. Химическое равновесие. Классификация равновесных состояний. Признаки равновесных состояний. Закон действующих масс. Вывод константы равновесия для гомогенной реакции. Связь между различными формами выражения констант равновесия. 10. Химическое равновесие в гетерогенных системах. Расчет константы равновесия. Химическое сродство как мера реакционноспособности системы. Изотерма Вант-Гоффа. Нормальное химическое сродство. 11. Зависимость константы равновесия от температуры. Уравнение изобары Вант-Гоффа в дифференциальной и интегральной формах. Зависимость константы равновесия от температуры. Уравнение изохоры Вант-Гоффа в дифференциальной и интегральной формах. 12. Расчет равновесных состояний с помощью таблиц стандартных термодинамических величин и по методу Тёмкина-Шварцмана 13. Термодинамика и законы разбавленных растворов. Понижение давления пара растворителя над раствором. Закон Рауля. 14. Растворимость газов в жидкостях. Закон Генри. Зависимость растворимости газов от различных факторов. 15. Замерзание и кипение растворов. Криоскопия и эбуллиоскопия. 16. Закон распределения. Экстракция. 17. Химический потенциал и общие условия равновесия системы. 18. Термодинамика и законы реальных растворов. Положительные и отрицательные отклонения от закона Рауля. Перегонка. Законы Коновалова. 19. Диаграмма состояния однокомпонентных систем Диаграммы состояния воды . 20. Термический анализ. Построение диаграмм состояния по кривым охлаждения. Анализ диаграмм состояния по конноде и по правилу фаз Гиббса. Анализ диаграмм состояния двухкомпонентных систем с неограниченной растворимостью в твердом и жидком состоянии. 21. Анализ трехкомпонентных систем. Объемные и плоские диаграммы состояния трехкомпонентных систем. Треугольники концентраций. Определение концентраций по методам Гиббса и Розебома. 22. Теория электролитической диссоциация. Степень диссоциации. Изотонический коэффициент. Закон Оствальда. 23. Электролиты. Электролитическая проводимость растворов электролитов: удельная и эквивалентная. Зависимость этих электропроводностей от концентрации. 24. Гальванические элементы. Механизм возникновения электродного потенциала. Строение двойного электрического слоя. Вывод уравнения Нернста. Элемент Якоби-Даниэля. 25. Измерение электродвижущие силы гальванического элемента. Классификация электродов. Типы электродов. Электроды первого, второго и третьего рода. Электроды сравнения. 26. Кинетика химических реакций. Задачи кинетики. Понятие о скорости. Виды скорости. Молекулярность и порядок реакций. 27. Кинетика простых реакций. Вывод кинетического уравнения для реакции первого, второго и третьего порядка. Период полураспада. 28. Порядок реакции. Методы определения порядка реакции. 29. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Энергия активации и методы её определения. 30. Теория активных столкновений Аррениуса. 1. Первой закон термодинамики, основные формулировки и математическое выражение первого закона термодинамики. Применение его к термодинамическим процессам. Работа расширения идеального газа в изохорном, изобарном, изотермическом и адиабатном процессах. Содержание и формулировки первого закона термодинамики Первый закон («первое начало») термодинамики есть частный случай закона сохранения и превращения энергии применительно к процессам, которые сопровождаются выделением, поглощением или преобразованием теплоты. Первый закон был обоснован работами Гесса (1836), Джоуля (1840), Майера (1842), Гельмгольца (1847) и др. Наиболее обычными формулировками первого закона термодинамики являются следующие:
Математическое выражение первого закона термодинамики Взаимосвязь между внутренней энергией, работой и теплотой устанавливается на основе первого закона термодинамики. Изменение внутренней энергии системы ΔUможет происходить за счет обмена теплотой Q и работой А с окружающей средой. В термодинамике условились считать положительными величинами теплоту, полученную системой, и работу, совершенную системой. Тогда из формулировки первого закона термодинамики следует, что теплота, полученная системой извне, расходуется на приращение внутренней энергии и работу, совершенную системой, т. е. Q = ΔU+W. Если эти количества бесконечно малы, то закон записывается в дифференциальной форме: 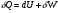 , ,где dU- полный дифференциал внутренней энергии системы; δQи δW- бесконечно малые количества теплоты и работы. Применение закона к термодинамическим процессам Изотермический процесс (Т=соnst) в идеальном газе силы межмолекулярного взаимодействия равны нулю. Внутренняя энергия идеального газа зависит от температуры, количества вещества и не зависит от давления и объема, поэтому для данных условий U=соnst; dU=0, dQТ=р·dV ; QТ=W теплота, сообщенная системе, в изотермическом процессе полностью расходуется на совершение работы расширения. используя р=RТ/V и проинтегрировав получим W= RТln(V2/V1) = RТln(Р1/Р2), т.к. по закону Бойля-Мариотта (РV)Т = соnst Изохорный процесс (V= соnst) при постоянном объеме dV=0, значит работа расширения газа dW= рdV=0 и dQ V = dU или Q = U2- U1 =dd U В изохорном процессе теплота, сообщенная системе, полностью расходуется на увеличение ее внутренней энергии и характеризует изменение состояния системы. Изобарный процесс (р= соnst) постоянную величину р можно внести под знак дифференциала, поэтому работа расширения dW = рdV =dW = d(рV) и dQр=dU+d(рV) = d(U +рV)= ΔН Работа расширения идеальных газов Идеальный газ – это газ для идеализированной системы, состоящей из частиц, собственный объем которых мал по сравнению со всем объемом системы, и которые находятся в непрерывном хаотическом движении. Работу принято считать положительной (А > 0), если система производит её над окружающей средой. Различают работу: механическую, поверхностных сил, электрическую и т. п. Механическую работу под действием сил давления называют работой расширения. Выясним, какое количество работы совершит газ при расширении. Рассмотрим обратимое расширение газа в цилиндре постоянного сечения S. Обозначим: р- внешнее давление; dh- бесконечно малое смещение поршня. dh S р |
