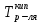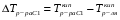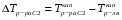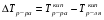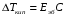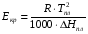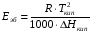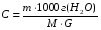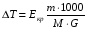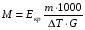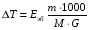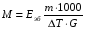Физическая химия (1-15 вопросы). Дисциплина Физическая химия
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
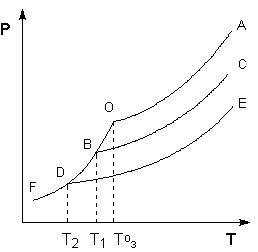
АДавлениеСоставВ Растворы двух летучих веществ, подчиняющиеся закону Рауля во всей области концентраций от 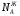 = 0 до = 0 до 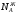 = 1, называются идеальными растворами. Этот тип растворов встречается редко. Идеальные растворы могут образовывать вещества, молекулы которых сходны по полярности, строению, химическому составу и, следовательно, взаимодействуют между собой с такой же силой FА-В, с какой взаимодействуют молекулы в чистых компонентах (FА-В = FА-А= FВ-В). Именно этим можно объяснить зависимость давления насыщенного пара над идеальным раствором только от концентрации, а также тот факт, что идеальные растворы образуются из жидких компонентов без выделения и поглощения теплоты ( = 1, называются идеальными растворами. Этот тип растворов встречается редко. Идеальные растворы могут образовывать вещества, молекулы которых сходны по полярности, строению, химическому составу и, следовательно, взаимодействуют между собой с такой же силой FА-В, с какой взаимодействуют молекулы в чистых компонентах (FА-В = FА-А= FВ-В). Именно этим можно объяснить зависимость давления насыщенного пара над идеальным раствором только от концентрации, а также тот факт, что идеальные растворы образуются из жидких компонентов без выделения и поглощения теплоты (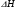 =0) и без изменения объема (υ=0), т. е. объем полученного раствора равен сумме объемов компонентов. =0) и без изменения объема (υ=0), т. е. объем полученного раствора равен сумме объемов компонентов.Растворы, образованные без изменения объема и энтальпии компонентов, близких по свойствам, часто называют совершенными. Изотермическая диаграмма х, р для идеальных растворов изображена на рис. В соответствии с уравнениями 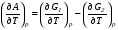 и и 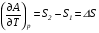 она состоит из трех прямых. она состоит из трех прямых.Т=const Рис.1. Зависимость парциальных и общего давлений пара от состава для идеального раствора Для реальных растворов данные зависимости являются криволинейными. Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения). Реальные растворы с положительными отклонениями давления пара образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0), растворы с отрицательными отклонениями образуются с выделением теплоты (ΔНраств < 0). Рис. 2. Зависимость парциальных и общего давлений пара идеальных (штриховая линия) и реальных (сплошная линия) бинарных растворов от состава при положительных (слева) и отрицательных (справа) отклонениях от закона Рауля. 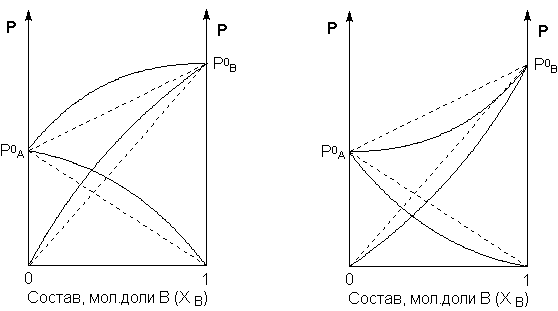 Второй закон Рауля является следствием из первого. Второй закон Рауля можно в наиболее общем виде сформулировать следующим образом: Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего вещества прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества. Данный закон справедлив только для бесконечно разбавленных растворов. Коэффициенты пропорциональности в уравнениях 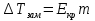 и и 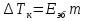 – криоскопическая и эбулиоскопическая константы – имеют физический смысл соответственно повышения температуры кипения и понижения температуры замерзания растворов с моляльной концентрацией, равной 1 моль/кг. Однако, поскольку такие растворы не являются бесконечно разбавленными, эбулиоскопическая и криоскопическая константы не могут быть непосредственно определены и относятся поэтому к числу т.н. экстраполяционных констант. – криоскопическая и эбулиоскопическая константы – имеют физический смысл соответственно повышения температуры кипения и понижения температуры замерзания растворов с моляльной концентрацией, равной 1 моль/кг. Однако, поскольку такие растворы не являются бесконечно разбавленными, эбулиоскопическая и криоскопическая константы не могут быть непосредственно определены и относятся поэтому к числу т.н. экстраполяционных констант.Зависимость растворимости газов в жидкости определяется законом Генри: Растворимость газа в жидкости прямо пропорциональна парциальному давлению газа при постоянной температуре C=Г·P где P - давление пара растворенного вещества,C - мольная доля его, Г - постоянная Генри. 14. Растворимость газов в жидкостях. Закон Генри. Зависимость растворимости газов от различных факторов. Зависимость растворимости газов в жидкости определяется законом Генри: «Растворимость газа в жидкости прямо пропорциональна парциальному давлению газа при постоянной температуре». Условием рановесного распределения вещества между газом и жидкостью является равенство химических потенциалов между жидкой и газовой фазами: Mж=Мг Химический потенциал описывается уравнением 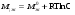 : :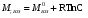 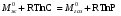 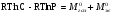 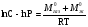 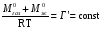 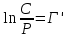 C=Г·P – закон Генри. Г - постоянная Генри, C – мольная доля растворенного вещества. Уравнение применимо для идеальных растворов. Если происходит диссоциация или ассоциация: Cn=Г·P n-коэффициент, учитывающий изменение числа частиц в растворе. Вообще, при растворении газа в жидкости устанавливается равновесие: Газ + Жидкость = Насыщенный раствор газа в жидкости При этом объем системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа; и наоборот. Растворимость газа в жидкости зависит от ряда факторов: природа растворителя и растворимого вещества, давления, газовой фазы и температуры. Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °C и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри (Генри–Дальтона). Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются. Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона–Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе): 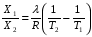 Как правило, при растворении газа в жидкости выделяется теплота (λ < 0), поэтому с повышением температуры растворимость уменьшается. Растворимость газов в жидкости сильно зависит от концентрации других растворенных веществ. Зависимость растворимости газов от концентрации электролитов в жидкости выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C): 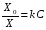 Таким образом, суммируя вышесказанное можно сделать следующие выводы. Поскольку растворение газов в воде представляет собой экзотермический процесс, их растворимость с повышением температуры уменьшается. Если оставить в теплом помещении стакан с холодной водой, то внутренние стенки его покрываются пузырьками газа - это воздух, который был растворен в воде, выделяется из нее вследствие нагревания. Значит, простым кипячением воды можно удалить из воды весь растворенный в ней воздух. Также процесс растворения подчиняется принципу Ле Шателье. Замерзание_и_кипение_растворов._Криоскопия_и_эбуллиоскопия.'>15. Замерзание и кипение растворов. Криоскопия и эбуллиоскопия. Из-за того, что давление пара растворителя над раствором меньше давления пара над чистым растворителем, все растворы замерзают при более низкой температуре, а кипят при более высокой температуре. Рассмотрим замерзание и кипение растворов, растворителем которого является вода:
| ||||||||||||

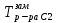 , T2=
, T2=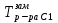 , T0з=
, T0з=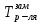
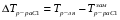
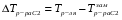
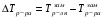
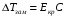
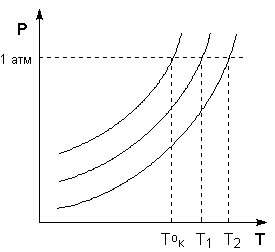
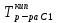 , T2=
, T2=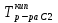 , T0к=
, T0к=