сессия. Зимняя сессия по химии. Доказательства сложного строения атома. Опыты Резерфорда
 Скачать 197.13 Kb. Скачать 197.13 Kb.
|
|
*Основания. Классификация оснований. Химические свойства. Способы получения. Амфотерные основания. Химические свойства на примере гидроксида алюминия и гидроксида цинка. Получение амфотерных оснований. Основания – сложные вещества, которые состоят из атома металла, связанные с одной или несколькими гидроксогруппами. Число гидроксогрупп в молекуле основания, определяется зарядом металла. KOH – гидроксид калия. Классификация оснований: По растворимости. Растворимое в воде основания щёлочи LiOH, NaOH (едкинад, каустическая сода). KOH (едкоекали), RbOH, CsOH, FrOH, Ca(OH)2 (известковая вода, пушанна, гашённая известь), Sr(OH)2, Ba(OH)2, Ra(OH)2. Нерастворимые основания: Fe(OH)2 (зелёный), Cu(OH)2 (голубой), CuOH (жёлтый). Амфотерные основания: Be(OH)2, Zn(OH)2 (белый студенистый осадок), Al(OH)3 (белый объёмный студенистый осадок), Fe(OH)3 (красно-бурый осадок), Cr(OH)3 (пепельно-зелёный), Sn(OH)2, Sn(OH)4, Pb(OH)2, Pb(OH)4, Mn(OH)4. По кислотности Под кислотностью в молекуле оснований понимают число гидроксогрупп, способных замещаться на кислотные остатки. Однокислотные основания: NaOH, CuOH, KOH. Двукислотные основания: Fe(OH)2, Ca(OH)2, Mg(OH)2. Трёхкислотные основания: Fe(OH)3, Cr(OH)3, Al(OH)3. Основание. Химические свойства.
Получение оснований.
Амфотерные основания – это такие, которые реагируют и с кислотами, и с щелочами с образование солей. Все амфотерные основания в воде не растворяются и с водой не реагируют. Химические свойства амфотерных оснований. С кислотами Al(OH)3+3HCl=AlCl3+3H2O Zn(OH)2+2HNO3=Zn(NO3)2+2H2O С кислотными оксидами Не реагируют с CO2, SO2 2Al(OH)3+3SO3=Al2(SO4)3+3H2O Zn(OH)2+SO3=ZnSO4+H2O С щелочами. NaOH+Al(OH)3=NaAl2+2H2O 2NaOH+Zn(OH)2=Na2ZnO2+2H2O 2NaOH+Zn(OH)2=Na2[Zn(OH)4] NaOH+Al(OH)3=Na[Al(OH)4] NaOH+Al(OH)3+2H2O=Na[Al(OH)4(H2O)2] 3NaOH+Al(OH)3=Na3[Al(OH)6] Амфотерные основания реагируют с основными оскидами (только с оксидами щелочных и щелочно-земельных металлов) !Всё при нагревании Na2O+2Al(OH)3=2NaAlO2+3H2O K2O+Zn(OH)2=K2ZnO2+H2O Все амфотерные основания при нагревании разлагаются на оксид и воду 2Al(OH)3=Al2O3+3H2O Zn(OH)2=ZnO+H2O Способы получения амфотерных оснований. Если к раствору AlCl3 прилить по каплям NaOH, то получается белый осадок Al(OH)3 AlCl3+3NaOH=Al(OH)3(осадок)+3NaCl Т. к Al(OH)3 является основанием амфотерным, он в избытке щёлочи будет раствором, образуя комплексную соль. Al(OH)3+NaOH=Na[Al(OH)4] Этот метод не является удобным, потому что нужно всё время соблюдать соотношение соли и щёлочи. AlCl3+4NaOH=Na[Al(OH)4]+3NaCl Al(OH)3 – не растворяется в избытке аммиака, поэтому его получают действием на растворимую соль Al водным раствором аммиака. AlCl3 + 3NH3 * H2O = Al(OH)3(осадок)+3NH4Cl ZnCl2+2KOH=Zn(OH)2(осадок)+2KCl *Соли. Соли средние, кислые, двойные и основные. Химические свойства средних солей. Способы получения средних солей. Разложение нитратов. Средние соли: Если в молекуле кислоты все атомы водорода заместить на атомы металла, то полученная соль – средняя. NaOH+H2SO4=Na2SO4+2H2O Кислыесоли: Если в молекуле кислоты часть атомов водорода заместить на атомы металла, то полученная соль – кислая. NaOH+H2SO4=NaHSO4+H2O Двойные соли: Если в молекуле кислоты атомы водорода заместить на атомы двух разных металлов, то полученная соль – двойная. 2KOH+NaOH+H3PO4=K2NaPO4+3H2O KAl(SO4)2 * 12H2O - алюмокалиевые квасцы KCr(SO4)2 * 12H2O – хромокалиевые квасцы Основные соли: Если в молекуле основания только часть гидроксогрупп заместить на кислотный остаток, то полученная соль – кислая. Cu(OH)2+HNO3=CuOHNO3+H2O Смешанные соли: Смешанные соли это такие, которые содержат два кислотного остатка и неметалл. CaOCl2 – хлорид гипохлорит кальция <-> хлорная или берильная известь. HClO – хлорноватистая кислота. Комплексные соли: Комплексные соли – такие, которые содержат в своём составе либо комплексный катион, либо комплексный анион. K3[Fe(CN)6] – красная кровяная соль K4[Fe(CN)6] – жёлтая кровяная соль [Cu(NH3)4]SO4 – аммиакат сульфат меди. Химические свойства средних солей. Растворимая соль + щёлочь -> осадок или газ CuSO4+2NaOH=Cu(OH)2(осадок)+Na2SO4 NH4Cl+NaOH=NaCl+NH3+H2O – аммиак распознаём по посинению красной влажной лакмусовой бумажке, по запаху. Соль + растворимая кислота -> осадок или газ Na2CO3+2HCl=2NaCl+CO2(газ)+H2O K2SiO3+2HNO3=2KNO3+H2SiO3(осадок) Р.соль + р.соль -> осадок BaCl2+Na2SO4=BaSO4(осадок)+2NaCl Баритова каша применяется для рентгерно-структурного анализа желудочно – кишечного тракта. AgNO3+NaCl=AgCl(осадок)+NaNO3 AgNO3 – используется для прижигания в медецине. Р.соль + металл Металл стоящий в ряду напряжений (активности) левее вытесняет из растворов солей правее стоящий металл. Fe+CuSO4=FeSO4+Cu Mg+2AgNO3=Mg(NO3)2+2Ag. В этой реакции щелочные и щелочно-земельные металлы брать нельзя. Некоторые соли при нагревании разлагаются. А) Все нерастворимые карбонаты при нагревании разлагаются на оксиды. СaCO3=CaO+CO2(газ) BaCO3=BaO+CO2(газ) Б) [CuOH]2CO3=2CuO+CO2(газ)+H2O   До Mg: MeNO2+O2(газ) В) Ме(NO3)n   От Cu до Au: Me+NO2(газ)+O2(газ) От Mg до Cu: Me2On+NO2(газ)+O2(газ) 2NaNO3=2NaNO2+O2(газ) 2Cu(NO3)2=2CuO+4NO2(газ)+O2(газ) 2AgNO3=2Ag+2NO2(газ)+O2(газ) Получение солей. Металл + неметалл 2Fe+3Cl2=2FeCl3 Al+S=Al2S3 Металл + р-р кислоты Zn+2HCl=ZnCl2+H2(газ) 2Al+3H2SO4=Al2(SO4)3+3H2(газ) Металл + р-р солей Fe+CuSO4=FeSO4+Cu Zn+Hg(NO3)=Zn(NO3)2+Hg Основный оксид + кислотный оксид CaO+CO2=CaCO3 3Na2O+P2O5=2Na3PO4 Основный оксид + кислота CuO+H2SO4=CuSO4+H2O Na2O+2HNO3=2NaNO3+H2O Менее летучий кислотный оксид вытесняет из солей более летучий (кристаллические карбонаты + SiO2) CaCO3+SiO2=CaSiO3+CO2(газ) Na2CO3+SiO2=Na2SiO3+CO2(газ) Щёлочь + кислотный оксид Ca(OH)2+CO2=CaCO3(осадок)+H2O – получение известковой воды 2NaOH+SO2=Na2SO3+H2O Основание + кислота NaOH+H2SO4=Na2SO4+H2O Cu(OH)2+2HCl=CuCl2+2H2O Щёлочь + р-р соль -> осадок или газ NH4Cl+NaOH=NaCl+NH3(газ) + H2O – аммиак распознаём по запаху и по посинению красной влажной лакмусовой бумажке. CuSO4+2KOH=Cu(OH)2+K2SO4 Р.соль+р.соль -> осадок BaCl+Na2SO4=BaSO4(осадок)+2NaCl AgNO3+NaCl=AgCl(осадок)+NaNO3 Соль + р.кислота -> осадок или газ Na2CO3+2HCl=2NaCl+CO2(газ)+H2O K2SiO3+2HNO3=KNO3+H2SiO3(осадок) *Генетическая Взаимосвязь между основными классами неорганических соединений.     Средняя соль Металл МеО(основный оксид) Ме(ОН)2 (основания)    Неметалл кислотный оксид кислота Связь между веществами, которые относятся к разным классам, называют генетической. Можно выделить три ряда генетически связанных веществ для металлов и один ряд – для неметаллов. Генетическую связь между простыми (металлы и неметаллы) и сложными (оксиды, гидроксиды и соли) веществами можно представить следующими схемам: Генетический ряд металлов, гидроксиды которых являются основаниями(щелочами):    Металл основный оксид основание (щёлочь) соль Например, генетический ряд кальция: 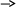 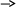 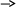 Ca CaO Ca(OH)2 CaCl2   Соль Соль Генетический ряд металлов, которые образуют амфотерные гидроксиды: 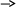    Металл амфотерный оксид соль амфотерный гидроксид    ZnCl2 Na2ZnO2 Например, генетический ряд цинка: 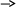 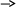 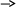 Zn ZnO ZnSO4 Zn(OH)2 Оксид цинка с водой не взаимодействует, поэтому из него сначала получают соль, а затем гидроксид цинка. Так же поступают, если металлу соответствует нерастворимое основание. Генетический ряд неметаллов (неметаллы образуют только кислотные оксиды): 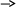 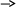 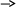 Неметалл кислотный оксид кислота соль Например, генетический ряд фосфора: 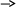 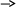 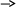 P P2O5 H3PO4 K3PO4 Переход от одного вещества к другому осуществляется с помощью химических реакций. *Понятие о ОВР. Типичные окислители и восстановители. Расстановка коэффициентов методом электронного баланса. Окислительно - восстановительные реакции – это такие реакции, которые протекают с изменением СО. По изменению СО все реакции делятся:
Процесс принятия электронов, называется – восстановление. Процесс отдачи электронов, называется – окисление. Если атом или ион электроны отдаёт, то он окисляется и является – восстановителем Восстановитель всегда повышает СО Если атом или ион электроны принимает, то он восстанавливается и является – окислителем. Окислитель всегда понижает СО Число отданных электронов равно числу принятых электронов. Это называется электронный баланс. Типичные окислители и типичные восстановители. Окислители всегда СО понижают. К основным окислителям относятся О2, О3(озон), галогены ( 7А группа), H2SO4 (концетр), HNO3(любой концетр), KMnO4, K2CrO4 (хромат калия), K2Cr2O7 (дихромат калия) и тд. Восстановители всегда СО повышают. Ме, H2, CO , H2S, KI. Если элемент в соединении находится в минимальной СО, то он СО может только повышать и является восстановителем. Если элемент находится в максимальной СО, то он СО понижает и является окислителем. Типы ОВР Межмолекулярные ОВР – такие, в которых окислители и восстановители находятся в разных молекулах. А) окислители и восстановители разные элементы. 3Cu+8HNO3=3Cu(NO3)2+2NO(газ)+4H2O |
