сессия. Зимняя сессия по химии. Доказательства сложного строения атома. Опыты Резерфорда
 Скачать 197.13 Kb. Скачать 197.13 Kb.
|
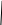 3 Cu -> Cu – о-ние, в-ль. 2 N -> N – в-ние, о-ль. Б) окислители и восстановители являются одним и тем же элементом, но они в разных молекулах. Такие реакции – реакции конмутации (кондиспропорционирование). В результате этих реакций всегда происходит выравнивание СО. SO+2H2S=3S+2H2O 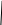 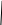 2 4 S -> S – о-ние, в-ль. 1 2 S -> S – в-ние, о-ль. HClO3+5HCl=3Cl2+3H2O 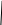  1 2 2Cl -> Cl2 – в-ние, о-ль. 5 10 2Cl -> Cl2 – о-ние, в-ль. Внутри молекулярный ОВР – такие, в которых окислитель и восстановитель входят в состав одной молекулы. А) Окислители и восстановители являются атомами разных элементов, но входят в состав одной молекулы. 2KClO3=2KCl+3O2   2 4 Cl -> Cl – в-ние, о-ль. 3 6 2O -> O2 – о-ние, в-ль. 2NaNO3=2NaNO2+O2(газ)   2 4 N -> N – в-ние, о-ль. 2 2O -> O2 – о-ние, в-ль. Б) реакции диспропорционирование (дисмутации) – это такие реакции, в которых атомы одного и того же элемента, имеющие одинаковую СО, одновременно повышают и понижают СО, образуя продукты самоокисления и солеобразования. 3Cl2+6KOH=5KCl+KClO3+3H2O   10 Cl2 -> 2Cl – в-ние, о-ль. 1 2 Cl2 -> 2Cl – о-ние, в-ль. Cl2+2KOH=KCl+KClO+H2O  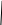 1 2 Cl2 -> 2Cl – о-ние, в-ль. 1 2 Cl2 -> 2Cl – в-ние, о-ль. В) реакции конмутации (конпропорционирования ) – атомы одного элемента в двух разных СО, выравнивают свою СО. NH4NO2=N2+2H2O 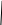 1 2N -> N2 – о-ние, в-ль. 1 2N -> N2 – в-ние, о-ль. NH4NO3=N2O+2H2O 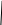 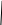 1 4 N -> N – о-ние, в-ль. 1 4 N -> N – в-ние, о-ль. Растворы. Классификация растворов по размеру частиц. Растворы насыщенные ненасыщенные, пересыщенные. Растворы разбавленные и концентрированные. Понятие о растворимости. Зависимость растворимости твердых веществ и газов от разных факторов. Понятие о кристаллогидратах. Формулы кристаллогидратов. Количественные способы выражения концентрации растворенного вещества. Растворы – однородные гомогенные системы, состоящие из молекул растворителей и растворённого вещества между которыми происходят физические и химические взаимодействия. Классификация растворов: По агрегатному состоянию Твёрдые (сплавы металлов и не только) Жидкие (соль в воде, сахар в воде, спирт в воде) Газообразные (воздух) Если в сталь ввести добавку 12% хрома, то получается нержавеющая сталь: в столовых приборах. Воздух это смесь 78% по объёму азота, 21% по объёму кислорода, 0,03 % углекислого газа, 1% благородных газов. По насыщенности(по содержанию растворённого вещества) Насыщенные Ненасыщенные Перенасыщенные Насыщенным раствором называется такой, в котором данное вещество при данной температуре больше не растворяется. Ненасыщенный раствор это такой раствор, в котором данное вещество при данной температуре ещё может растворяться. Перенасыщенный раствор это такой раствор, который содержит больше вещества, чем в насыщенном. По концентрации Разбавленные Концентрированные Понятие разбавленный и концентрированный раствор очень сильно различны, они связаны с индивидуальной растворимостью вещества. Для веществ, которые являются слаборастворимыми, даже 2-х % раствор может быть концентрированным. Если растворимость веществ хорошая, то тогда концентрация более 50 % будет считаться концентрированным веществом. Разбавленные растворы – это растворы с небольшим содержанием растворённого вещества. Концентрированные растворы – это растворы с большим содержанием растворённого вещества. Например, сказать точно, какой раствор H2SO4 концентрированный, а какой разбавленный нельзя. По степени дисперсности ( по размерам частиц): Истинные (<1Нм) Коллоидные (1-100Нм) Взвеси (>100 Нм) 1.Раствор соли в воде, раствор сахара. 2.Раствор яичного белка, кровь, раствор желатина, студень, птичье молоко, мармелад. 3.Частицы вещества можно увидеть невооруженным глазом. Растворимость. Растворимостью или коэффициентом растворимости называют способность вещества образовывать насыщенный раствор в 100 г растворителя при данной температуре. Растворимость веществ зависит: От природы вещества (Например: сахар и поваренная соль хорошо растворимы в воде, а серебро и золото практически в воде нерастворимы.) Вещество хорошо растворимо, если при комнатной температуре в 100 г воды растворяется более 1 г этого вещества. (KCl, AgNO3) Вещество малорастворимо, если при комнатной температуре в 100 г воды растворяется менее 1г этого вещества. (CaSO4, PbCl2). От температуры При повышении температуры растворимость газов уменьшается. При понижении температуры растворимость газов растёт. Влияние давления на растворимость веществ. В отличии от твёрдых веществ и жидкостей на растворимость газов очень сильно влияет давление под которым находится газ. При данной температуре и давлении газ растворяется в жидкости до тех пор, пока скорость отрыва молекул газа от поверхности не станет равной скорости, с которой молекулы газа проникают в жидкость. Тогда устанавливается состояние равновесия, жидкость становится насыщенным газом. Если же давление газа увеличилось, например в 2 раза, во столько же раз увеличится и концентрация его молекул над жидкостью, а следовательно и скорость растворения газа. Равновесие нарушится. Чтобы при новом давлении установилось равновесие, концентрация растворённых молекул газа должна, тоже увеличится в 2 раза. В общем виде зависимость растворимости газов от давления выражается законом Генри: С(х)=Кр*Р(х) – Кр постоянная Генри для каждого газа. С – моль/л. Р(х) – давление газа (в Паскаль). Количественным выражением способности вещества растворяться в растворители при данных условиях является концентрация его насыщенного раствора – растворимость. Растворимость вещества в различных растворителях, например в воде, колеблется в широких пределах. Если в 100 г воды при комнатной температуре растворяется более 10 г вещества, то вещество называется легкорастворимым. Если менее 1 г вещества, то малорастворимым. Если менее 0,1 г вещество, то нерастворимым. Хорошо растворимые вещества: щёлочи (NaOH,KOH); большинство солей; сахароза; уксусная кислота и тд. Малорастворимые вещества: твёрдые вещества(гипс – CaSO4*2H2O – 0,195 г в 100 г воды; Ca(OH)2 – 0,165 г в 100 г воды, жидкости – диэтиловый эфир), газы (О, N, H)/ Практически нерастворимые вещества: (BaSO4 – 0,00023 г на 100 г воды, AgCl – 0,00015 г на 100 г воды, CaCO3 – 0,00013 г на 100 воды) Абсолютно нерастворимых веществ не существует. Влияние природы растворителя и растворённого вещества. Очень давно опытным путём установлено, что подобное растворяется в подобном. Так вещества с ионным типом связи (соли, щёлочи) или полярным типом связи (спирты, кислоты) хорошо растворимы в полярных растворителях (в воде), и наоборот растворимость кислорода в бензоле намного выше чем в воде, потому что молекулы О и С6Н6 не полярные. Взаимное влияние растворяющихся веществ Если в воде уже растворено какое-то вещество, то в этом растворе газы растворяются обычно хуже, чем в чистой воде. Например: в водном растворе NaCl Cl2 растворяется значительно хуже, чем в чистой воде. Происходит понижение концентрации свободных молекул воды за счёт взаимодействия их с ионами натрия и хлора. Кристаллогидраты – вещества, в состав молекул которых входит кристаллизационная вода. CuSO4*5H20 – медный купорос FeSO4*7H2O – железный купорос ZnSO4*7H2O – цинковый купорос MnSO4*7H2O – горькая морская соль или английская соль Na2SO4*10H2O – глауберова соль мирабилит Na2CO3*10H2O – кристаллическая соль NaHCO3 – пищевая, медицинская, питьевая, двууглекислая сода NaOH – каустическая сода CaSO4*2H2O - гипс CaSO4*2H2O=CaSO4*0,5H2O+1,5H2O (алебастр) CoCl2*6H2O – фосген, розовый цвет CoCl2*2H2O – синий цвет CoCl2 безводный – синий цвет KAl(SO4)2*12H2O – алюмокалиевые квасцы KCr(SO4)2*12H2O – хромокалиевые квасцы FeSO4*(NH4)2SO4*6H2O – соль мора Взаимодействие серной, азотной кислот разных концентраций с металлами. Взаимодействие азотной разбавленной и концентрированной кислоты и серной концентрированной кислоты с неметаллами. Все реакции разобрать с окислительно-восстановительной точки зрения. H2SO4. А) H2SO4 разб. реагирует со всеми металлами, стоящими в ряду напряжений до Н с образованием соли и Н, кроме Са, Ва, Sr, Pb, т.к на поверхности этих металлов образуются нерастворимые сульфаты и реакции прекращаются. Fe+H2SO4(разб)=FeSO4+H2(газ)   1 2 Fe -> Fe – о-ние, в-ль. 1 2 Fe -> Fe – в-ние, о-ль. Б) H2SO4 концет. реагирует со всеми металлами, кроме Au, Pt, Ir, Pd, Os, Ta, с образованием соли металла, SO2 (удушливый газ). На холоду H2SO4 концет. пассивирует Al, Cr, Fe (образуется тонкая оксидная плёнка, реакция прекращается), но при нагревании реакция с этими металлами идёт. Cu+2H2SO4(конц)=CuSO4+SO2(газ)+2H2O   1 1 Cu -> Cu – о-ние, в-ль. 1 1 S -> S – в-ние, о-ль. 2Fe+6H2SO4(конц)=Fe2(SO4)3+3SO2(газ)+6H2O   2 2 Fe -> Fe – о-ние, в-ль. 3 3 S -> S – в-ние, о-ль. В) H2SO4 концет. реагирует с активными металлами, они считаются включительно по Zn в ряду напряжений с образованием соли металла, воды, ряд продуктов: S, H2S, SO2 4Zn+5H2SO4(конц)=4ZnSO4+H2S(газ)+4H2O   4 8 Zn -> Zn – о-ние, в-ль. 1 2 S -> S – в-ние, о-ль. 3Zn+4H2SO4(конц)=3ZnSO4+S(осадок жёлтый)+4H2O   3 6 Zn -> Zn – о-ние, в-ль. 1 2 S -> S – в-ние, о-ль. HNO3 А) НNO3 разб. реагирует с активными металлами ( по Zn) с образованием соли металла, N2О, Н2О. 4Mg+10HNO3(разб)=4Mg(NO3)2+N2O(газ)+5H2O   4 8 Mg -> Mg – о-ние, в-ль. 1 2 Fe -> 2N – в-ние, о-ль. Б) HNO3 разб. реагирует с металлами средней активности (от Zn до Н) и малоактивными металлами (после Н) с образованием соли металла, NO (бесцветный газ), Н2О. HNO3 не реагирует с Au, Pt, Ir, Pd, Ta, Os. 3Cu+8HNO3(разб)=3Cu(NO3)2+2NO(газ)+4H2O   3 3 Cu -> Cu – о-ние, в-ль. 2 2 N -> N – в-ние, о-ль. В) HNO3 конц. Реагирует со всеми металлами, кроме Au, Pt, Ir, Pd, Ta, Os с образованием соли металла, NO (бурый газ) и вода. На холоду HNO3 конц. пассивирует Al, Cr, Fe, но при нагревании реакция идёт. Cu+4HNO3(конц)=Cu(NO3)2+2NO2(газ)+2H2O   1 1 Cu -> Cu – в-ние, о-ль. 2 2 N -> N – о-ние, в-ль. Г) HNO3 оч.разб. реагирует с активными металлами по Zn, с образованием соли металла, H2O и ряда продуктов N2 (газ), NH3 (газ с сильно раздражающим запахом), NH4NO3 (твёрдое в-во белого цвета). 8Al+30HNO3(оч.разб)=8Al(NO3)3+3NH4NO3+9H2O   8 8 Al -> Al – о-ние, в-ль. 3 3 N -> N – в-ние, о-ль. |
