№ 45 Объясните различие в обмене жиров двух людей: один поужинал и лег отдохнуть, а другой вместо ужина совершает получасовую пробежку. Напишите схемы соответствующих метаболических путей, скорость которых увеличивается у этих людей. Объясните действие гормонов, активирующих эти пути.
У первого человека происходит усиленное выделение инсулина, а у второго – адреналина.
Синтез жиров в печени (у первого):

Депонирование жира (у 1-го)
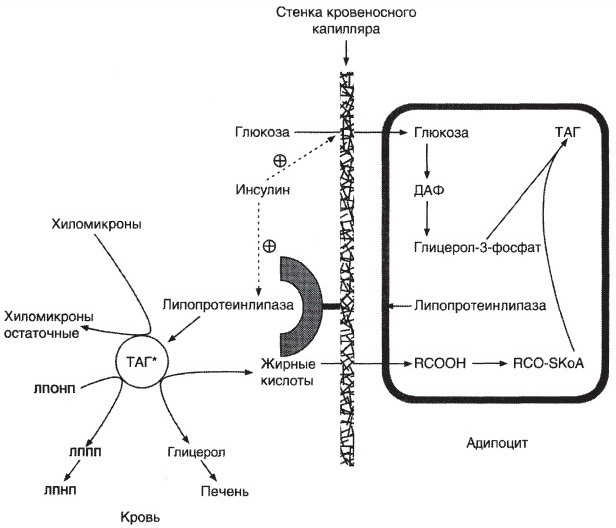
Синтез жирных кислот (у 1-го): Мобилизация жира (ниже) (у 2-го):
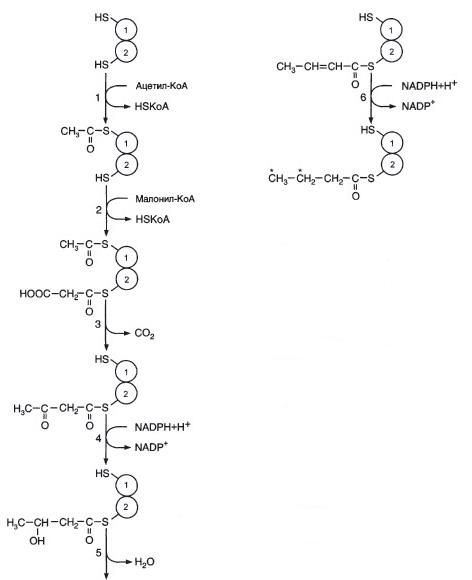 
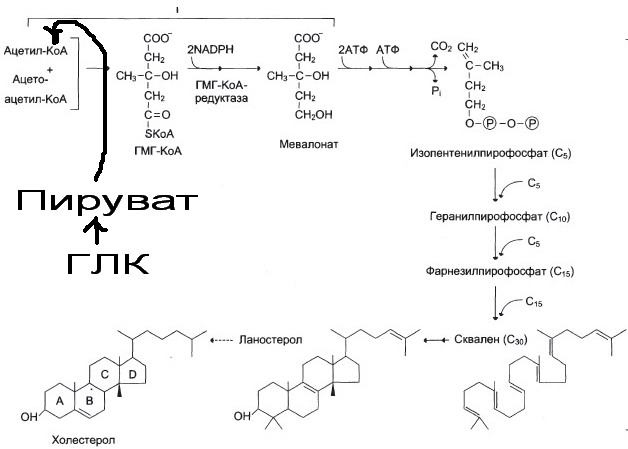
Синтез холестерола (у 1-го):
β-окисление жирных кислот (у 2-го):
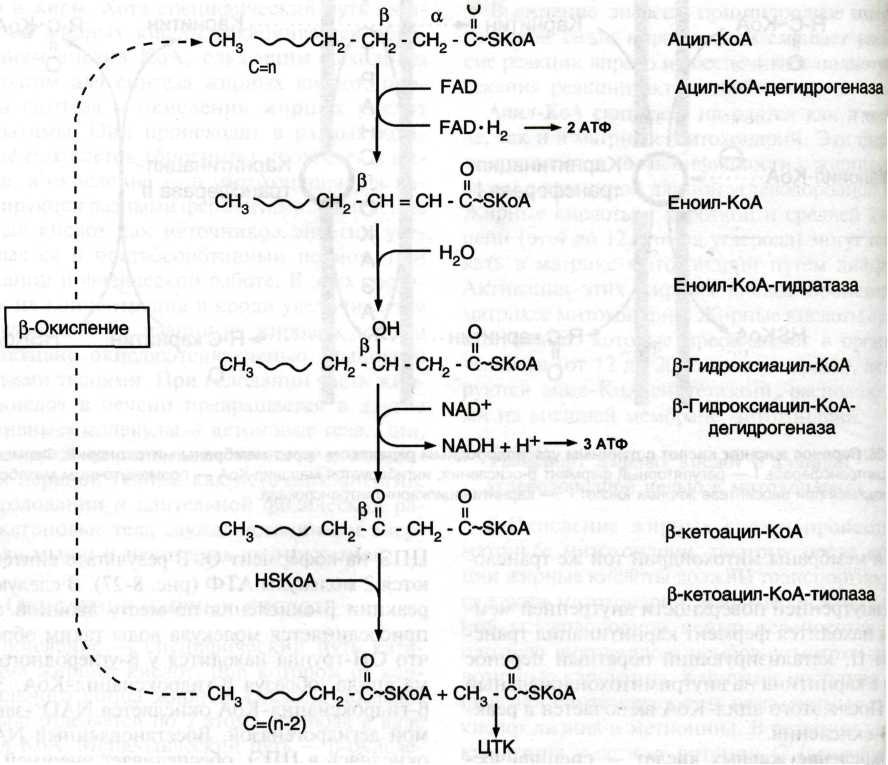
|
№ 46 Пациентам при атеросклерозе и угрозе образования тромба профилактически назначают аспирин. Объясните механизм действия аспирина, ответив на вопросы:
а) Каковы функции разных типов эйкозаноидов в свертывании крови;
б) Какая реакция в синтезе эйкозаноидов ингибируется аспирином, и по какому механизму;
в) Укажите, синтез каких эйкозаноидов увеличивается при лечении аспирином, перечислите их биологические функции;
г) Какие осложнения могут возникнуть при приеме аспирина?
а)
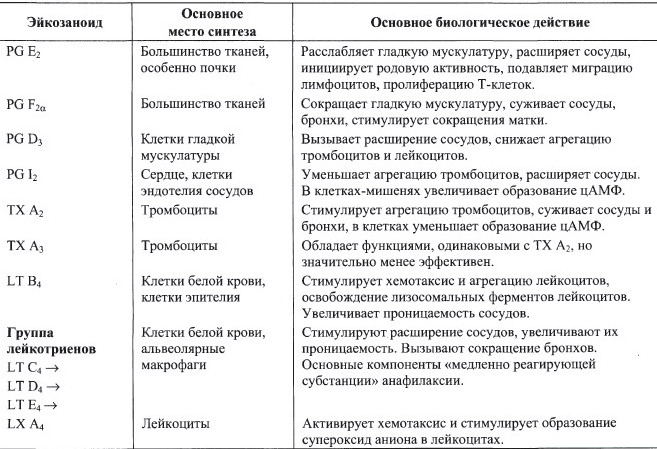
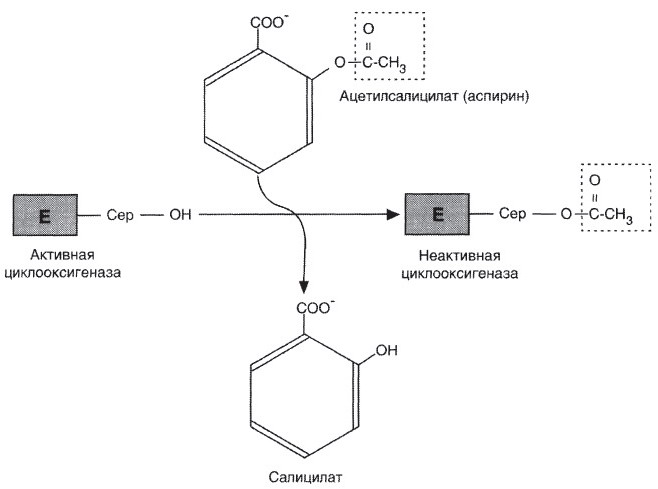
б) Механизм - инактивация циклоксигеназы аспирином.
в) Увеличится синтез лейкотриенов, которые стимулируют расширение сосудов, сокращение бронхов.
г) При приёме аспирина у больных, имеющих изоформу липоксигеназы с высокой активностью, может вызвать приступ бронхиальной астмы. Так называемая «аспириновая» бронхиальная астма.
|
№ 47 Концентрация глутамина в крови людей значительно выше, чем остальных аминокислот. Объясните это отличие, описав роль глутамина в обмене веществ и используя соответствующие реакции и схемы.
Роль Глутамина – транспортная форма аммиака. Глутамин участвует в синтезе мочевины в печени, синтезе пуриновых и пиримидиновых оснований нуклеотидов и нуклеиновых кислот, аминосахаров и аминопроизводных липидов.
Высокий уровень Глутамина в крови и лёгкость его поступления в клетки обуславливают использование глутамина во многих анаболических процессах.
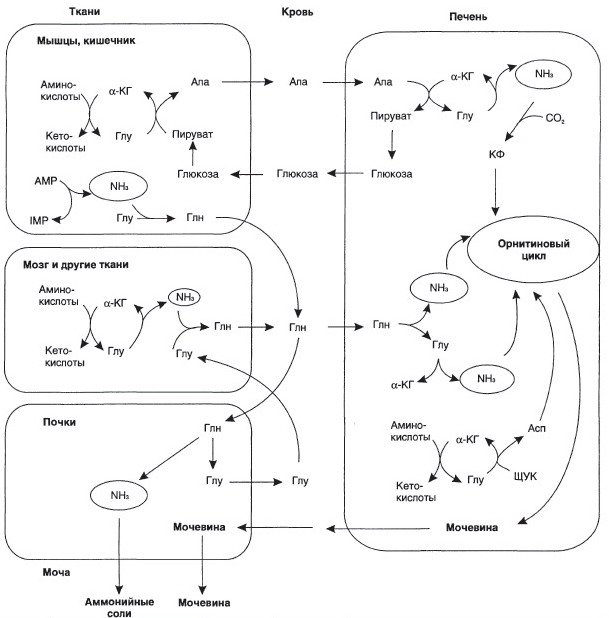
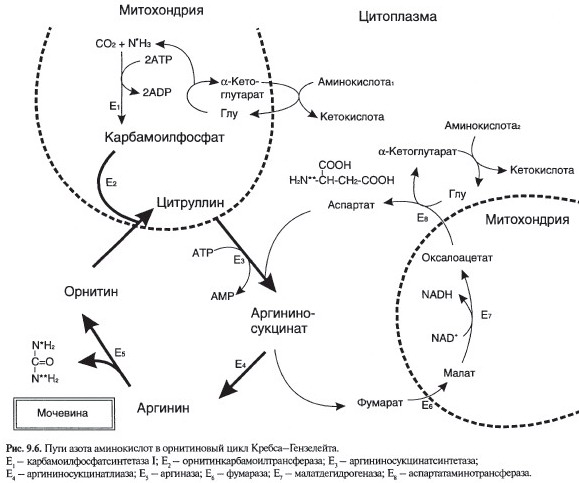
Орнитиновый цикл
Синтез пуриновых нуклеотидов
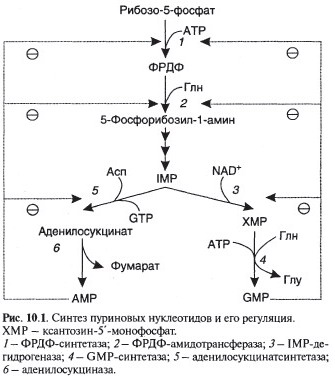
Синтез пиримидиновых нуклеотидов
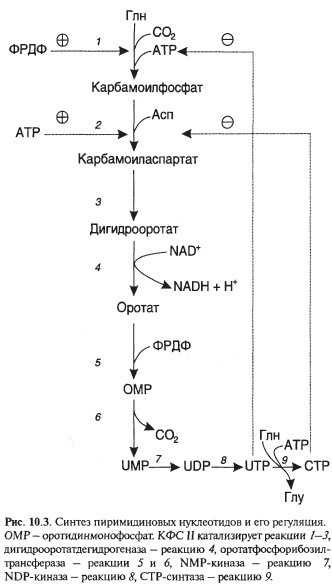
|
|
|
№ 48 Некоторые формы гриппа вызывают у детей усиленный распад белков, характерный для инфекционных болезней, а синтез ключевого фермента, участвующего в инактивации конечного продукта распада аминокислот снижается. Назовите метаболит, который при этом накапливается, объясните биохимические механизмы его токсического действия на нервную систему. Перечислите известные вам способы обезвреживания этого вещества в тканях.
Метаболит – аммиак. Аммиак – токсическое вещество. Даже небольшое увеличение его концентрации оказывает неблагоприятное воздействие на организм, и прежде всего, на ЦНС. Например, увеличение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги.
Симптомы гиперамониемии: тремор, нечленораздельная речь, тошнота, рвота, головокружение, потеря сознания. Причина – дефект ферментов орнитинового цикла.
Механизм токсического действия аммиака намозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
• Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
а-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации а-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции трансаминирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.); гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность а-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
• Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
• Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3РО4.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез γ-аминомаслянной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
• Ион NH4+ практически не проникает в цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульса.
Способы обезвреживания аммиака.
1. Основной реакцией, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы:
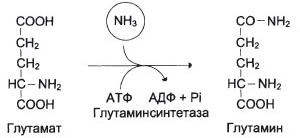
2. В клетках кишечника под действием фермента глутаминазы роисходит гидролитическое освобождение амидного азота в виде аммиака:
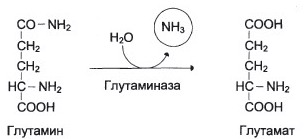
3. Около 5 % образовавшегося аммиака удаляется вместе с фекалиями, небольшая часть через воротную вену попадает в печень, остальные около 90 % выводятся почками.
Орнитиновый цикл

|
№ 49 У больных с циррозом печени часто развивается гипераммониемия. Объясните это, написав схему метаболического пути, нарушение которого у этих больных приводит к данному симптому, укажите возможные последствия гипераммониемии.
Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут выступать как генетический дефект ферментов орнитинового цикла в печени, так и вторичное поражение печени в результате цирроза, гепатита и других заболеваний.
Орнитиновый цикл

Все симптомы гипераммониемии – проявление действия аммиака на ЦНС.
Механизм токсического действия аммиака намозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
• Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата:
а-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации а-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции трансаминирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.); гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность а-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоацетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
• Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
• Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3РО4.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез γ-аминомаслянной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
• Ион NH4+ практически не проникает в цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульса.
Последствия гипераммониемии:
1. Тошнота, повторяющаяся рвота
2. Головокружение, судороги
3. Потеря сознания, отёк мозга
4. Отставание умственного развития (при хронической рождённой форме)
|
№ 50 Полипептиды трасилол (контрикал), гордокс используются как лечебные препараты при панкреатите. Объясните, на чем основано лечебное действие этих пептидов. Назовите механизмы, которые в норме защищают поджелудочную железу от самопереваривания. Укажите ферменты, секретируемые поджелудочной железой и примеры активации некоторых из них.
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсин, проэластаза, прокарбоксипептидазы А и В, то есть в неактивной форме → секретируются к месту действия (полость кишечника), где активируются путём частичного протеолиза (отщепление пептида различной длины с N-конца молекулы профермента). Место синтеза проферментов и место их активации пространственно разделены. Такой механизм образования актив. ферментов необходим для защиты секреторных клеток поджелудочной железы от самопереваривания.
Преждевременная активация проферментов в секреторных клетках происходит при остром панкреатите – трипсиноген превращается в трипсин в клетках поджелудочной железы и активирует остальные панкреатические пептидазы

В клетках поджелудочной железы присутствует белок – ингибитор трипсина, образующий с активной формой фермента прочный комплекс в случае преждевременной активации
Трипсин гидролизуется пептидными связями Арг и Лиз.
Химотрипсин – пептидные связи карбоксильных групп ароматических АК (Фен, Тир, Три)
Карбоксипептидаза А (ароматические) и В (Арг, Лиз) отщепляют C-концевые остатки АК
|
|
№ 51 У пациента перенесшего гепатит, определяли АЛТ и ACT в крови. Почему активность этих ферментов увеличивается? Для ответа на вопрос:
а) Объясните, что такое энзимодиагностика;
б) Напишите схемы реакций, катализируемые АЛТ и ACT, укажите кофермент, укажите роль этих реакций в обмене аминокислот;
в) Назовите требования, которые предъявляют к ферментам, используемым в энзимодиагностике.
а) Энзимодиагностика – определение активности ферментов в сыворотке крови для диагностики некоторых заболеваний.
б) Реакции трансаминирования, кофермент-пиридоксальфосфат.
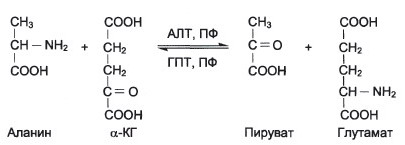
Реакции трансаминирования играют большую роль в обмене аминокислот.
• Путем трансаминирования из соответствующих ос-кетокислот синтезируются заменимые аминокислоты, если их в данный момент в ткани недостаточно. Таким образом происходит перераспределение аминного азота в органах и тканях.
• Трансаминирование — один из начальных этапов катаболизма аминокислот, первая стадия непрямого дезаминирования. Образующиеся а-кетокислоты могут затем окисляться в цикле трикарбоновых кислот и использоваться для глюконеогенеза.
в) В норме в крови активность этих ферментов очень мала и составляет 5—40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени — наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют «коэффициент де Ритиса». В норме этоткоэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8—10 раз, а АЛТ — в 1,5—2,0 раза. Наиболее резко активность ACT увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в 8—10 раз по сравнению с нормой, a ACT — в 2—4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
|
№ 52 Объясните, почему сульфаниламидные препараты оказывают антибактериальное действие, не проявляя при этом цитостатического влияния на клетки человека. Для этого:
а) Объясните механизм действия этих препаратов;
б) Приведите примеры процессов, которые нарушаются в бактериальных клетках при введении сульфаниламидных препаратов.
а) Сульфаниламидные препараты – структурные аналоги П-аминобензойной кислоты. Это антивитамины. Они оказывают антибактериальное действие, так как являются конкурентными ингибиторами ферментов синтеза фолиевой кислоты у бактерий, а также могут использоваться как псевдосубстраты, в результате чего синтезируются соединения, не выполняющие функции фолиевой кислоты. В обоих случаях бактерии перестают размножаться, так как нарушается обмен одноуглеродных фрагментов и, следовательно, нуклеиновых кислот.
 В клетках больного сульфаниламидные лекарственные препараты не вызывают подобных изменений, поскольку человек с пищей получают готовую фолиевую кислоту. В клетках больного сульфаниламидные лекарственные препараты не вызывают подобных изменений, поскольку человек с пищей получают готовую фолиевую кислоту.
б) Бактерии прекращают размножаться за счёт нарушения обмена одноуглеродных фрагментов, а следовательно синтеза нуклеиновых кислот.
|
|
|
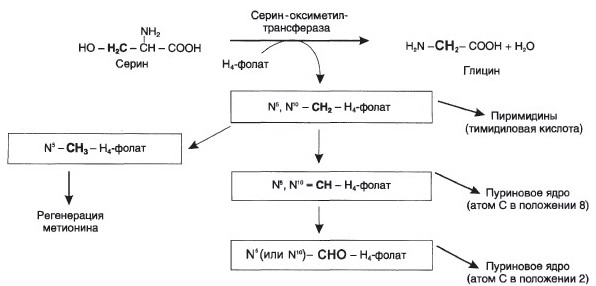
№ 53 Одной из причин гомоцистинурии является гиповитаминоз фолиевой кислоты, а также В12 и В6. Как изменится при этом заболевании обмен серосодержащих аминокислот? Для ответа на вопрос:
а) Напишите схемы объясняющие роль фолиевой кислоты, витаминов В12 и В6 в обмене этих аминокислот;
б) Объясните, к каким последствиям может привести изменение скорости образования в организме серосодержащих аминокислот.
а) Необходимые схемы:

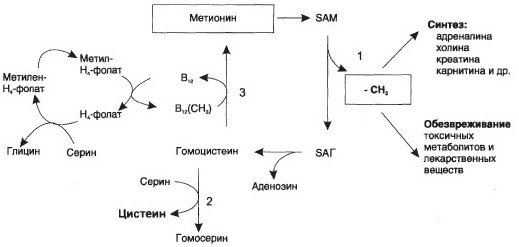
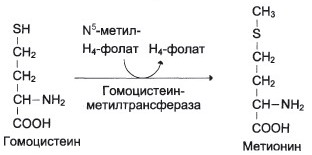
Промежуточным переносчиком
метильной группы в этой реакции
служит проивзодное витамина В12 –
метилкобаламин (здесь – кофермент)
б) 1. Гомоцистеинемия/гомоцистеинурия – способствует развитию атеросклеротической бляшки. 2. Цистатионинурия – при недостаточности витаминов группы B. 3. Мегалобластная анемия – крупные ядерные эритроциты, уменьшение количества витамина В12. , недостаточность фолиевой кислоты, что приводит к нарушению обмена серосодержащих АК в мозге и, как следствие, к умственной отсталости.
|
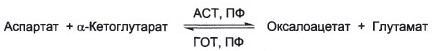
№ 54 После введения мышам аспартата, содержащего радиоактивный атом азота (N |5) в α-аминогруппе, обнаружили, что метка быстро появляется в α-аминогруппах других аминокислот. Объясните значение реакций, которые протекают при этом, написав соответствующие схемы; укажите диагностическое значение ферментов, катализирующих подобные реакции, их кофермент.
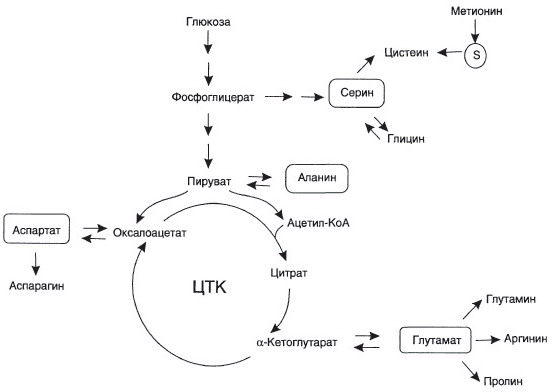

Ферменты, катализирующие подобные реакции – АСТ и АЛТ.
Кофермент – ПФ.
В норме в крови активность этих ферментов очень мала и составляет 5—40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени — наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют «коэффициент де Ритиса». В норме этоткоэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8—10 раз, а АЛТ — в 1,5—2,0 раза. Наиболее резко активность ACT увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в 8—10 раз по сравнению с нормой, a ACT — в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
|
№ 55 У новорожденного ребенка обнаружено повышенное содержание фенилпирувата в моче (в норме он практически отсутствует). Содержание фенилаланина в крови составило 35 мг/дл (при норме 1,5 мг/дл). Для какого наследственного заболевания характерны данные симптомы? Для ответа на вопрос:
а) Напишите схему метаболического пути, активность которого снижена у больного, на схеме укажите место ферментного «блока»;
в) Укажите причину повышения фенилпирувата и других метаболитов в крови больного;
г) Объясните, каким образом появление этих метаболитов в крови больного влияет на развитие болезни.
Для классической фенилкетонурии.
а) в)
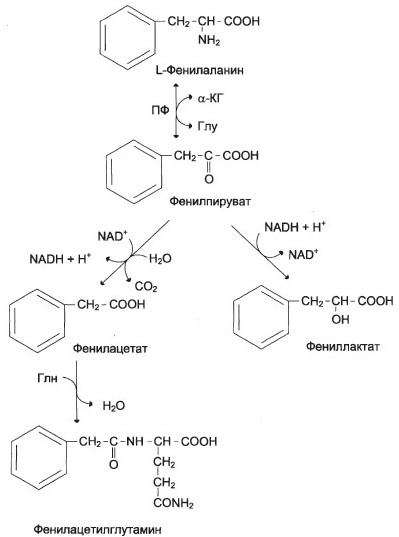 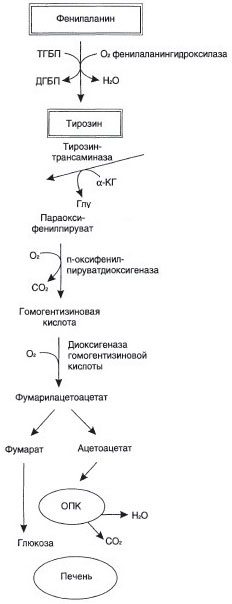
Причина - При дефекте
фенилаланингидроксилазы запускаются
альтернативные пути катаболзма
фенилаланина – накопившийся
фенилаланин подвергается
трансаминированию с
α-кетоглутаратом. Образовавшийся
фенилпируват превращается либо в
фениллактат, либо в фенилацетилглутамин,
который накапливается в крови и
Место ферментного блока – выделяется с мочой. Эти соединения
реакция, катализируемая токсичны для мозга.
фенилаланингидроксилазой
г) Тяжёлые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций. Фен, фенилпирувата, фениллактата. Большие концентрации Фен ограничивают транспорт Тир и Три через гематоэнцефалический барьер и тормозит синтез нейромедиаторов.
| |
 Скачать 7.72 Mb.
Скачать 7.72 Mb.