Биотехнология ферментов. БИОТЕХНОЛОГИЯ В ПРОИЗВОДСТВЕ ВИТАМИНОВ И ФЕРМЕНТОВ. ИММОБИЛИЗАЦИ. Экстракция из растительного и животного сырья
 Скачать 1.06 Mb. Скачать 1.06 Mb.
|
|
Витамины(от лат. vita – жизнь) – органические соединения различной химической природы, необходимые в малых количествах для осуществления биохимических и физиологических процессов в живых организмах. Основные пути производства витаминов: • экстракция из растительного и животного сырья Недостатки: низкое содержание в природных источниках и ограниченность сырьевых ресурсов. • химический синтез Сложный многоступенчатый процесс, сопряженный с большими производственными затратами → дорогие конечные продукты • биосинтез с использованием микроорганизмов Получение витамина В2 (рибофлавин, витамин роста)  • Улучшает обмен углеводов, жиров, аминокислот • Его производные ФАД (флавинадениндинуклеотид) и ФМН (флавинмононуклеотид)являются коферментами (небелковая часть сложных ферментов). • Необходим для образования антител, дыхания клеток и роста • Улучшает состояние органов зрения Гиповитаминоз: поражения слизистой оболочки губ, отек и покраснение языка, светобоязнь, анемия, мышечная слабость, боли в ногах. «Рибофлавин» – дословно «желтый спирт». Используется в качестве пищевого красителя (Е101). Источники: высшие растения (овес, томаты, зародыши кукурузы), дрожжи, грибы. До 30-х гг этот витамин выделяли из природного сырья (в максимальных концентрациях он присутствует в моркови и печени трески). Из 1т моркови можно выделить 1г рибофлавина, 1т печени – 6г. Микроорганизмы синтезируют рибофлавин и его коферментные формы (ФАД и ФМН). Продуцентами витамина являются: • бактерии (Brevibacterium ammoniagenes, Micrococcus glutamaticus), • дрожжи (Candida guilliermondii, C. flaveri), • микроскопические грибы (Ashbya gossypii, Eremothecium ashbyii) • плесневые грибы (Aspergillus niger). Промышленное получение рибофлавина осуществляется • химическим синтезом, • микробиологическим • комбинированным (синтезированная микроорганизмами рибоза химически трансформируется в В2). Активным продуцентом рибофлавина являются культура микроскопического дрожжеподобного гриба Eremothecium ashbyii. Недостаток этих культур: нестабильность при хранении. Решение: в течение 8-10 месяцев пересеивать культуру на твердую среду, отбирая колонии с высокой продуктивностью по интенсивности оранжевой окраски. Яркая окраска колоний коррелирует с высокой способностью синтезировать рибофлавин. Eremothecium ashbyii способен при выращивании на 1т питательной смеси синтезировать 25 кг витамина. На примере выделения рибофлавина в культуральную жидкость было открыто явление сверхсинтеза. Сверхсинтез рибофлавина можно получить, если: 1.действовать на дикие штаммы мутагенами, нарушающими механизм ретроингибирования синтеза витамина В2. Отбор мутантов ведут по устойчивости к аналогу витамина В2 – розеофлавину (обладает антибактериальными свойствами), 2.действовать флавиновыми нуклеотидами 3. изменять состав культуральной среды. Биосинтез рибофлавина Eremothecium ashbyiiстимулируется липидами. При добавлении в питательную среду кукурузного или соевого масла выход рибофлавина увеличивается вдвое. При биосинтезе рибофлавина начальное значение рН=6-7, в процессе роста грибов снижается до 4,5. Поэтому величину рН постоянно поддерживают на уровне 9,5. После окончания процесса ферментации культуральную жидкость вместе с мицелием в вакуум-выпарных аппаратах нагревают до 800С с целью разрушения клеточных структур с одновременным концентрированием, затем высушивают в распылительной сушилке. В 1983г был сконструирован рекомбинантный штамм продуцента сенной палочки (Bacillus subtilis). В этом штамме увеличена доза оперонов (генов), которые контролируют синтез рибофлавина. Клонированием генов рибофлавинового оперона в одной из созданных плазмид был получен производственный штамм-продуцент, способный синтезировать в три раза больше по сравнению с Eremothecium ashbyii за 42 часа ферментации, и этот продуцент более устойчив к экзогенной контаминации (попаданию примесей) Постоянно проводится разработка оптимального состава питательной среды и определение условий культивирования. Например, были отобраны мутанты Ashbya gossupii, продуцирующие повышенное количество рибофлавина и способные к эффективному синтезу витамина на среде с апельсиновой кожурой (богата маслами). Продукция витамина – на 180% выше контроля. Получение витамина В12 (цианокобаламин, противоанемийный) Имеет наиболее сложную, по сравнению с другими витаминами, химическую структуру. В его состав входит кобальт, который придает ему красный цвет. 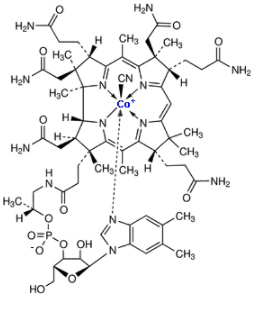 • Входит в состав кофакторов ферментов, которые принимают участие в метилировании и других реакциях • В комплексе с фолиевой кислотой способствует созреванию эритроцитов • Активирует свертывающую систему крови • играет большую роль в нормальном функционировании ЦНС • антиоксидант Применяется для лечения злокачественной анемии, лучевой болезни, заболеваний печени. У женщин, которые принимали витамин В12, длина теломер (концевые участки хромосом, маркеры старения) была на 5,9% больше, чем у женщин, которые его не принимали. Гиповитаминоз: анемия, неврологические расстройства, онемение конечностей, атаксия (расстройство координации движения). Часто он приводит к неспецифической усталости или недомоганию у пожилых людей. У людей, больных старческой деменцией, выявлено более низкое содержание витамина В12 по сравнению со здоровыми пожилыми людьми. Ни животные, ни растения не способны синтезировать витамин В12, т.к. это единственный витамин, продуцируемый микроорганизмами (бактериями, актиномицетами и сине-зелеными водорослями). Источником витамина В12 для человека служит пища животного происхождения (печень, почки, моллюски, раки, крабы яйца, молоко и молочные продукты). Часто этот витамин добавляют в сухие завтраки, шоколадные батончики, энергетические напитки. Концентрация витамина В12 в продуктах питания уменьшается во время термической обработки. Норма: от 1,4 до 3,0 мкг/сут. В организме человека и животных витамин синтезируется микрофлорой кишечника, но это не удовлетворяет потребность организма в нем, остальная часть – с пищей. В последнее время стало модным пить с концентратом сине-зелёных водорослей с целью компенсации нехватки витамина В12. Однако большинство съедобных сине-зеленых водорослей (цианобактерий), используемых для пищевых добавок, в основном содержат псевдовитамин В12, который неактивен у людей. При этом их наличие в крови показывает при анализе нормальную концентрацию витамина В12, что может привести к неправильному диагнозу заболеваний, связанных с дефицитом В12 Способы получения витамина В12: • из природного сырья (1т печени – 15мг витамина). • В 1972 г – в Гарвадском университете был осуществлен химический синтез витамина В12. Он включал 37 стадий, что лишало возможности организовать промышленное производство этого витамина. химический синтез (37 стадий) • микробиологический синтез – единственный способ его получения в настоящее время. Интересно, что обнаружение витамин В12 как побочного продукта при производстве антибиотиков стимулировало поиск продуцентов этого витамина. Продуценты витамина при его промышленном получении: актиномицеты, метанобразующие и фотосинтезирующие бактерии, одноклеточные водоросли. Выделено 14 видов пропионовокислых бактерий, продуцирующих этот витамин. Выращивание пропионовых бактерий производится периодическим методом в анаэробных условиях на среде с кукурузным экстрактом, глюкозой, солями кобальта и сульфатом аммония. Образующиеся кислоты нейтрализуются щелочью. Через 72 часа после начала ферментации вносят предшественник – 5,6-диметилбензимидазол (5,6-ДМБ). Без искусственного введения 5,6-ДМБ бактерии синтезируют фактор В и псевдовитамин B12 (азотистым основанием служит аденин), не имеющие клинического значения. Длительность ферментации – трое суток. 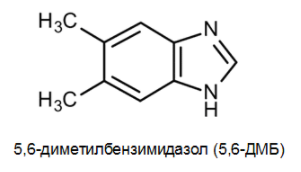 Полученную массу сепарируют, стабилизируют нитритом натрия, охлаждают, нейтрализуют, коагулируют белки и фильтруют. Очищают на ионообменной смоле, кристаллизуют и проводят химическую очистку продукта. Далее получают различные лекарственные формы препаратов. Учитывая высокую светочувствительность витамина В12 при проведении биотехнологического процесса необходимо все операции осуществлять в затемненных условиях или используя красный свет. Способы повышения выхода целевого продукта: • применение мутантов • добавление в среду 5,6 ДМБ • добавление в среду кукурузного и мясного экстракта, соевой муки, рыбной муки • применение уплотняющих агентов (агар-агар, крахмал) (бактерии плохо переносят перемешивание) • использование высоко анаэробных условий и автоматического поддержания рН. • иммобилизация на полимерах. Получение витамин РР (никотиновая кислота и никотинамид) 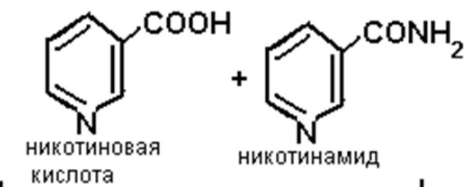 • Никотинамид является частью коферментов НАД (никотинамидадениндинуклеоти́д) и НАДФ, переносящими водород в обменных процессах • Расширяет мелкие кровеносные сосуды • Регулирует уровень холестерина в крови • Нейтрализует токсины Авитаминоз: пеллагра (болезнь трех «Д» - диарея, дерматит, деменция (слабоумие)). В англоязычной литературе иногда добавляют четвёртую «Д» — смерть англ. Death.. Пеллагра впервые была обнаружена у людей в рационе которых главным злаком являлась кукуруза (мало белка, особенно аминокислоты триптофана). Без лечения болезнь может убить в течение 4—5 лет. Лекарством является никотинамид. Массовое заболевание свиней пеллагрой бывает при продолжительном одностороннем кормлении початками кукурузы и кукурузным силосом (до 80% от общей питательности рациона), а также при кормлении вареным картофелем, особенно при отсутствии в рационе зеленых кормов. При варке картофеля в нем резко снижается содержание никотиновой кислоты. Гипервитаминоз: диарея, рвота, прилив крови к лицу и голове, сухость кожи, жировая дистрофия печени Источники: овощи, фрукты, гречневая крупа, зеленые орехи, дрожжи, печень. Зерна злаков, в т.ч. кукурузы, содержат вещества, которые при обработке щелочью превращаются в витамин РР. Поэтому в Мексике и Центральной Америке кукурузу по традиции обрабатывают известью, перед тем как выпекать из нее лепешки. В последние годы в любой престижной мировой кулинарной школе студенты изучают технику – никстамализация (приготовлении зёрен кукурузы в щелочных раствора) (от науаских слов nixtli (пепел) и tamalli (тесто)). Никотиновую кислоту получают в виде коферментной формы: никотинамидаденилдинуклеотид (НАД) экстракцией из пекарских дрожжей. Для повышения содержания НАД культивирование проводят в средах с предшественником синтеза аденина или самой никотиновой кислоты и получают 12мг НАД на 1г клеток. Для проникновения кофермента через мембраны (сам он не проникает) добавляют ПАВ (цетилсульфат натрия, цетилпиридина хлорид). Это позволяет получить до 6 г/л. Аскорбиновая кислота • Стимулирует рост, участвует в процессах тканевого дыхания, обмене аминокислот и углеводов. • Повышает сопротивляемость организма к инфекциям и негативным воздействиям. • Принимает участие в сворачивании крови и регенерации тканей, синтезе коллагена (белок – основа соединительной ткани). • Нормализует уровень холестерина в крови, способствует усвоению железа из пищи. • Важный антиоксидант. • образование нейромедиатора серотонина («гормон счастья») Гиповитаминоз– быстрая утомляемость, нарушение сердечной деятельности, ослабление иммунитета. Авитаминоз – цинга (скорбут) – нарушение синтеза коллагена: ломкость сосудов, кровоточивость десен, выпадение зубов, анемия. Гипервитаминоз: нарушение всасывания витамина В12, образование камней в почках. Суточная норма: 70-100 мг. Для курящих людей норма увеличивается. У многих млекопитающих этот витамин синтезируется (кошка), но у человека и высших приматов – нет. Свежие фрукты и овощи являются важными пищевыми источниками витамина С. Кипячение, консервирование могут разрушить часть аскорбиновой кислоты в продуктах. При вымачивании овощей витамин С переходит в воду, поэтому овощи лучше погружать сразу в кипящую воду. Важным ее источником в западных странах служит картофель. У Джека Лондона есть рассказ – в деревне все, кроме одного, заболели цингой. С помощью расследования нашли у этого человека спрятанный мешок сырой картошки, этим спасли деревню. Джеймс Кук – ввел в рацион моряков кислую капусту – все вернулись домой. Потом стали вводить в рацион цитрусовые. Нобелевский лауреат Полинг – считал, что очень прием витамина С в высоких дозах способствует излечению от множества болезней, в том числе рака. Внастоящее время для крупномасштабного производства витамина С используют в основном химический синтез, включающим одну микробиологическую стадию. 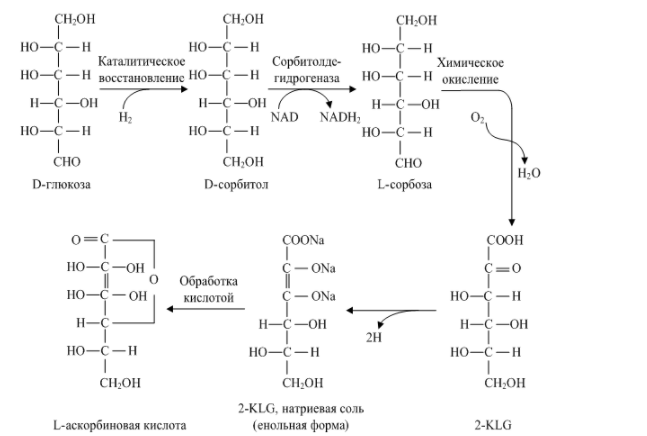 С помощью уксусно-кислых бактерий (Acetobacter suboxydans) проводят реакцию трансформации d-сорбита в L-сорбозу.В отличие от химического процесса, где в результате окисления сорбита получается смесь продуктов, окислительная трансформация с помощью бактерий характеризуется предельно точным воздействием на определенные функциональные группы. В настоящее время широкое использование биотехнологических процессов позволяет совершенствовать синтез витамина С путем сокращения многоэтапных и дорогих химических стадий. Пример: синтез аскорбиновой кислоты осуществляют енолизацией 2-кето-L-гулоновой кислоты (2-KLG). 2-KLG можно получить из глюкозы с помощью совместного культивирования микроорганизмов Corynebacterium и травяной палочки (Erwinica herbicola). Erwinica herbicolaокисляет глюкозу в 2,5-дикето-D-глюконовую кислоту, а Corynebacteriumтрансформирует 2,5-DKG в 2-KLG. 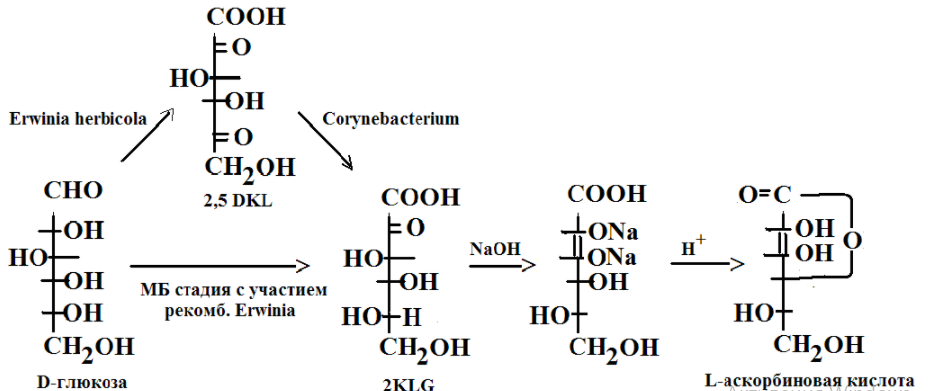 Однако условия культивирования, оптимальные для одного организма, неприемлемы для другого, что влечет спонтанное «вымывание» из среды одного из них. Можно культивировать микроорганизмы последовательно, но такой процесс трудно сделать непрерывным, так как для роста микроорганизмов необходимы разные среды. Можно создать один микроорганизм, способный превращать D-глюкозу в 2-KLG. Для этого надо выделить ген 2,5-DКG-редуктазы Corynebacterium и ввести его в Erwinica herbicola. Полученные рекомбинантный микроорганизм сможет сразу осуществлять превращение глюкозы в 2-KLG. 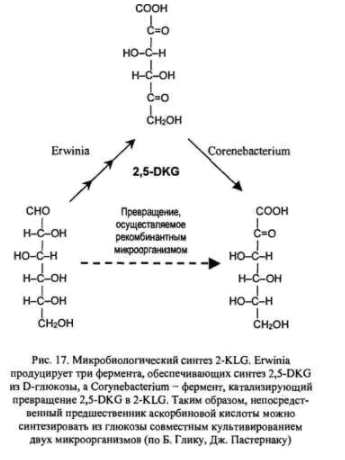 Коммерческую ценность 2,5-DKG-редуктазы можно повысить, если произвести аминокислотные замены, повышающие каталитическую активность фермента и его термостабильность. Эргостерин (провитамин D2) 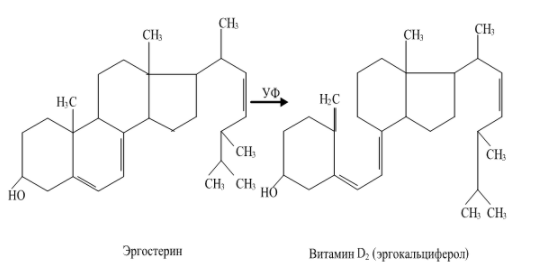 Витамин D2 (эргокальциферол): • Обеспечение всасывания кальция и фосфора из продуктов питания в тонком кишечнике • Участие в регуляции размножения клеток и обменных процессов • Стимуляция синтеза некоторых гормонов Авитаминоз: рахит(у детей), остеопороз (у взрослых), увеличение заболеваемости раком, ослабление иммунитета, повышенный риск сердечнососудистых заболеваний. Гипервитаминоз: гиперкальциемия, гиперкальциурия. Открытие. Обнаружили, что от рахита не страдали те собаки, которых кормили рыбьим жиром. Сначала думали, что это витамин А, но порция жира, в котором нейтрализовали витамин А, также помогала от рахита. Это был четвертый открытый витамин – D. Недавно выяснили, что солнцезащитные кремы с SPF 15 и выше уменьшают выработку витамина D из 7-дегидрохолестерина в организме человека на 99 %. Для обеспечения нормальной дозы витамина D необходимо находиться с открытыми для солнечных лучей конечностями на полуденном солнце (в промежуток с 10 утра до 3 часов дня), по крайней мере, дважды в неделю. Людям со светлой кожей достаточно 5-минут, темнокожие – не менее получаса. В продаже есть яд для грызунов, содержащий холекальциферол – витамин D3. Его летальная доза в пересчете на массу тела сильно различается у грызунов и людей. У животные покрытые шерстью (кошки, собаки) или перьями (птицы) 7-дегидрохолестерол (предшественник витамина D) выделяется различными кожными железами и облучается светом, находясь на шерсти или перьях. Затем они слизывают готовый провитамин, когда приводят себя в порядок. Некоторые животные (например, голый землекоп), которые большую часть жизни проводят в полной темноте, научились обходится малым количеством этого витамина. Некоторые растения являются источником витамина D. Например, в Аргентине местному населению была давно известна болезнь скота, которая сопровождалась избыточным окостенением суставов, что нарушало подвижность животных. Как оказалось, болезнь возникала за счет передозировки аналогами кальцитриолов, которые естественным образом содержались в растении паслене восколистном. Хроническое потребление травы паслена приводит к передозировке аналога витамина D у копытных. Также аналоги кальцитриола обнаружились в луговом растении Средней России – еже сборной. При этом растения освоили синтез аналогов витамина D без участия ультрафиолета! Т.к. молоко является главным источником кальция, оно было выбрано для обогащения витамином D (облучением ультрафиолетом - при получении молочного порошка, или путем добавления концентратов витамина). Либо в рацион коров добавляют облученные дрожжи. Источники витамина D: водоросли, жирные сорта рыбы, рыбий жир, дрожжи, лесные лисички (а не выращенные при искусственном освещении), сливочное масло, сыр. Может синтезироваться в организме под действием солнечных лучей. Витамин D2 образуется при облучении ультрафиолетом эргостерина, который в значительных количествах синтезируют бурые водоросли, дрожжи, плесневые грибы. Наиболее активные продуценты эргостерина – Saccharomyces, Rhodotoryla, Candida. Условия культивирования: • избыток сахара • дефицит азота • высокая температура • хорошая аэрация. В анаэробных условиях культивирования происходит накопление в клетках дрожжей сквалена Более интенсивно эргостерин образуют дрожжи рода Candida на средах с углеводородами. При получении кристаллического препарата витамина D2 культивируют плесневые грибы (Penicillium, Aspergillus). Для получения кормовых препаратов облучают ультрафиолетом суспензию или сухие дрожжи (Candida). Кроме того в качестве источника получения эргостерина можно использовать: • мицелий грибов, который остается как отход антибиотической промышленности • Cryptoccocus curvatus на средах отходами молочной промышленности и при переработке хлопка. β-каротин  β-каротина – предшественник витамина А (ретинола). Витамин А: • Является компонентом родопсина – основного зрительного пигмента (содержится в палочках сетчатки глаза) • Стимулирует рост и развитие • Структурный компонент клеточных мембран • Антиоксидант • Необходим для работы иммунной системы • Способствует нормальному обмену веществ • Участвует в синтезе белков Гиповитаминоз: куриная слепота, поражения эпителия, истощение, снижение сопротивляемости инфекциям, замедление роста у детей. Гипервитаминоз: воспаление роговицы глаза, кровоточивость десен, боли в суставах, повышение внутричерепного давления, сухость кожи, увеличение печени. Острое отравление: судороги, паралич. Источники. Рыбий жир и печень, сливочное масло, яичный желток. Многие растения содержат каротины– провитамины ретинола (морковь, лук, красный перец, салат, тыква, томаты) Однако содержание β-каротина у микроорганизмов во много раз превышает его содержание у растений. Основные продуценты: дрожжи, наиболее широко применяются плесневые грибы Blakeslea trispora. Используют кукурузно-соевую среду. Золотой рис – генетически модифицированный сорт посевного риса, в зернах которого содержится огромное количество бета-каротина. Эти зерна имеют золотисто-желтый цвет.  Считается, что это первая сельскохозяйственная культура, которая целенаправленно генетически модифицирована для улучшения пищевой ценности. При обширном выращивании, золотой рис может в несколько раз улучшить качество питания во многих странах (в том числе и в ряде стран третьего мира), где наблюдается нехватка витамина A. Для модификации риса использовали два гена: ген цветка нарцисса и ген бактерии Erwinia uredovora.  УБИХИНОНЫ (коферменты Q) 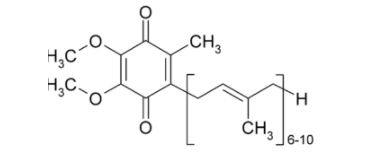  Участие убихинона в метаболических процессах проявляет регуляторный эффект, он же принимает участие в тканевом дыхании, окислительном фосфолирировании, в переносе электронов. Применение убихинонов – при ишемической болезни сердца и при повышенных нагрузках. Получение убихинонов – это биотехнология на основе каллусных культур риса или опухолевой ткани. Продуценты – бактерии, дрожжи и дрожжеподобные микроорганизмы. Сухая масса грибов рода Candida содержит смесь убихинонов. Так биотехнология совмещает в едином процессе получение убихинонов и эргостерина из микробных липидов. Уксуснокислые бактерии, используемые при окислении сорбита в сорбозу (при получении витамина С) содержат убихинон-10, который является коферментом организма человека. БИОТЕХНОЛОГИЯ ФЕРМЕНТОВ Лактозный оперон Лактозный оперон – это совокупность генов бактерии, кодирующих ферменты, принимающие участие в метаболизме лактозы (бета-галактозидазу, бета-галактозидпермеазу и бетагалактозидтрансацетилазу). Синтез этих ферментов происходит ТОЛЬКО КОГДА В ПИТАТЕЛЬНОЙ СРЕДЕ ЕСТЬ ЛАКТОЗА И НЕДОСТАТОК ГЛЮКОЗЫ. Лактозный оперон состоит из трех структурных генов, промотора и оператора. Промотор – участок ДНК перед оператором, служит местом связывания ДНК-зависимой РНК-полимеразы (транскриптазы). Оператор – участок ДНК, который граничит с первым структурным геном. С ним может связываться белок-репрессор, блокируя начало транскрипции. Репрессор – аллостерический белок, имеет два центра связывания (для оператора и для эффектора/индуктора): один центр узнает оператор, другой – взаимодействует с эффектором (индуктором). Для лактозного оперона индуктор – лактоза, она связывается с репрессором → он отсоединяется. 1) Механизм негативной регуляции. В отсутствие индуктора (лактозы) репрессор связан с оператором → транскрипция не идет. 2) Механизм позитивной регуляции. РНК-полимераза может связаться с промотором только когда к промотору присоединен регуляторный белок БАК (белок-активатор катаболитных оперонов). БАК может связаться с промотором только в том случае, если в клетке в достаточно высокой концентрации присутствует цАМФ. Когда концентрация глюкозы в клетке снижается, происходит активация фермента аденилатциклазы, которая катализирует превращение АТФ в цАМФ («сигнал клеточного голода»). Глюкоза является ингибитором фермента аденилатциклазы и активирует фосфодиэстеразу (фермент, катализирующий превращение молекулы цАМФ в АМФ). цАМФ присоединяется к БАК и образовавшийся комплекс взаимодействует с промотором лактозного оперона → теперь с промотором может связаться РНК-полимераза Т.е. если в клетке много глюкозы → много АТФ, но мало цАМФ → БАК не может связаться с промотором → синтез ферментов, нужных для метаболизма лактозы НЕ идет. Если в клетке мало глюкозы → много цАМФ → цАМФ связывается с БАК, и этот комплекс присоединяется к промотору → РНК-полимераза теперь тоже может связаться с промотором → начинается синтез ферментов, нужных для метаболизма лактозы (В СЛУЧАЕ, ЕСЛИ В СРЕДЕ МНОГО ЛАКТОЗЫ, которая связалась с белком-репрессором и он отсоединился от оператора, т.е. «освободил место для РНК-полимеразы).) 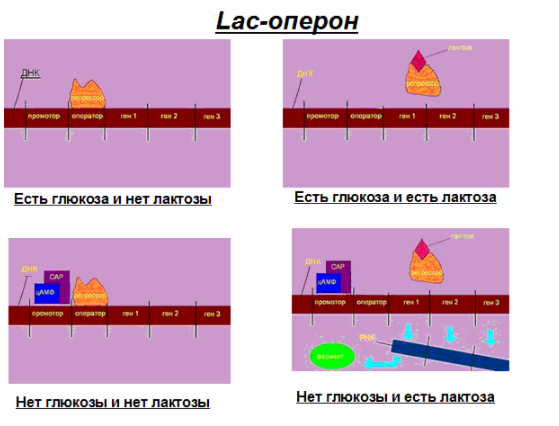 Это было установлено с использованием феномена диауксии. Диауксия – это приспособление микроорганизмов к росту в средах, содержащих два разных источника углерода. Микроорганизмы используют сначала один из источников с помощью конститутивного фермента (постоянно образующегося), а затем другой – с помощью индуцибельного фермента (образующегося при определенных условиях). Биологический смысл всего этого – чтобы ферменты метаболизма лактозы синтезировались не все время, а только тогда, когда клеткам это надо (в питательной среде много лактозы и не хватает глюкозы). Если в среде много и глюкозы, и лактозы – клетки будут использовать глюкозу. Диауксия является одним из проявлений катаболитной репрессии (репрессии глюкозой). Микробные ферменты Использование микробных ферментов в некоторых отраслях промышленности началось более 70 лет назад. Большую часть, составляют гидролазы. Ферменты: • амилолитические (L-амилаза) – их действие проявляется при гидролизе крахмала и гликогена. Применяются в спиртовой промышленности, хлебопечении. • протеолитические – ускоряют гидролиз пептидных связей в белках и пептидах. • пектолитические – объединены в одну группу по внешнему проявлению своего действия – уменьшению молекулярной массы и снижению вязкости пектиновых веществ. • целлюлолитические – их действие проявляется лишь в деполимеризации молекул целлюлозы. Использование перспективно в гидролизной промышленности (получение глюкозы из целлюлозы); в медицинской - выделение лекарственных веществ (стероидов) из растений; в пищевой - улучшение качества растительных масел; в сельском хозяйстве - как добавки в комбикорма для жвачных животных. Преимущества микробного синтеза ферментов: 1. В качестве питательной среды используют дешевое сырье (отходы производств). 2. Цикл ферментации достаточно короткий (36-40 часов при поверхностном культивировании, 48-70 часов – при глубинном). 3. Простые процессы фракционирования и разделения ферментов. 4. Микроорганизмы способны к сверхсинтезу. В качестве источника ферментов используют микроорганизмы. Исключения: • папаин (размягчитель мяса), который получают из плодов папайи, • ренин животного происхождения, • фицин выделенный из инжира. Для удешевления их производства используют культуры тканей и отдельных органов. На биосинтез фермента влияет наличие в питательной среде индукторов или репрессоров. Пример: липаза почти не синтезируется грибом на среде без индуктора, внесение кашалотового жира усиливает биосинтез фермента в сотни раз. Этот же вид гриба при добавлении в среду крахмала и полном исключении минерального фосфора интенсивно синтезирует фосфатазу. В среду добавляют факторы роста (аминокислоты, пуриновые основания, РНК). Продуктивность штаммов микроорганизмов, производящих ферменты, можно увеличить с помощью мутагенных факторов в 2-5 раз. Пересадкой плазмид получают количество ферментов, достигающее 50% массы продуцируемого белка. Синтезируемые микроорганизмами ферменты подразделяются на • внеклеточные – амилаза, целлюлаза, лактаза, липаза, пектиназа, протеаза. Их получают из культуральной жидкости, предварительно отделанной от микроорганизмов. • внутриклеточные – аспарагиназа. каталаза, инвертаза. Для их выделения разрушают клеточные оболочки с помощью механических, физических, химических (действие кислот, растворителей), ферментативных и биологических методов. Более широкое технологическое применение ферментов до последнего времени сдерживалось рядом причин: 1) трудоемкость отделения ферментов от исходных реагентов и продуктов реакции; 2) неустойчивость ферментов при хранении, различных воздействиях (тепловых); 3) трудоемкость очистки ферментов и получения их в активном виде. Используют иммобилизацию ферментов. Это перевод их в нерастворимое состояние с сохранением каталитической активности. 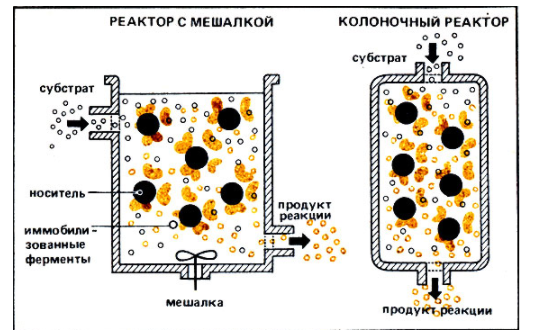 Преимущества, которыми обладают иммобилизованные ферменты по сравнению со своими растворимыми аналогами: • легко отделяются от реакционной среды и могут быть использованы повторно; • проявляют повышенную стабильность к экстремальным условиям и сохраняют активность в течение более длительного времени; • позволяет разрабатывать непрерывные технологии; • возможно создание мультиферментных иммобилизованных композиций, это, в свою очередь, позволяет осуществлять последовательные ферментные реакции разных процессов. Недостатки: • может наблюдаться снижение каталитической активности. • иммобилизованные ферменты, ввиду фиксации ферментов на носителе, не действуют на неподвижные или нерастворимые субстраты (целлюлоза, ксилан, лигнин и др.). • высокая стоимость иммобилизации. 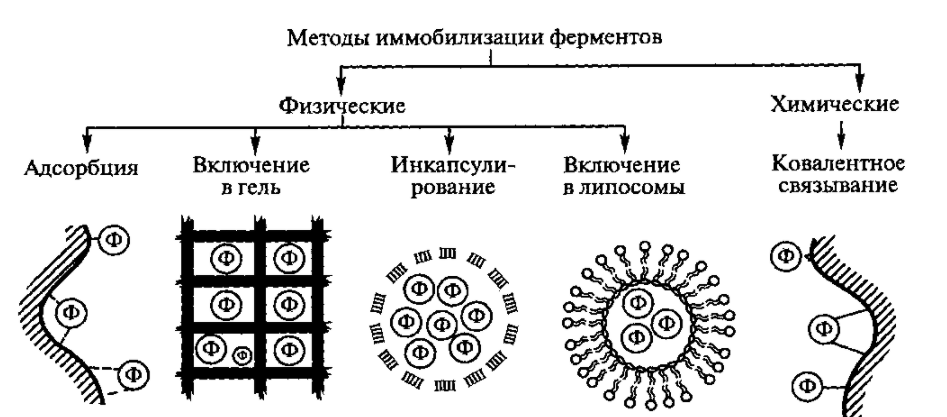 Физическая иммобилизация – адсорбция на нерастворимом носителе. В основе метода – действие электростатических сил и сил поверхностного натяжения. Смешиваем при соответствующих условиях фермент и носитель, далее инкубация и отделение нерастворимого компонента смеси центрифугированием или фильтрованием. Недостаток – непрочная связь фермента с носителем. Такая иммобилизация слабо влияет на каталитическую активность фермента. • адсорбция на поверхности нерастворимого носителя (или как иногда говорят матрикса); Наиболее старый метод. Носителями при данном способе иммобилизации могут быть как органические, так и неорганические вещества, которые применяются в виде порошка, мелких гранул или шариков. Метод простой и достигается путем обеспечения контакта водного раствора фермента с носителем. После отмывки неадсорбированного фермента препарат готов к применению. Но адсорбция фермента на носителе зависит от множества факторов среды. • включение в поры геля; Молекулы фермента включаются в трехмерную сетку, образованную тесно переплетающимися нитями, формирующими гель. Пространство между полимерными цепями в геле заполнено водой, на долю которой приходится обычно значительная часть общего объема геля. 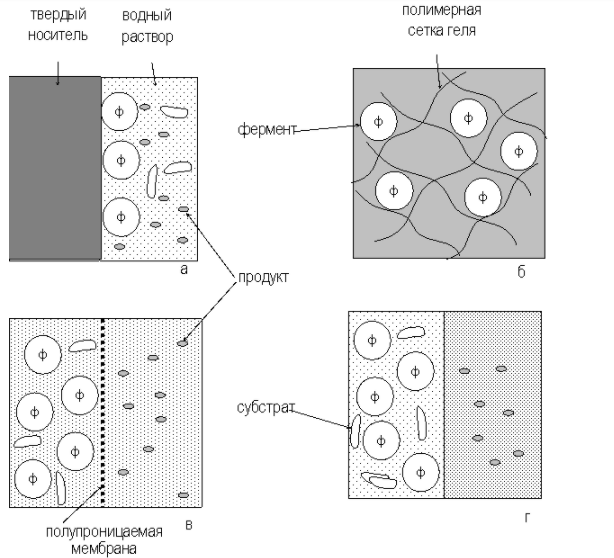 • пространственное разделение фермента от остальной части реакционной смеси с помощью полупроницаемой мембраны; Водный раствор фермента отделяется от водного раствора субстрата полупроницаемой мембраной, способной легко пропускать небольшие молекулы субстрата, задерживая крупные молекулы фермента. Модификация этого метода: микрокапсулирование в замкнутых сферических пузырьках, имеющих тонкую полимерную стенку (мембрану). • введение фермента а двухфазную реакционную среду, в которой он растворим, но может находиться только в одной из фаз. Метод двойного эмульгирования, в соответствии с которым приготовленная заранее эмульсия водного раствора фермента в органическом растворе полимера вновь диспергируется в воде. После затвердевания органического раствора образуются полимерные сферические частицы с иммобилизованными в них молекулами фермента. В медицинских целях и некоторых фундаментальных исследованиях достаточно широко используется метод иммобилизации ферментов путем их включения в липосомы, поскольку такие системы близки природным мембранам и могут дать ценную информацию о ферментативных процессах, протекающих в клетках. Химические методы иммобилизации Вследствие химических взаимодействий в молекуле фермента возникают новые ковалентные связи, в частности между ним и носителем. Может приводить к снижению ферментативной активности. Этого можно избежать, если проводить иммобилизацию в присутствии субстрата, защищающего активный центр. Для ковалентного присоединения требуется предварительная активация носителя. Иммобилизация субстратов ферментов. Это позволило создать метод выделения и очистки ферментов, основанный на хроматографии по сродству (аффинной хроматографии). Иммобилизованные клетки микроорганизмов, содержащих естественный набор ферментов. Отпадают стадии выделения, очистки и иммобилизации ферментов. Ферменты в микроорганизме более термостабильны, дольше сохраняют каталитические свойства. Носители – это вещества органической и неорганической природы. • Органические: желатин, фибрин, альгинат натрия, целлюлоза, карбоксиметилцеллюлоза, ПААГ-полиакриламидный гель. • Неорганические – термический песок, активированный уголь, окись алюминия, бентонит. 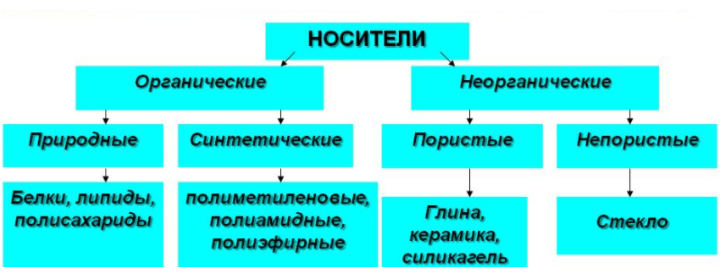 Ограничения метода иммобилизации: • если целевой продукт не выходит в среду растворителя, накапливается внутри клетки, то работать с иммобилизованным продуктом нет смысла. • Ферменты тоже не всегда можно иммобилизовать, например, если у фермента есть кофермент, который с ним не прочно связан. Кофермент можно вводить в среду, но это не всегда бывает возможно в условиях производства. |
