Биохимия. ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Экзаменационные вопросы по биологической химии для студентов лечебного, педиатрического и медикопрофилактического факультетов
 Скачать 6.22 Mb. Скачать 6.22 Mb.
|
|
Глюкокортикоиды,С21-стероиды, играют важную роль в адаптации к стрессу. Они оказывают разнообразные эффекты, но наиболее важный - стимуляция глюконеогенеза. Основной глюкокортикоид человека - кор-тизол. Минералокортикоиды,С21-стероиды, необходимы для поддержания уровня Na+ и К+. Самый активный гормон этого класса - альдостерон. Андрогены - С19-стероиды. В коре надпочечников образуются предшественники андрогенов, из которых наиболее активный - дегидроэпиандростерон (ДЭА) и слабый - андростендион. Самый мощный андроген надпочечников тестостерон синтезируется в надпочечниках в небольшом количестве. Эти стероиды превращаются в более активные андрогены вне надпочечников. Тестостерон в незначительных количествах может превращаться в надпочечниках в эстрадиол. Но в норме продукция этих гормонов надпочечниками не играет существенной роли. Биосинтез и метаболизм кортикостероидов. Общим предшественником кортикостероидов служит холестерол В митохондриях холестерол превращается в прегненолон при участии гидроксилазы, относящейся к группе цитохромов Р450. Цитохром Р450, отщепляющий боковую цепь, локализован во внутренней мембране митохондрий. Отщепление боковой цепи холестерола включает 2 реакции гидроксилирования: одна - по атому С22, другая - по С20. Последующее отщепление шестиуглеродного фрагмента приводит к образованию С21-стероида - прегненолона. Дальнейшее превращение прегненолона происходит под действием различных гидроксилаз с участием молекулярного кислорода и NADPH, а также дегидрогеназ, изомераз и лиаз. Эти ферменты имеют различную внутри- и межклеточную лбкализацию. В коре надпочечников различают 3 типа клеток, образующих 3 слоя, или зоны: клубочковую, пучковую и сетчатую. Каким именно стероидом окажется конечный продукт, зависит от набора ферментов в клетке и последовательности реакций гидроксилирования. Например, ферменты, необходимые для синтеза альдостерона, присутствуют только в клетках клубочковой зоны, а ферменты синтеза глюкокортикоидов и андрогенов локализованы в пучковой и сетчатой зонах. 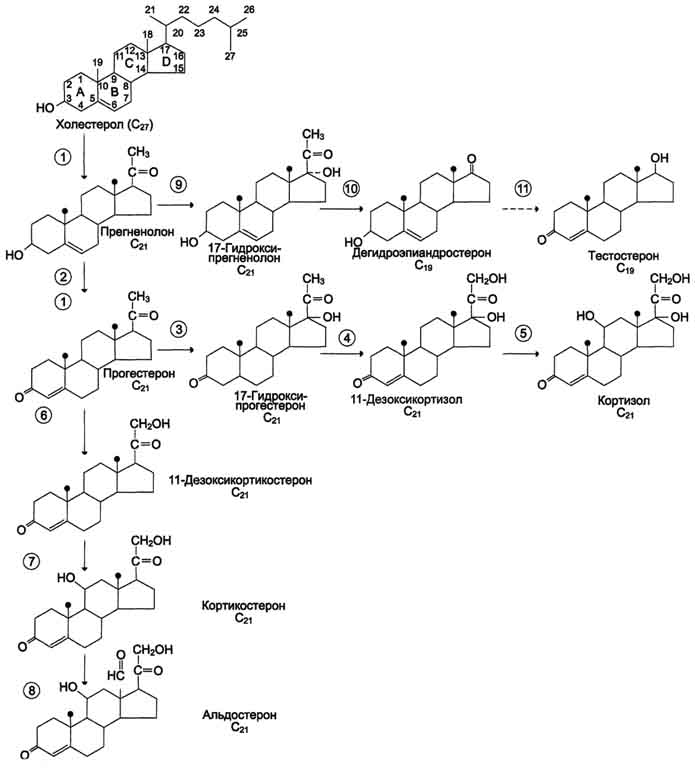 Путь биосинтеза кортизола.Кортизол синтезируется из холестерола, который в основном поступает из крови в составе ЛПНП или синтезируется в клетках из ацетил-КоА. Значительная часть эфиров холестерола накапливается в цитозоле клеток в липидных каплях. Под влиянием АКТГ происходит активация специфической эстеразы, и свободный холестерол транспортируется в митохондрии. Синтез кортизола начинается с превращения прегненолона в прогестерон. Эта реакция протекает в цитозоле клеток пучковой зоны коры надпочечников, куда прегненолон транспортируется из митохондрий. Реакцию катализирует 3-β-гидроксистероиддегидрогеназа. В мембранах ЭР при участии 17-α-гидроксилазы происходит гидроксилирование прогестерона по С17 с образованием 17-гидроксипрогестерона. Этот же фермент катализирует превращение прегненолона в 17-гидроксипрегненолон, от которого далее при участии 17,20-лиазы может отщепляться двухуглеродная боковая цепь с образованием С19-стероида - дегидроэпиандростерона. 17 -гидроксипрогестерон служит предшественником кортизола, а дегидроэпиандростерон - предшественником андрогенов. Далее 17-ОН-прогестерон гидроксилируется 21-гидроксилазой (P450-C21), локализованной в мембране ЭР, и превращается в 11-дезоксикортизол, который переносится во внутреннюю мембрану митохондрий, где гидроксилируется при участии цитохрома Р450-с11 с образованием кортизола. Скорость синтеза и секреции кортизола стимулируются в ответ на стресс, травму, инфекцию, понижение концентрации глюкозы в крови. Повышение концентрации кортизола подавляет синтез кортиколиберина и АКТГ по механизму отрицательной обратной связи. Синтез минералокортикоидовв клетках клубочковой зоны коры надпочечников также начинается с превращения холестерола в прегненолон, а затем в прогестерон. Прогестерон гидроксилируется вначале по С21 с образованием 11-дезоксикортикостерона. Следующее гидроксилирование происходит по С11, что приводит к образованию кортикостерона, обладающего слабовыраженной глюкокортикоидной и минералокортикоидной активностью. В клетках клубочковой зоны 17-α-гидроксилаза отсутствует, но есть митохондриальная 18-гидроксилаза, при участии которой кортикостерон гидроксилируется, а затем дегидрируется с образованием альдегидной группы у С18. Главным стимулом для синтеза альдостерона служит ангиотензин II Транспорт кортикостеровдов.Кортизол в плазме крови находится в комплексе с α-глобулином транскортином и в небольшом количестве в свободной форме. Синтез транскортина протекает в печени и стимулируется эстрогенами. Т1/2 кортизола составляет 1,5-2 ч. Несвязанный, или свободный кортизол, составляет около 8% от общего количества гормона в плазме и является биологически активной фракцией. Альдостерон не имеет специфического транспортного белка, но образует слабые связи с альбумином. Катаболизм гормонов коры надпочечниковпроисходит прежде всего в печени. Здесь протекают реакции гидроксилирования, окисления и восстановления гормонов. Продукты катаболизма кортикостеровдов (кроме кортикостерона и альдостерона) выводятся с мочой в форме 17-кетостероидов, образующихся в результате отщепления боковой цепи. Эти продукты метаболизма выделяются преимущественно в виде конъюгатов с глюкуроновой и серной кислотами. 17-Окси- и 17-кетостероиды образуются также при катаболизме половых гормонов, которые имеют у С17гидрокси- или кетогруппы. У мужчин 2/3 кетостероидов образуется за счёт кортикостеровдов и 1/3 за счёт тестостерона (всего 12-17 мг/суг). У женщин 17-кетостероиды образуются преимущественно за счёт кор-тикостероидов (7-12 мг/сут). Определение 17-кетостероидов в моче позволяет оценить как количество глюкокортикоидов, секретируемых корой надпочечников, так и функцию надпочечников. Биологические функции кортикостероидовотличаются широким спектром влияний на процессы метаболизма и подробно рассматриваются в соответствующих разделах. Важнейший фактор в механизме действия кортикостеровдов - взаимодействие их со специфическими рецепторами, расположенными в цитозоле клетки или в ядре. Регуляция внутриклеточных процессов под влиянием кортико-стероидных гормонов проявляется в изменении количества белков, обычно ключевых ферментов метаболизма, путём регуляции транскрипции генов в клетках-мишенях. Влияние глюкокортикоидовна промежуточный метаболизм связано с их способностью координированно воздействовать на разные ткани и разные процессы, как анаболические, так и катаболические. Кортизол стимулирует образование глюкозы в печени, усиливая глюконеогенез и одновременно увеличивая скорость освобождения аминокислот - субстратов глюконеогенеза из периферических тканей. В печени кортизол индуцирует синтез ферментов катаболизма аминокислот (аланинаминотрансферазы, трипто-фанпирролазы и тирозинаминотрансферазы и ключевого фермента глюконеогенеза - фосфо-енолпируваткарбоксикиназы). Кроме того, кортизол стимулирует синтез гликогена в печени и тормозит потребление глюкозы периферическими тканями. Это действие кортизола проявляется в основном при голодании и недостаточности инсулина. У здоровых людей эти эффекты кортизола уравновешиваются инсулином. Избыточное количество кортизола стимулирует липолиз в конечностях и липогенез в других частях тела (лицо и туловище). Кроме того, глюкокортикоиды усиливают липолитическое действие катехоламинов и гормона роста. Влияние глюкокортикоидов на обмен белков и нуклеиновых кислот проявляется двояко: в печени кортизол в основном оказывает анаболический эффект (стимулирует синтез белков и нуклеиновых кислот). В мышцах, лимфоидной и жировой ткани, коже и костях кортизол тормозит синтез белков, РНК и ДНК и стимулирует распад РНК и белков. При высокой концентрации глюкокортикоиды подавляют иммунные реакции, вызывая гибель лимфоцитов и инволюцию лимфоидной ткани; подавляют воспалительную реакцию, снижая число циркулирующих лейкоцитов, а также индуцируя синтез липокортинов, которые ингибируют фосфолипазу А2, снижая таким образом синтез медиаторов воспаления - простагландинов и лейкотриенов. Высокая концентрация глюкокортикоидов вызывает торможение роста и деления фибро-бластов, а также синтез коллагена и фибронектина. Для гиперсекреции глюкокортикоидов типичны истончение кожи, плохое заживление ран, мышечная слабость и атрофия мышц. Глюкокортикоиды участвуют в физиологическом ответе на стресс, связанный с травмой, инфекцией или хирургическим вмешательством. В этом ответе в первую очередь участвуют катехоламины, но во многих случаях для проявления их максимальной активности необходимо участие глюкокортикоидов. Минералокортикоидыстимулируют реабсорбцию Na+ в дистальных извитых канальцах и собирательных трубочках почек. Кроме того, они способствуют секреции К+, NH4+ в почках, а также в других эпителиальных тканях: потовых железах, слизистой оболочке кишечника и слюнных железах. В организме человека альдостерон - наиболее активный минералокортикоид. Изменения метаболизма при гипо- и гиперфункции коры надпочечников. Заболевания коры надпочечников могут проявиться симптомами как гипо-, так и гиперпродукции гормонов. Большинство клинических проявлений надпочечниковой недостаточности обусловлено дефицитом глюкокортикоидов и минералокортикоидов. Острая надпочечниковая недостаточность представляет большую угрозу для жизни, так как сопровождается декомпенсацией всех видов обмена и процессов адаптации. Она проявляется сосудистым коллапсом, резкой адинамией, потерей сознания. Такое состояние возникает вследствие нарушения обмена электролитов, которое приводит к потере ионов Na+ и Сl- с мочой, обезвоживанию за счёт потери внеклеточной жидкости, повышению уровня К+ в сыворотке крови, в межклеточной жидкости и клетках, в результате чего может нарушаться сократительная способность миокарда. Изменение углеводного обмена проявляется в снижении уровня сахара в крови, уменьшении запаса гликогена в печени и скелетных мышцах. Острая недостаточность функции коры надпочечников может быть следствием декомпенсации хронических заболеваний, а также развивается у больных, лечившихся длительное время глюкокортикоидными препаратами по поводу неэндокринных заболеваний, например инфекционно-аллергических заболеваний. В результате длительного приёма глюкокортикоидов подавляется функция гипоталамо-гипофизарно-надпочечниковой системы и развивается атрофия клеток коры надпочечников. Резкая отмена гормональных препаратов может сопровождаться острой надпочечниковой недостаточностью (так называемый синдром "отмены"). Первичная недостаточность надпочечников (болезнь Аддисона)развивается в результате поражения коры надпочечников туберкулёзным или аутоиммунным процессом. Основные клинические проявления выражаются в снижении массы тела, общей слабости, снижении аппетита, тошноте, рвоте, снижении АД и типичной для первичной надпочечниковой недостаточности гиперпигментацйи кожи ("бронзовая болезнь") . Причина гиперпигментации - повышение продукции ПОМК - предшественника АКТГ и меланоцитстимулирующего гормона. Вторичная недостаточность надпочечниковможет развиться при дефиците АКТГ, что, в свою очередь, может быть следствием опухоли или инфекционного поражения гипофиза. При вторичной недостаточности надпочечников, в отличие от болезни Аддисона, отсутствует гиперпигментация. При врождённой гиперплазии надпочечниковнарушается синтез кортизола. В 95% случаев при этой патологии обнаруживается дефект 21-гидроксилазы (реже 11-гидроксилазы). Снижение продукции кортизола сопровождается увеличением секреции АКТГ, накоплением промежуточных продуктов синтеза кортикостероидов, в частности, предшественников андрогенов. Избыток андрогенов ведёт к усилению роста тела, раннему половому созреванию у мальчиков и развитию мужских половых признаков у девочек (адреногенитальный синдром). При частичной недостаточности 21-гидроксилазы у женщин может нарушаться менструальный цикл. Гиперпродукция глюкокортикоидов (гиперкортицизм)может быть следствием повышения уровня АКТГ при опухолях гипофиза (болезнь Иценко-Кушинга)и опухолях других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола при гормонально-активных опухолях коры надпочечников (синдром Иценко-Кушинга). При гиперкортицизме наблюдаются гипергликемия и снижение толерантности к глюкозе, обусловленные стимуляцией глюконеогенеза ("стероидный диабет"), усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани. Характерно своеобразное перераспределение отложений жира ("лунообразное лицо", выступающий живот). Гипернатриемия, гипертензия, гипокалиемия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.ттДля выявления первичной причины гиперкортицизма, помимо определения концентрации АКТГ в плазме крови, используют тесты с применением высоких доз синтетического глюкокортикоида дексаметазона (структурного аналога кортизола). Дексаметазон подавляет секрецию АКТГ по механизму отрицательной обратной связи.иДля болезни Иценко-Кушинга характерно снижение концентрации кортизола после применения дексаметазона более чем на 50%. Отсутствие реакции на введение дексаметазона может указывать на наличие опухоли надпочечников или внегипофизарной секреции АКТГ. 128. Регуляция синтезами секреции гормонов по принципу обратной связи. Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратной связи. Изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус. Синтез и секреция тропных гормонов подавляется гормонами эндокринных периферических желёз. Такие петли обратной связи действуют в системах регуляции гормонов надпочечников, щитовидной железы, половых желёз. Схема взаимосвязи регуляторных систем организма. 1 - синтез и секреция гормонов стимулируется внешними и внутренними сигналами; 2 - сигналы по нейронам поступают в гипоталамус, где стимулируют синтез и секрецию рилизинг-гормо-нов; 3 - рилизинг-гормоны стимулируют (либерины) или ингибируют (статины) синтез и секрецию тройных гормонов.гипофиза; 4 - тройные гормоны стимулируют синтез и секрецию гормонов периферических эндокринных желез; 5 - гормоны эндокринных желез поступают в кровоток и взаимодействуют с клетками-мишенями; 6 - изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов эндокринных желез и гипоталамуса; 7 - синтез и секреция тройных гормонов подавляется гормонами эндокринных желез; ⊕ - стимуляция синтеза и секреции гормонов; ⊝ - подавление синтеза и секреции гормонов (отрицательная обратная связь). 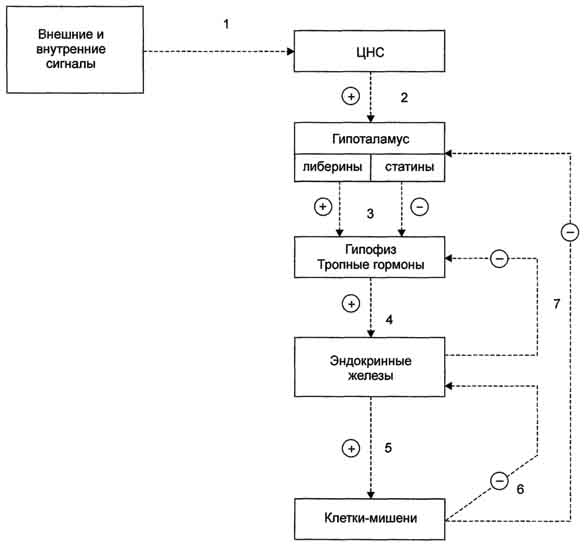 129. Половые гормоны: строение, влияние на обмен веществ и функции половых желез, матки и молочных желез. Половые гормоны — гормоны стероидной природы, определяющие у человека и животных половую дифференцировку в эмбриональном периоде, характер вторичных половых признаков, функциональную активность репродуктивной системы и формирование специфических поведенческих реакций. Они влияют на многие процессы промежуточного обмена, водно-солевой обмен, а также на состояние адаптационных систем организма. К половым гормонам относятся андрогены, эстрогены и прогестины. Андрогены — мужские половые гормоны, производные андростана, синтезирующиеся в основном в яичках; некоторое количество андрогенов образуется в коре надпочечников и яичниках. Наиболее активный андроген тестостерон по своей химической структуре является стероидом. Биосинтез андрогенов представляет собой ряд последовательных ферментативных превращений холестерина. Основным физиологическим регулятором секреции андрогенов служит лютеинизирующий гормон, взаимодействующий со специфическими циторецепторами. Андрогены, имеющие кетогруппу (СО-группу) при С17, объединяют в группу 17-кетостероидов. В печени андрогены конъюгируются с серной или глюкуроновой кислотами, образуя конъюгаты (парные соединения), которые выводятся с мочой. В крови они содержатся в виде комплексов с липопротеинами, частично в виде свободных глюкуронидов или сульфатов. Тестостерон образуется в яичках, яичниках и надпочечниках. В яичках он продуцируется главным образом клетками Лейдига, в яичниках — тека-клетками овариальных фолликулов, а также в межуточной ткани коркового вещества. В организме взрослого мужчины образуется 4—7 мгтестостерона в сутки, причем около 0,5 мг — в надпочечниках. Яичники и надпочечники взрослой женщины продуцируют примерно 0,5 мгтестостерона в сутки. Основная масса тестостерона, циркулирующего в крови, находится в виде комплекса со специфическим транспортным белком — тестостеронэстрадиолсвязывающим глобулином (ТЭСГ). Связанный с ТЭСГ тестостерон не подвержен метаболическим превращениям. Связывание тестостерона с ТЭСГ служит одним из факторов, определяющих скорость его метаболического клиренса. Метаболические превращения тестостерона осуществляются в печени, почках, кишечнике, легких, коже и других органах. Особое место в его метаболизме принадлежит превращениям в тканях-мишенях. Для метаболического превращения тестостерона в тканях-мишенях характерна 5a-редуктазная реакция, в результате которой образуется 5a-дигидротестостерон. Этот процесс является необходимым этапом биологического действия тестостерона, т.к. именно 5a-дигидроформа связывается с рецепторами тканей-мишеней, 5a-Дигидротестостерон обладает большей андрогенной активностью, чем тестостерон, в связи с чем некоторые исследователи рассматривают тестостерон как прогормон. Биологическое действие тестостерона наиболее специфично в тканях-мишенях, где происходит его избирательное накопление. Рецепторы к тестостерону обнаружены в клетках семенных канальцев, в придатке яичка, предстательной железе, семенных пузырьках, гипоталамусе, матке, фолликулах яичников на определенных стадиях их развития. Андрогенная активность тестостерона проявляется во внутриутробном периоде, когда он, декретируемый яичками плода, обеспечивает половую дифференцировку гипоталамуса, а также формирование внутренних и наружных половых органов по мужскому типу. В период полового созревания под влиянием тестостерона происходит формирование половых органов и развитие вторичных половых признаков. В репродуктивном периоде тестостерон стимулирует определенные этапы сперматогенеза, а также поддерживает половую активность. В женском организме тестостерон оказывает специфическое действие на процессы биосинтеза в клетках матки, а также влияет на развитие фолликулов яичников. Тестостерон обладает выраженным анаболическим действием, связанным со стимуляцией синтеза белка, которое проявляется при формировании фенотипа. Снижение его секреции в мужском организме при гипогонадизме оказывает влияние на формирование наружных половых органов, развитие вторичных половых признаков и сперматогенез. Клиническая симптоматика гипогонадизма во многом определяется степенью недостаточности выработки тестостерона и тем этапом онтогенеза, на котором это нарушение возникло. У женщин повышенная секреция тестостерона надпочечниками (адреногенитальный синдром, вирилизирующие опухоли надпочечников) или яичниками (вирилизирующие опухоли яичников, склерокистозные яичники) приводит к нарушению генеративной функции яичников, а также к вирилизации.  Эстрогены являются производными эстрана, С18-стероидами с ароматическим циклом, фенольной гидроксильной группой при С3 и кетогруппой или гидроксилом при С17. Биосинтез эстрогенов как биохимический процесс представляет собой ароматизацию С19-стероидов, катализируемую комплексом ферментов, локализованных в микросомах. У женщин детородного возраста основная масса эстрогенов синтезируется в яичнике, содержащем зреющий фолликул или желтое тело. Синтез эстрогенов в фолликуле определяется взаимодействием двух стероидпродуцирующих структур зернистого слоя и текаклеток. При этом в последних под регулирующим влиянием лютеинизирующего гормона осуществляется синтез С19-стероидов — андрогенов, которые перемещаются в клетки зернистого слоя, где происходит процесс их ферментативной ароматизации и превращения в эстрогены под контролем фолликулостимулирующего гормона. Синтез эстрогенов в зреющем фолликуле является одним из основных факторов, определяющих функцию гипофизарно-овариальной системы, т.к. повышение концентрации эстрогенов в крови в фазе роста фолликула вызывает преовуляторный выброс лютеинизирующего и фолликулостимулирующего гормонов, которые необходимы для завершения процесса созревания вторичного фолликула и овуляции. Биосинтез эстрогенов путем ароматизации С19-стероидов происходит не только в стероидпродуцирующих железах внутренней секреции, но и во многих тканях организма (жировой ткани, мышцах, печени, почках и др.). В крови эстрогены находятся в основном в виде комплексов с транспортными белками. Образование таких комплексов служит одним из факторов регуляции биологической активности и интенсивности обмена эстрогенов. Основным направлением метаболизма эстрогенов является гидроксилирование стероидного ядра их молекулы в различных положениях. На направленность метаболизма эстрогенов влияет ряд факторов. Так, интенсивность С16-гидроксилирования возрастает при увеличении массы тела, дисфункции печени, снижении концентрациитиреоидных гормонов в крови. Метаболизм эстрогенов происходит в органах-мишенях, почках, коже, эритроцитах и др., однако центральная роль в этом процессе принадлежит печени. Эстрогены, циркулируя в печени, метаболизируются в ней и с желчью попадают в желудочно-кишечный тракт. При этом часть эстрогенов всасывается обратно в кровь, подвергаясь реактивации. В печени образуются водорастворимые конъюгаты эстрогенов и их метаболиты с глюкуроновой и серной кислотами. Кишечно-печеночный цикл и процессы активации — инактивации эстрогенов являются механизмами, регулирующими их обмен и выведение из организма. Нарушение этих механизмов объясняет появление гиперэстрогении у мужчин, больных циррозом печени. Эстрогены и их метаболиты экскретируются с мочой и калом. Физиологический эффект эстрогенов определяется их взаимодействием с рецепторами клеток-мишеней. Рецепторы эстрогенкомпетентных клеток обладают неодинаковым сродством к различным природным и синтетическим эстрогенам. Так, связывание эстрадиола выше, чем синэстрола (гексэстрадиола), эстрона, эстриола (в порядке убывания), что соответствует биологической активности перечисленных эстрогенов в отношении клеток-мишеней. Основное биологическое действие эстрогенов заключается в их влиянии на формирование и функционирование женских половых органов. Эстрогены вызывают увеличение матки за счет роста стромы миометрия и эндометрия, под влиянием эстрогенов осуществляется васкуляризация эндометрия и рост его желез. На протяжении менструального цикла под влиянием меняющегося уровня секреции эстрогенов происходят морфологические изменения слизистой оболочки матки и эпителия влагалища. Под контролем эстрогенов находятся некоторые ключевые этапы яичникового цикла: они дифференцированно влияют на чувствительность клеток зернистого слоя и текаклеток к лютеинизирующему и фолликулостимулирующему гормонам. Эстрогены участвуют в формировании вторичных половых признаков, оказывают модулирующее влияние на различные структуры гипоталамуса, что, в частности, находит выражение в формировании специфического полового поведения. Важную роль играют эстрогены в регуляции функции молочных желез также на жировой обмен, обмен веществ в костной ткани и коже, систему мононуклеарных фагоцитов.  Прогестины. Желтым телом яичника, корой надпочечников, яичками и плацентой синтезируется стероидный гормон прогестерон, который относится к С21 стероидам. Образование прогестерона в яичниках вне беременности регулируется лютеинизирующим гормоном, а при беременности — хорионическим гонадотропином. Механизм действия прогестерона такой же, как у всех стероидных гормонов. Этот гормон взаимодействует со специфическими цитоплазматическими белковыми рецепторами, образуя комплекс, который переносится в ядро клетки и активирует определенные структуры хроматина. В результате стимулируется синтез специфических белков и изменяется функциональное состояние органов-мишеней. Прогестерон участвует в регуляции циклической трансформации эндометрия. Под его влиянием происходят секреторное преобразование эндометрия в лютеиновой фазе менструального цикла, а также функциональные изменения в маточных трубах, влагалище и эпителии молочных желез. Одной из основных физиологических функций прогестерона является торможение сократительной функции миометрия, особенно во время беременности. Снижение секреции прогестерона желтым телом (вне беременности) приводит к недостаточности лютеиновой фазы менструального цикла и к неполноценной секреторной трансформации эндометрия. 130. Гормон роста, строение, функции. Гормон роста (соматотропин) - пептидный гормон образуется в соматотропных клетках аденогипофиза. Молекула СТГ состоит из 191 аминокислотного остатка (на восемь остатков меньше, чем в молекуле пролактина ) и в отличие от пролактина содержит не три, а два внутримолекулярных дисульфидных мостика Гормоном роста соматотропин называют за то, что у детей и подростков, а также молодых людей с ещё не закрывшимися зонами роста в костях он вызывает выраженное ускорение линейного (в длину) роста, в основном за счет роста длинных трубчатых костей конечностей. Соматотропин оказывает мощное анаболическое и анти-катаболическое действие, усиливает синтез белка и тормозит его распад, а также способствует снижению отложения подкожного жира, усилению сгорания жира и увеличению соотношения мышечной массы к жировой. Кроме того, соматотропин принимает участие в регуляции углеводного обмена — он вызывает выраженное повышение уровня глюкозы в крови и является одним из контринсулярных гормонов, антагонистов инсулина по действию на углеводный обмен. Описано также его действие на островковые клетки поджелудочной железы, иммуностимулирующий эффект, усиление поглощения кальция костной тканью и др. Многие эффекты гормон роста вызывает непосредственно, но значительная часть его эффектов опосредуется инсулиноподобными факторами роста. 131. Метаболизм эндогенных и чужеродных токсических веществ: реакции микросомального окисления и реакции конъюгации с глутатионом, глюкуроновой кислотой, серной кислотой. Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы. В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями. Сисгема обезвреживания включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть модифицирован. Микросомальные ферменты катализируют реакции С-гидроксилирования, N-гидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования. В мембранах ЭР практически всех тканей локализована сисгема микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырёк - микросому, отсюда и название - микросомальное окисление. Эта сисгема обеспечивает первую фазу обезвреживания большинства гидрофобных веществ. В метаболизме ксенобиотиков могут принимать участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны они в печени. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации. Вторая фаза - реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными сисгемами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма. Микросомальное окисление. Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом. Основные ферменты микросомальныхэлектронтранспортных цепей. Микросомальная сисгема не содержит растворимых в цитозоле белковых компонентов, все ферменты - мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Сисгема включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу. |
