Экзаменационные вопросы по дисциплине Микробиология, вирусология
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
Первая стадия иммунного ответа (эндоцитоз, процессинг и презентация антигена). Антигенпредставляющая клетка (макрофаг, дендритная клетка или В-лимфоцит) сталкивается с нативным антигеном и поглощает его. Макрофаги фагоцитируют главным образом патогены, для которых характерно внутриклеточное паразитирование (вирусы, бактерии, грибы, простейшие и др.); дендритные клетки пиноцитируют вирусы; В-клетки интернализируют различные токсины. Следующее событие, процессинг, представляет собой ферментативный катализ макромолекулы антигена внутри антигенпредставляющей клетки. В результате процессинга происходит высвобождение доминирующей антигенной детерминанты (иммуноактивного пептида или суперантигена), который загружается на желобки собственных молекул HLA I или HLA II и выводится на поверхность клетки для представления лимфоцитам. В зависимости от происхождения антигена выделяют два пути процессинга. Экзогенные антигены презентируются в комплексе с молекулами HLA II «наивным» CD4+ T-клеткам (путь, опосредуемый HLA II). Сначала эти антигены поглощаются и фрагментируются с помощью протеолитических ферментов в эндосомах (лизосомах). В то же самое время молекулы HLA II, связанные с шаперонами (калнексином и инвариантной цепью Ii), синтезируются и собираются в эндоплазматическом ретикулуме. Ii-цепь необходима для защиты желобка молекулы HLA вплоть до того момента, пока не будет загружен антигенный пептид. Затем комплекс HLA II/Ii-цепь транспортируется через аппарат Гольджи в эндосомы, где Ii-цепь теряется, а роль по защите желобка начинают выполнять дополнительные молекулы HLA-DM и, вероятно, HLA-DO. Наконец, антигенный пептид загружается на желобок молекулы HLA II, и этот комплекс экспрессируется на поверхности клетки. Эндогенные или внутриклеточно расположенные антигены микробного происхождения загружаются на молекулы HLA I (путь, опосредуемый HLA I) для представления «наивным» CD8+ T-клеткам. Сначала, в отличие от экзогенных антигенов, такие цитоплазматические антигены перемещаются в цитозоль, где они расщепляются в крупном протеолитическом комплексе - протеасоме. После этого антигенный пептид транспортируется через «туннель» молекул TAP-1/TAP-2 в эндоплазматический ретикулум. Одновременно здесь происходит сборка молекулы HLA I, желобок которой (по аналогии с Ii-цепью у HLA II) находится «под защитой» шаперонов (сначала калнексина, затем кальретикулина), а укладка всей молекулы HLA I в последующем стабилизируется дополнительными молекулами (тапазином и др.). После загрузки антигенного пептида на желобок HLA I этот комплекс транспортируется на поверхность клетки. Небелковые антигены загружаются на не-HLA-антигенпредстав ляющие молекулы CD1. В целом макрофаги и В-клетки вовлечены, соответственно, в Т-клеточный или гуморальный иммунный ответ по пути, опосредованному HLA II, а дендритные клетки двух типов способны к перекрестной презентации. Дендритная клетка типа 1 осуществляет процессинг эндогенных антигенов по пути с HLA I для запуска Т-клеточного ответа, а дендритная клетка типа 2 процессирует экзогенные антигены по пути с HLA II и включает В-клеточный ответ. Тимуснезависимые антигены активируют В-клетки непосредственно, без помощи Т-клеток. В зависимости от способа активации В-клеток различают 2 группы таких антигенов – ТН1-антигены и ТН2-антигены. ТН1-антигены вызывают поликлональную активацию В-лимфоцитов. Пример – ЛПС клеточной стенки грамотрицательных бактерий. ТН2-антигены представлены крупными молекулами с повторяющимися антигенными детерминантами – пример: фиколл, декстран, флагелин бактерий, они вызывают перекрестное сшивание антигенраспознающих рецепторов В-лимфоцитов и активацию этих клеток, однако при этом необходимы цитокины. В результате этих взаимодействий В-лимфоциты дифференцируются в плазмоциты и синтезируют IgM и IgG, не формируется длительная иммунная память. ТН антигены активируют преимущественно В1-клетки, локализованные в полостях тела – брюшной и плевральной. 33. Конечный этап иммунного ответа – освобождение организма от патогена, супрессия ИО и формировапние иммунологической памяти и протективного иммунитета (постинфекционного, инфекционного, с преобладанием гуморального (антибактериального, антитоксического и др.) или клеточного иммунитетов), слабонапряженного, типоспецифического и др. Примеры. В эффекторной фазе иммунного ответа связанный Аг подвергается фагоцитозу и разрушению гидролитическими ферментами, кислородными радикалами, радикалами оксида азота до мелких метаболитов, которые экскретируются из организма через системы выделения (почки, ЖКТ). Второй результат лимфоцитарной иммунной реакции - иммунологическая память. Супрессия, или подавление иммунного ответа, является физиологической реакцией организма, которая в норме завершает иммунный ответ. Иммуносупрессия развивается при устранении из организма антигенного раздражителя и направлена на торможение экспансии антигенспецифичных клонов лимфоцитов. В отличие от иммунологической толерантности, супрессии подвергается уже инициированное иммунное реагирование. Различают три механизма иммуносупрессии: уничтожение клонов иммунокомпетентных клеток путем апоптоза, торможение активности иммунокомпетентных клеток цитокинами, • элиминация антигенного стимула. Апоптоттеской элиминации подвергаются следующие группы клеток: терминально дифференцированные лимфоциты, завершившие свою биологическую программу; активированные лимфоциты, не получившие антигенного стимула; «изношенные» лимфоциты; аутореактивные клетки. Функциональная активность иммунокомпетентных клеток может быть ингибирована растворимыми факторами их конкурентов или потомков. Ведущая роль в этом явлении принадлежит иммуноцитокинам с множественными эффектами. Известно, например, что Т2-хелперы и тучные клетки при помощи ИЛ-4, -13 препятствуют дифференцировке Т-хелпера в Т1-клетку. Последний, в свою очередь, может блокировать образование Т2-хелпера, синтезируя у-ИФН. Пролиферацию Т- и В-лимфоцитов ограничивает Р-ТФР, который продуцируют терминально дифференцированные Т-хелперы. Уже упомянутые продукты Т2-хелпера (ИЛ-4, -13 и р-ТФР) подавляют биологическую активность макрофагов. 34. Иммунологический метод диагностики инфекционных заболеваний. Принципы использования реакций иммунитета в диагностике инфекционных заболеваний. Компоненты и механизм иммунологических реакций. Экспресс диагностика. В основу реакций иммунитета положено специфическое взаимодействие антигена с антителом. С помощью известных антигенов можно определить наличие антител в сыворотке крови больного или обследуемого лица (серологическая диагностика инфекционных заболеваний). И, наоборот, наличие специфических иммунных сывороток позволяет установить родовую, видовую и типовую принадлежность микроорганизма (серологическая идентификация микроба по антигенной структуре). Реакции иммунитета применяются для диагностики инфекционных болезней, анализа антигенной структуры микроорганизмов, суждения об эволюционных и генетических связях различных видов организмов. В основу практического применения этих реакций положен принцип тесной физико-химической связи между антигенами и антителами, специфичности их взаимодействия. На основании этого принципа по одному известному компоненту можно делать заключение о природе другого, т. е. природу неизвестного возбудителя можно определить по известным антителам и наоборот. Реакции иммунитета дают возможность судить о динамике защитных свойств организма в процессе инфекционного заболевания, степени иммунитета, возникающего в случае применения предохранительных прививок. Реакция агглютинации (РА) на стекле. РА на стекле - ориентировочная РА, наступающая в течении нескольких минут, применяется только с целью идентификации выделенной из организма больного чистой культуры бактерий по антигенной структуре. В РА на предметном стекле, поставленной с целью идентификации возбудителя брюшного тифа по антигенной структуре участвуют 3 ингредиента: 1)выделенная чистая культура S.typhi на скошенном МПА (корпускулярный АГ- агглютиноген); 2)диагностические видоспецифические антисыворотки с АТ-ми против S.typhi, S. paratyphi A и S. paratyphi B., полученные путем гипериммунизации кроликов соотвествующими бактериальными антигенами; 3)изотопический раствор хлорида натрия (электролит). Паралелльно вставится три реакции на стекле: а)1 капля физ. раствора + 1 капля диагностической сыворотки против S.typhi + бактерии со скошенного агара; б)1 капля физ. раствора + 1 капля диагностической сыворотки против S. paratyphi A + бактерии со скошенного агара; в)1 капля физ. раствора + 1 капля диагностической сыворотки против S. paratyphi В + бактерии со скошенного агара; Хорошо перемешать. Наличие агглютинации (выпадение хлопьев белого цвета) указывает на присутствие соответствующего возбудителя, при отрицательной - наблюдается равномерное помутнение. Агглютинация – это склеивание бактериальных клеток под влиянием специфических антител. 9.2 Развернутые реакции агглютинации Видаля, Вейгля и Райта Агглютинация – это склеивание и выпадение в осадок микроорганизмов или других клеток (корпускулярных антигенов) под действием специфических антител в присутствии электролитов. Развернутая РА в пробирках (объемный способ) применяется для серологической диагностики инфекционных заболеваний, то есть для определения динамики нарастания титра противомикробных антител в сыворотке крови (реакция Видаля - при брюшном тифе и паратифах, р. Вейгеля - при эпидемическом сыпном тифе, р. Райта - при бруцеллезе и др.) и для серологической идентификации микробов. РА Видаля применяется с целью серодиагностики брюшного тифа и паратифов А и В, то есть для определения антител, и изучения динамики нарастания и сохранения антител против S.typhi, S. paratyphi A и S. paratyphi B, которые обнаруживаются в крови больного со 2-ой недели заболевания. Компоненты реакции: 1)исследуемая сыворотка крови в разведениях от 1:100 до 1:800; 2) три диагностикума - взвеси убитых сальмонелл: S.typhi, S. paratyphi A и S. paratyphi В; 3) изотопический раствор хлорида натрия (электролит). Реакция ставится в три ряда пробирок по 5 пробирок в каждом ряду, из которых 4 опытных и одна контрольная (физ. раствор+диагностикум). Реакцию инкубируют: в термостате в течение 2 часов при 37°С, при этом образуются крупнохлопчатый осадок за счет жгутикового Н-антигена; при комнатной температуре в течение 18-24 часов, выпадает мелкозернистый осадок за счет соматического О-АГ. Механизм реакции. Реакция протекает в две фазы: 1) соединение АГ с АТ (специфическая фаза); 2) выпадение образовавшегося комплекса АГ-АТ (агглютината) в растворе солей (электролите) в осадок (неспецифическая фаза). Антигены поливалентны, а антитела двух – (IgG) или более валентны (IgМ). Соединение их приводит к образованию макроконгломератов, выпадающих в осадок. При учёте реакции сначала просматривают контрольную пробирку. В ней при лёгком встряхивании наблюдается равномерное помутнение, хлопьев не должно быть. Опытные пробирки просматривают одновременно с контрольной, держа в одной руке и встряхивая. При положительной реакции обнаруживаются хлопья из склеенных бактерий. Учитывают максимальное разведение сыворотки, при котором произошла отчетливая агглютинация (титр сыворотки). Диагностический титр равен 1:200, то есть реакция считается положительной при наличии агглютинации в разведении сыворотки 1:200 и более. Недостатки реакции: 1) реакция положительна начиная со 2-ой недели заболевания; 2) реакция положительна в 3-х случаях: у больных («инфекционная» реакция), у переболевших («анамнестическая») и у вакцинированных («прививочная»). Для дифференциации реакций прибегают к повторной постановке ее через 5-6 дней. У больных отмечается нарастание титра антител в 4 и более раза. При «прививочной» и «анамнестической» реакциях титр антител не изменится; 3) реакция может быть группоспецифической - положительной с двумя или тремя антигенами. При групповой агглютинации учет реакции проводится по максимальному титру антител. Реакцию Видаля можно поставить одновременно с Н- и О-антигенами бактерий брюшного тифа, что помогает дифференцировать «инфекционную» от «прививочной», так как у привитых и переболевших обнаруживаются только Н-антитела, О- агглютинин в высоком титре отмечается только в разгар болезни. РА Вейгеля ставится с диангостикумом Ricketsia prowazekii (взвесь убитых риккетсий), РА Райта – с бруцеллезным диагностикумом (взвесь убитых бруцелл: B. melitensis, B. abortus и B. suis). 9.3 РПГА – реакция пассивной гемагглютинации (определение напряженности поствакцинального противодифтерийного и противоскарлатинозного антитоксических иммунитетов) Под РПГА понимают реакцию, в которой АТ-а взаимодействуют с высокодисперсными АГ (гаптенами), предварительно адсорбированными на корпускулярных носителях - эритроцитах, которые при этом склеиваются. Компоненты РПГА, применяемой для определения напряженности поствакцинального противодифтерийного антитоксического иммунитета: 1) испытуемая сыворотка крови в разведениях от 1:10 до 1:20480; 2) диагностикум дифтерийный эритроцитарный – дифтерийный анатоксин, адсорбированный на поверхности эритроцитов; 3) физиологический раствор; 4) противодифтерийная контрольная сыворотка с активностью 10МЕ/мл; 5) полистероловые пластины (при их отсутствии – пробирки). Испытуемую сыворотку разводят физ. раствором от 1:10 до 1:20480 в 12 лунках. Вносят по 1 капле диагностикума в каждую лунку. Ставят контроли специфичности реакции с иммунной противодифтерийной антисывороткой (положительная реакция) и нормальной сывороткой (отрицательная реакция). Противодифтерийную контрольную сыворотку (с активностью 10МЕ/мл) разводят от 1:10 до 1:20480 и вносят также по 1 капле диагностикума. Оставляют при комнатной температуре на 3 часа (максимум на 15-20 часов) и читают реакцию. При положительной реакции, в результате образования комплекса (АГ-АТ) на поверхности эритроцитов, последние склеиваются и равномерно покрывают все дно пробирки или всю лунку пластинки в виде зонтика с неровными краями. При отрицательной реакции эритроциты выпадают в осадок в виде маленького диска с ровными краями («пуговки»). Титром антитоксина в исследуемом материале считают последнее максимальное разведение, которое еще вызывает агглютинацию эритроцитов. Расчет активности испытуемой сыворотки производят по формуле: Х=(10ЧА)/В, где: Х – активность испытуемой сыворотки в МЕ/мл.; 10 – титр контрольной сыворотки в МЕ/мл.; А – максимальное разведение испытуемой сыворотки с положительным результатом; В – максимальное разведение контрольной сыворотки с положительным результатом. Неиммунными считаются лица с титром антитоксина менее 0,03 МЕ/мл. (1:20). РПГА с целью определения напряженности противоскарлатинозного антитоксического иммунитета ставят с анатоксином S. pyogenes, адсорбированным на поверхности эритроцитов. 35. Серодиагностика инфекционных заболеваний. Динамика образования антител, первичный и вторичный иммунный ответ. Отличие истинной от анамнестической реакции иммунитета. Диагностическая ценность определения нарастания титра антител и отдельных классов иммуноглобулинов. Способность к образованию антител появляется во внутриутробном периоде у 20-недельного эмбриона; после рождения начинается собственная продукция иммуноглобулинов, которая увеличивается до наступления зрелого возраста и несколько снижается к старости. Динамика образования антител имеет различный характер в зависимости от силы антигенного воздействия (дозы антигена), частоты воздействия антигена, состояния организма и его иммунной системы. При первичном и повторном введении антигена динамика антителообразования также различна и протекает в несколько стадий. Выделяют латентную, логарифмическую, стационарную фазу и фазу снижения. В латентной фазе происходят переработка и представление антигена иммунокомпетентным клеткам, размножение клона клеток, специализированного на выработку антител к данному антигену, начинается синтез антител. В этот период антитела в крови не обнаруживаются. Во время логарифмической фазы синтезированные антитела высвобождаются из плазмоцитов и поступают в лимфу и кровь. В стационарной фазе количество антител достигает максимума и стабилизируется, затем наступает фаза снижения уровня антител. При первичном введении антигена (первичный иммунный ответ) латентная фаза составляет 3—5 сут, логарифмическая — 7— 15 сут, стационарная — 15—30 сут и фаза снижения — 1—6 мес и более. Особенностью первичного иммунного ответа является то, что первоначально синтезируется IgM, а затем IgG. В отличие от первичного иммунного ответа при вторичном введении антигена (вторичный иммунный ответ) латентный период укорочен до нескольких часов или 1—2 сут, логарифмическая фаза характеризуется быстрым нарастанием и значительно более высоким уровнем антител, который в последующих фазах длительно удерживается и медленно, иногда в течение нескольких лет, снижается. При вторичном иммунном ответе в отличие от первичного синтезируются главным образом IgG. 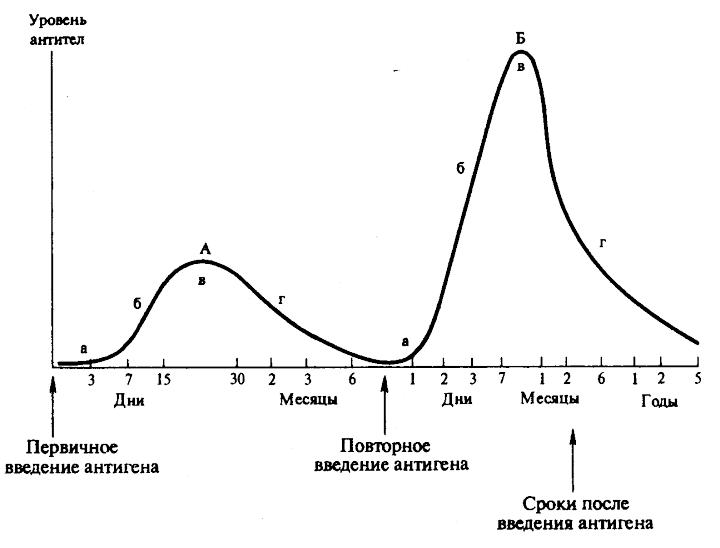 Существенное значение при проведении дифференциального диагноза результатов серологических реакций является нарастание титров антител в динамике. Диагностическое значение имеет нарастание величины титра антител в 4 раза и выше. Диагностическая ценность серологических исследований повышается при определении классов антител (IgM, IgG) к исследуемым возбудителям. Антитела класса IgM появляются в остром периоде инфекционного заболевания, а антитела класса IgG свидетельствуют о значительной продолжительности процесса. У детей первых месяцев жизни антитела IgG в крови чаще всего являются материнского происхождения. 36.Аллергический метод диагностики инфекционных заболеваний. Фазы, механизм, защитная и патогенетическая роль инфекционной аллергии(ГЧЗТ). Диагностические препараты для постановки кожно-аллергических проб (корпускулярные и растворимые) При многих инфекционных заболеваниях развивается состояние повышенной чувствительностик повторному введению возбудителя или продуктов его жизнедеятельности. Такое состояние, называемое инфекционной аллергией, характерно для туберкулеза, туляремии, бруцеллеза, сапа, сифилиса, сибирской язвы, токсоплазмоза, паротита, простого герпеса и ряда других инфекций. Для выявления инфекционной аллергии применяют аллергические диагностические пробы, для чего строго внутрикожно вводят соответствующий аллерген. Наличие гиперемии и инфильтрата указывает на положительный результат реакции, т. е. на наличие инфекционной аллергии. Аллергический метод диагностики основан на аллергической реакции – реакции гиперчувствительности замедленного типа (ГЗТ). В основе формирования реакции ГЗТ лежит не гуморальный, а клеточный иммунный ответ организма на первый (сенсибилизирующий) контакт с определенным антигеном. Сенсибилизация связана с преимущественной пролиферацией Т-лимфоцитов, несущих специфические для данного аллергена рецепторы. После этого в организме надолго сохраняется размножившийся клон сенсибилизированных Т-лимфоцитов, который вступает в реакцию с конкретным аллергеном при его повторном попадании в организм. Выявление клеточного иммунного ответа - гиперчувствительности замедленноготипа (ГЗТ), схема * Введение внутрикожно Аг бактерий * Через 48 – 72 часа появляется воспаление * Измеряют величину покраснения и папулы • Аг Тх выделяют лимфокины  активация Тцтл активация Тцтл активация фагоцитов активация фагоцитов  воспаление воспалениеВ реакциях ГЗТ участвуют: Т-хелперы (стимулируют образование Т-эффекторов через ИЛ-2) → Т-эффекторы (продуцируют лимфокины - хемоаттрактанты и привлекают макрофаги в очаг воспаления) → макрофаги (продуцируют медиаторы-монокины) →мононуклеарный инфильтрат на месте введения аллергена → величина инфильтрата зависит от степени сенсибилизации организма и достигает максимума через 24-48 ч. Аллергические диагностические пробы позволяют диагностировать туберкулез (реакция Манту), бруцеллез (проба Бюрне), туляремию (проба с тулярином), сибирскую язву (проба с антраксином), мягкий шанкр (реакция Дюкрея), проказу (реакция Мицуды), а последняя - даже дифференцировать туберкулоидную (лепромин-положительную) форму от лепроматозной (лепромин-отрицательной). Положительная кожная аллергическая проба указывает, что введение аллергена при постановке пробы является повторным, т. е. индивидуум в прошлом имел контакт с микробным агентом. Здесь сказывается основной недостаток диагностической ценности кожно-аллергических проб, так как они могут быть положительными не только у инфицированных, но и у привитых против этих болезней, а также у лиц, переболевших много лет назад, в том числе и у носителей, т. е. положительный тест у здоровых лиц указывает только на контакт с микробным антигеном. При определении природы заболевания истинное диагностическое значение имеет только переход от отрицательной кожной пробы к положительной, который наблюдается в течение болезни. Кроме того, вираж реакции, т. е. увеличение выраженности ее проявления при повторном исследовании, также служит основанием для более детального обследования на инфицированность данным возбудителем. Кожные аллергические пробы Применяются для выявления ГЗТ (инфекционной аллергии). ГЗТ – реакция, опосредованная Т-лимфоцитами играют важную роль в патогенезе многих инфекций (туберкулеза, лепры, бруцеллеза, сифилиса и др.). Для постановки аллергических проб применяются аллергены (корпускулярные и растворимые). Растворимые аллергены - отдельные фракции клеточной стенки, выделенные из микробов. Очищенный туберкулин (ППД - Л) – очищенный белок (низкомолекулярный белок) туберкулезной палочки. Применяется для выявления аллергии к возбудителю туберкулеза (проба Манту). Аллерген бруцеллезный (бруцеллин) – полисахаридно-белковый комплекс B. аbortus. Применяется для выявления аллергии к возбудителю бруцеллеза. Аллерген сибироязвенный (антраксин) – белковонуклиосахаридный комплекс. Применяется для выявления аллергии к возбудителю сибирской язвы. Корпускулярные аллергены (взвесь убитых микробов): Аллерген туляримийный (тулярин) применяется для выявления аллергии к возбудителю туляремии. Лепромин применяется для выявления аллергии к возбудителю лепры. Принцип метода: внутрикожно или накожно в ладонную поверхность предплечья вводится небольшое количество аллергена. При наличии инфекционной аллергии через 24-48-72 час. Развивается инфекционная аллергия в виде гиперемии, инфильтрата, отека кожи. 37. Особенности антибактериального иммунитета: неспецифические и специфические факторы. Иммунитет против внутриклеточных паразитов (иммунитет при туберкулезе, лепре, бруцеллезе, сифилисе и др.). Защитная роль антител. Антитоксический иммунитет. Механизмы нейтрализации экзотоксинов. Противобактериальный или, как его еще называют, антибактериальный иммунитет включает себя как специфические, так и неспецифические защитные факторы организма. Специфический ответ заключается в выработке противобактериальный антител. Противобактериальные антитела бывают двух видов – производство одних активизируется адгезинами (адгезины – вид молекул) бактерий, других токсинами, образующимися при жизнедеятельности бактерий. Первый вид связывается с бактериями, препятствуя прикреплению и проникновению в клетки организма, второй подавляет развитие патологических процессов, вызываемых токсинами. Оба вида относятся к иммуноглобулинам G и M. По уровню антибактериальных антител в составе крови пациента можно судить о силе противобактериального иммунного ответа. Неспецифическими факторами противобактериального иммунитета принято считать комплемент, фагоцитоз, лизоцим (фермент, разрушающий клеточную оболочку бактерии). Уровень бактерицидного действия крови напрямую зависит от степени активности этих факторов. Обнаружив в крови больного повышенную активность неспецифических противобактериальных факторов, врач может сделать благоприятный прогноз на выздоровление. Антитоксический иммунитет формируется при заболеваниях, возбудители которых продуцируют и выделяют в окружающую среду экзотоксины (возбудители дифтерии, ботулизма, столбняка, газовой раневой инфекции, стафилококки, стрептококки). В процессе эволюции макроорганизм при заражении токсигенными микробами выработал способность обезвреживать не только микробные клетки, но и их токсины. Обезвреживание экзотоксинов обуславливается антитоксинами в результате реакции нейтрализации. Антитоксичские сыворотки (дифтерийная, столбнячная, ботулиновая, газовогангренозная) применяются с лечебной целью при токсикоинфекциях. При введении антитоксических сывороток создается искусственный пассивный приобретенный иммунитет. Идентификация С.рerfringens по токсигенности в реакции нейтрализации токсина антитоксином (РН) на мышах РН токсина антитоксической сывороткой на животных основан на способности специфических антител антитоксинов подавлять биологическую активность бактериальных экзотоксинов. Компоненты: исследуемый материал (экзотоксин С.рerfringens); диагностические сыворотки с антитоксинами против С.рerfringens, C. novyi, C. septicum, C. histolyticum и др.; мыши – индикатор реакции. Диагностические сыворотки получают путем гипериммунизации кроликов анатоксинами - инактивированными эзотоксинами (формальдегидом), но сохранившими свои иммуногенные свойства, то есть способность индуцировать выроботку антител. Принцип метода. К диагностическим видоспецифическим антитоксическим сывороткам добавляют исследуемого токсина, выдерживают в течение определенного времени и вводят внутрикожно животным. Учет реакции проводится по живой мышке. С. рerfringensпродуцирует шесть типов экзотоксина, различающихся по антигенной структуре (А, В, С, D, Е, F). Идентифицируют их с помощью диагностических типоспецифических сывороток. 38. Особенности антивирусного иммунитета: неспецифические и специфические факторы. Особенность иммунологии вирусных инфекций обусловлена уникальными особенностями биологии их возбудителей, принадлежащих к агентам молекулярной неклеточной организации. Все вирусы представляют собой строгие внутриклеточные паразиты, отличающиеся механизмами репродукции и взаимодействия с чувствительными клетками от клеточных микроорганизмов. При вирусных инфекциях, как и при бактериальных, после переболевания в организме формируется иммунитет различной напряженности и длительности. Следует отметить, что при попадании вируса в организме не всегда происходят иммунологические реакции. В основе механизмов такой невосприимчивости (врожденного иммунитета — видового, наследственного, генетического) к определенным возбудителям лежит отсутствие в клетках рецепторов и субстратов, необходимых для взаимодействия вирусов, наличие веществ, блокирующих репродукции вирусов. Защитные приспособления, или факторы противовирусного иммунитета, подразделяют на неспецифические и специфические, которые разнообразны по своей природе и механизму действия. Неспецифический противовирусный иммунитет. Создание иммунитета обеспечивают факторы неспецифической защиты: 1) общие физиологические; 2) гуморальные; 3) клеточные. Перечисленные факторы обеспечивают защиту микроорганизма против вирусов на молекулярном, клеточном и организменном уровнях, которые неразрывно связаны между собой. Общие физиологические факторы. Для проникновения в восприимчивые клетки и ткани вирусу необходимо преодолеть защитные барьеры. Кожно-слизистые барьеры выдерживают первую атаку вирусов. Неповрежденные кожа и слизистая оболочка служат не только механической преградой, но и являются стерилизующим фактором. Если вирусы преодолели кожные и слизистые барьеры, то начинается их массивное проникновение в ткани. В инфицированный участок быстро прибывает огромная масса фагоцитов, и таким образом создается защитный вал вокруг воспалительного очага, при этом ограничивается распространение микробов в соседние ткани и кровь. В создании иммунитета участвуют и такие общефизиологические факторы, как температура тела и выделение вируса из организма различными секрециями. При повышении температуры тела усиливаются процессы иммуногенеза, ускоряется обмен веществ, усиливается продукция интерферона, что в совокупности способствует выздоровлению. Повышение температуры тела вызывает непосредственную инактивацию внеклеточного вируса и способствует подавлению репродукции внутри клетки. Выделение вирусов в окружающую среду с мочой и другими экскретами способствует более быстрому восстановлению относительного постоянства внутренней среды организма, нарушаемого вирусной инфекцией. Гуморальные факторы. Неспецифическую защиту организма обеспечивают пропердин, ингибиторы в сыворотке крови, гормоны. Пропердин (гамма-глобулин) содержится в нормальной сыворотке крови и принимает участие в нейтрализации вирусов. Активность проявляется за счет не самого пропердина, а системы пропердина (комплемента и двухвалентных ионов магния). Ингибиторы — это неспецифические противовирусные вещества белковой природы, которые присутствуют в нормальной сыворотке крови, секретах эпителия слизистых оболочек дыхательного и пищеварительного трактов, в экстрактах органов и тканей. Они обладают способностью подавлять активность вирусов вне чувствительной клетки: при нахождении вируса в крови и жидкостях. Ингибиторы подразделяют на термолабильные (теряют свою активность при прогревании сыворотки крови при 60...62 °С в течение 1 ч) и термостабильные (выдерживают нагревание до 100 °С). Ингибиторы обладают универсальной вируснейтрализующей активностью в отношении многих вирусов. Механизм действия ингибиторов заключается в соединении их с вирусами, вызывая нейтрализацию вирусных рецепторов, что выражается в понижении их физико-химических адсорбционных свойств. В результате вирусы теряют способность адсорбироваться на поверхности чувствительных клеток и проникать в них; вирусные частицы отторгаются с поверхности чувствительных клеток. Клеточные факторы. В неспецифическом противовирусном иммунитете участвуют фагоцитирующие клетки (микро- и макрофаги). Макрофаги — это полиморфная группа клеток, активно фагоцитирующих чужеродный материал, попавший в кровоток: моноциты крови, клетки костного мозга, купферовские клетки печени, гистиоциты, макрофаги селезенки, лимфатических узлов и серозных полостей. Фагоцитозу возбудителей макрофагами способствуют специфические антитела, оказывающие опсонирующие и агглютинирующие действия на вирусы. Кроме того, фагоциты являются продуцентами антител и интерферона. Роль лейкоцитов в противовирусном иммунитете малоэффективна (незначительна). Вирусы адсорбируются на лейкоцитах и поглощаются ими, но последующего разрушения их в клетках не происходит: весь процесс останавливается на стадии незавершенного фагоцитоза. Попытки в экспериментальных условиях перевести незавершенный фагоцитоз в завершенный не дали положительных результатов. Неспособность макрофагами переваривать вирусы — одна из основных особенностей механизма противовирусного и противобактериального иммунитета. Однако в противовирусном иммунитете фагоцитозу не отводится существенная роль. Подавление процесса репродукции одного вируса другим в живых клетках называется виругенией. Материальной основой служит особое вещество — интерферон, образующийся клеткой в ответ на проникновение в нее вируса. Его продуцируют практически все клетки организма, но наиболее активно клетки РЭС (особенно селезенки) и лейкоциты (макрофаги и лимфоциты). Образование интерферона в клетке обусловлено двумя моментами: устойчивостью клетки к вирусу и степенью вирулентности вируса. Если клетка устойчива к вирусу и вирус маловирулентный, то в клетке начинается синтез интерферона. Интерферон подавляет синтез вирусных нуклеаз и активирует синтез другого клеточного белка, обладающего антивирусной активностью. Причем местами такого действия интерферона могут быть вирусная информационная РНК или клеточные рибосомы. Но если клетка чувствительна к вирусу и последний достаточно вирулентен, то клетка синтезирует вирусные компоненты; начинается репродукция вирусных частиц. В отличие от антител интерферон обладает широким спектром антивирусного действия; предохраняет клетки от заражения не только гомологичным вирусом, но и гетерологичными вирусами. Интерферон адсорбируется другими клетками, и по мере наступления адсорбции развивается устойчивость клеток к заражению вирусом. Он не инактивирует внеклеточный вирус ин витро, что подтверждается сохранением инфекционности последнегопосле смешивания его с интерфероном, а также препятствует адсорбции вируса клеткой и лишь с наступлением интерференции предотвращает накопление вируса в клетке и развитие цитопати- ческого эффекта. При латентных инфекциях наступает равновесие между продукцией клетками вируса и интерферона. Внешне такие клетки не отличаются от здоровых. Таким образом, антивирусное действие интерферона сводится в конечном счете к превращению инфицированной клетки в систему, в которой репродукция вируса либо невозможна, либо подавлена. Специфический противовирусный иммунитет. Специфическая защита животных от вирусов осуществляется иммунной системой, которая обладает уникальной способностью распознавать множество разнообразных агентов (микроорганизмы, в том числе и вирусы, токсины и др.) — антигенов и вырабатывать в ответ на это распознавание специфические антитела и сенсибилизированные лимфоциты. Иммунные механизмы обеспечивают: 1) гуморальные факторы; 2) клеточные факторы. Специфические противовирусные антитела способны взаимодействовать только с внеклеточным вирусом, внутриклеточные структуры прижизненно для них недоступны. Антитела нейтрализуют вирусную частицу, препятствуя ее адсорбции на клетке-мишени, инфицированию и генерализации процесса, а также связывают вирусные белки и нуклеиновые кислоты, которые попадают в межклеточную среду и секреты после разрушения зараженных вирусами клеток. Образовавшиеся иммунные комплексы элиминируются путем иммунного фагоцитоза. Специфическое связывание антител с вирусными белками, экспрессированными на ЦПМ инфицированных клеток, индуцирует цитотоксическую активность естественных киллеров (см. гл. 11, разд. 11.3.1). Клетки, инфицированные вирусом и приступившие к его репликации, экспрессируют вирусные белки на цитоплазматической мембране в составе молекул антигенов гистосовместимости — МНС I класса (см. гл. 10, разд. 10.1.4.2). Это является сигналом для активации Т-киллеров, которые распознают зараженные вирусом клетки и уничтожают их (см. гл. 11, разд. 11.3.2). 39. Иммунобиологические препараты. Вакцины: живые, инактивированные (убитые), субклеточные и субвирионные (химические), анатоксины, синтетические, полусинтетические, рекомбинантные, ассоциированные вакцины (поливакцины и комбинированные) и др.; способы приготовления, достоинства, недостатки. Адъюванты. Иммунобиологические препараты имеют сложный состав, отличаются по своей природе, способам получения и применения, целевому назначению. Однако их объединяет то, что они действуют или на иммунную систему, или через иммунную систему, или же механизм их действия основан на иммунологических принципах. Действующим началом в ИБП являются или антигены, полученные тем или иным способом, или антитела, или микробные клетки и их дериваты, или биологически активные вещества типа иммуноцитокинов, иммунокомпетентные клетки и другие иммунореагенты. Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов. Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича). Инактивированные вакцины в качестве действующего начала включают убитые химическим или физическим методом культуры патогенных бактерий или вирусов (цельноклеточные, цельновирионные вакцины) Для инактивации бактерий и вирусов применяют формальдегид, спирт, фенол или температурное воздействие, ультрафиолетовое облучение, ионизирующую радиацию. Получают инактивированные вакцины путем выращивания на искусственных питательных средах патогенных бактерий или вирусов, которые затем подвергают инактивации, очистке, конструированию в виде жидкого или лиофильно высушенного препарата. В препарат обязательно добавляют консервант, иногда — адъюванты. Субклеточные и субвирионные вакцины состоят из антигенных комплексов, выделенных из бактерий или вирусов после их разрушения. Такие вакцины используют с применением адъюванта, чтобы замедлить всасывание из места введения. Для выделения из бактерий и вирусов антигенных комплексов (гликопротеинов, ЛПС, белков) применяют трихлоруксусную кислоту, фенол, ферменты, изоэлектрическое осаждение, ультрацентрифугирование, ультрафильтрацию, хроматографию и другие физические и химические методы. Анатоксины: дифтерийный, столбнячный, ботулинический (типов А, В, Е), гангренозный (перфрингенс, нови и др.), стафилококковый, холерный. Принцип получения анатоксинов состоит в том, что образующийся при культивировании соответствующих бактерий токсин в молекулярном виде превращают в нетоксичную, но сохраняющую специфическую антигенность форму — анатоксин путем воздействия 0,4% формальдегида и тепла (37 °С) в течение 3—4 недель. Полученный анатоксин подвергают очистке и концентрированию физическими и химическими методами для удаления балластных веществ, состоящих из продуктов бактерий и питательной среды, на которой они выращивались. К очищенному и концентрированному анатоксину для повышения его иммуногенности добавляют адъюванты. Синтетические вакцины Принцип конструирования вакцин включает синтез или выделение нуклеиновых кислот или полипептидных последовательностей, образующих Aг-детерминанты, распознаваемых нейтрализующими AT. Непременные компоненты таких вакцин — сам Аг, высокомолекулярный носитель (винилпирролидон или декстран) и адъювант (повышающий иммуногенность вакцин). Синтетические пептидные вакцины - это препараты, содержащие искусственно синтезированные короткие пептиды, имитирующие небольшие участки протективных антигенов вируса, способные вызывать специфический иммунный ответ организма и защитить его от конкретного заболевания. Идентификация основных антигеных детерминант протективных антигенов многих вирусов позволила синтезировать антигенноактивные пептиды. Полусинтетические вакцины представляют собой сложный комплекс, состоящий из антигена или его детерминанты, носителя в виде высокомолекулярного полимера и адъюванта. В настоящее время такие полусинтетические экспериментальные вакцины получены против гриппа, чумы, туляремии. Методом химического синтеза получены антигены ВИЧ, которые уже используются в диагностической системе «Рекомбинант ВИЧ». Рекомбинантные вакцины содержат Аг возбудителей, полученные с использованием методов генной инженерии, и включают только высокоиммуногенные компоненты, способствующие формированию защитного иммунитета. Возможны несколько вариантов создания генно-инженерных вакцин. • Внесение генов вирулентности в авирулентные или слабовирулентные микроорганизмы. • Внесение генов вирулентности в неродственные микроорганизмы с последующим выделением Аг и его использованием в качестве иммуногена. • Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин. Ряд современных противовирусных вакцин сконструирован путём введения генов, кодируюших основные Аг патогенных вирусов и бактерий в геном вируса осповакцины (HBsAg вируса гепатита В) и непатогенных для человека сальмонелл (HBsAg вируса гепатита В и Аг токсина столбнячной палочки). Другим примером служит введение генов возбудителя туберкулёза в вакцинный штамм БЦЖ, что придаёт ему большую активность в качестве дивергентной вакцины. Такие препараты известны как векторные вакцины. Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов и позволяющие проводить иммунизацию против нескольких инфекций одновременно. Если в препарат входят однородные антигены, то такую ассоциированную вакцину называют поливакциной. Если же ассоциированный препарат состоит из разнородных антигенов, то его целесообразно называть комбинированной вакциной. Они представляют собой препараты, состоящие из микробного антигенного компонента (обычно выделенного и очищенного или искусственно синтезированного антигена возбудителя) и синтетических полиионов (полиакриловая кислота и другие) - мощных стимуляторов иммунного ответа. Содержанием этих веществ они и отличаются от химических убитых вакцин. Примером поливакцины можно считать живую полиомиелитную поливакцину, содержащую аттенуированные штаммы вируса полиомиелита I, II, III типов. Примером комбинированной вакцины является АКДС, куда входят инактивированная корпускулярная коклюшная вакцина, дифтерийный и столбнячный анатоксин. Комбинированные вакцины применяются в сложной противоэпидемической обстановке. В основе их действия лежит способность иммунной системы отвечать на несколько антигенов одновременно. Под иммунологическими адъювантами подразумевают любые вещества, действующие неспецифически и повышающие специфический иммунный ответ на антигены. Поскольку многие вирусные вакцины (особенно компонентные) вызывают слабые иммунные реакции, стали использовать адъюванты, добавление которых дало возможность в различной степени возместить этот недостаток. Адъюванты функционируют как депо антигена, как иммуностимуляторы, и как иммуномодуляторы или как организаторы антигена в дискретные частицы. Многие адъюванты сочетают комбинированное действие двух и более из этих функций. Об иммуностимулирующей и иммуномодулирующей функции адъювантов свидетельствует повышение титра антител, возрастание активности Тц- и/или Тх-клеток. Различные цитокины действуют так же как адъюванты. 40. Календарь прививок
41.Лечебно-профилактические иммунные сыворотки антитоксические, антибактериальные, антивирусные) и иммуноглобулины (гомологичные и гетерогенные, нормальные и направленного действия); принципы получения, очистки и титрования). Лечебно-профилактические сыворотки применяют для создания пассивного искусственно приобретенного иммунитета и делят на противовирусные, антибактериальные и антитоксические. Преимущество сывороток перед вакцинами в том, что они сразу же после введения создают иммунитет (12 – 24 час). Недостаток– непродолжительный иммунитет, т.к. антитела - чужеродные белки, которые быстро (через 1 – 2 недели) выводятся из организма. Лечебно-профилактические сыворотки получают из крови гипериммунизированных животных (лошадей)и из крови людей (донорской, плацентарной, абортивной), переболевших или иммунизированных. Для получения антитоксических сывороток проводят гипериммунизацию (многократное введение) лошадей токсинами. Иммунизацию проводят подкожно или внутривенно возрастающими дозами антигена с определенными интервалами времени между инъекциями. Вначале вводят анатоксин, а через 4 – 5 дней – токсин. Антитоксические сыворотки используют для создания антитоксического иммунитета, т.е. для лечения и профилактики токсинемических инфекций (ботулизма, столбняка, газовой гангрены, дифтерии). Для получения антибактериальных сывороток проводят гипериммунизацию вакцинными штаммами бактерий или убитыми бактериями. Они содержат антитела с агглютинирующими и лизирующими свойствами. Это нетитруемые препараты. Малоэффективны. Для получения противовирусных сывороток проводят гипериммунизацию штаммами вирусов. Сыворотки очищают различными методами, концентрируют, стерилизуют и определяют ее активность (титр антител). Активность антитоксических сывороток выражают в Международных единицах (МЕ). Активность сыворотки отражает ее способность нейтрализовать определенную дозу токсина. Это условно взятая величина для каждого вида сыворотки. Например, для дифтерийной сыворотки 1 МЕ – это наименьшее количество сыворотки, которое нейтрализует 100 DLM дифтерийного токсина для морской свинки. Сыворотки представляют собой прозрачные жидкости, бледно- желтого цвета. Выпускают в ампулах. Сыворотки, так же, как и вакцины, после производства проходят государственный контроль в соответствии с инструкциями Министерства здравоохранения. Сыворотки контролируют на стерильность, безвредность, количество белка, прозрачность и активность (титр антител). Сыворотки вводят подкожно, внутримышечно, реже - внутривенно или в спинномозговой канал. Вводят сыворотки по методу Безредке для предупреждения анафилактического шока и сывороточной болезни. Из сывороток получают иммуноглобулины путем водно-спиртового извлечения (очистки). Иммуноглобулины – это очищенные и концентрированные иммунные сыворотки. Иммуноглобулины, как и иммунные сыворотки бывают гомологичными и гетерологичными. Гомологичные получают из крови людей, гетерологичные – из крови животных. Иммуноглобулины из крови человека бывают 2-х видов: 1) противокоревой (нормальный) иммуноглобулин – получают из донорской, плацентарной или абортивной крови здоровых людей, которая содержит антитела против вируса кори, вирусов гриппа, гепатита, полиомиелита, против коклюша и некоторых других бактериальных и вирусных инфекций; 2) иммуноглобулины направленного действия – получают из крови переболевших людей и добровольцев, которых иммунизируют против определенной инфекции; они содержат повышенные концентрации специфических антител и применяются с лечебной целью; получают иммуноглобулины направленного действия против гриппа, бешенства, оспы, клещевого энцефалита, столбняка и стафилококковых инфекций. Гетерологичные иммуноглобулины: иммуноглобулины лошадиные против бешенства (антирабический g-глобулин), клещевого энцефалита, лихорадки Эбола, японского энцефалита, сибирской язвы; иммуноглобулины из сыворотки крови волов для лечения лептоспироза. Гомологичные сывороточные препараты широко применяют для профилактики и лечения вирусного гепатита, кори, для лечения ботулизма, столбняка, стафилококковых инфекций, клещевого энцефалита, гепатита В. и др. Гетерологичные сыворотки – это лошадиные сыворотки против ботулизма, газовой гангрены, дифтерии, столбняка. Применение гомологичных сывороток и иммуноглобулинов предпочтительнее (лучше), так как антитела более длительно находятся в организме (4 – 5 недель) и не вызывают сильных побочных реакций, как гетерологичные. Гетерологичные препараты быстро выводятся из организма (через 1 – 2 недели) и вызывают побочные эффекты. Они имеют строго ограниченное применение из-за опасности аллергических осложнений. |
