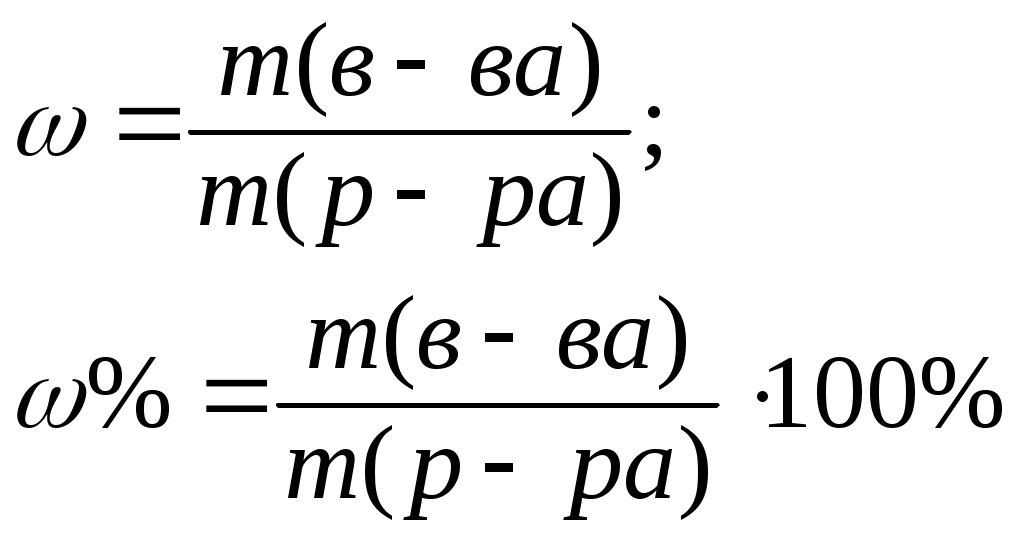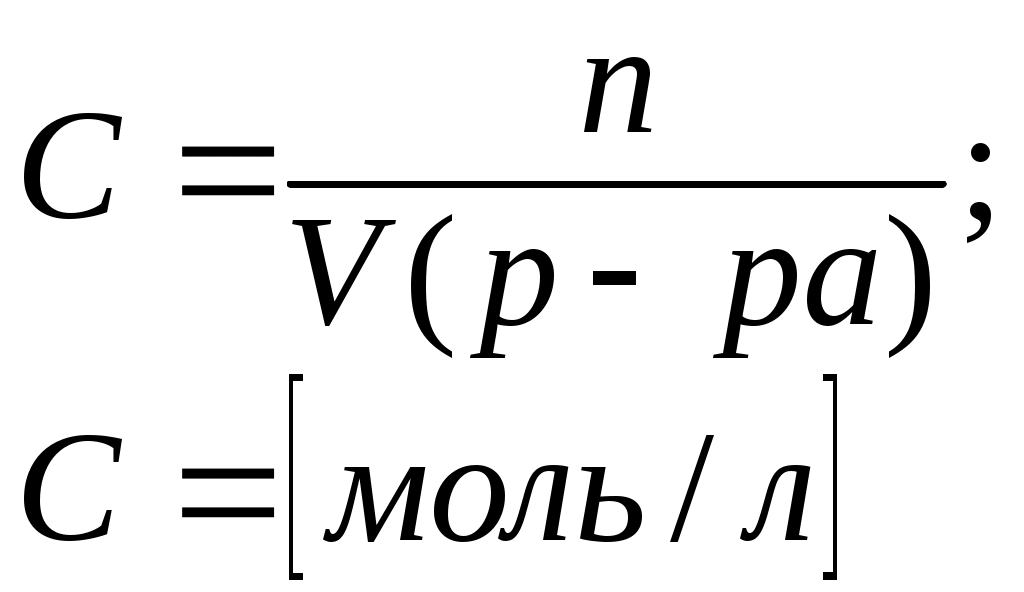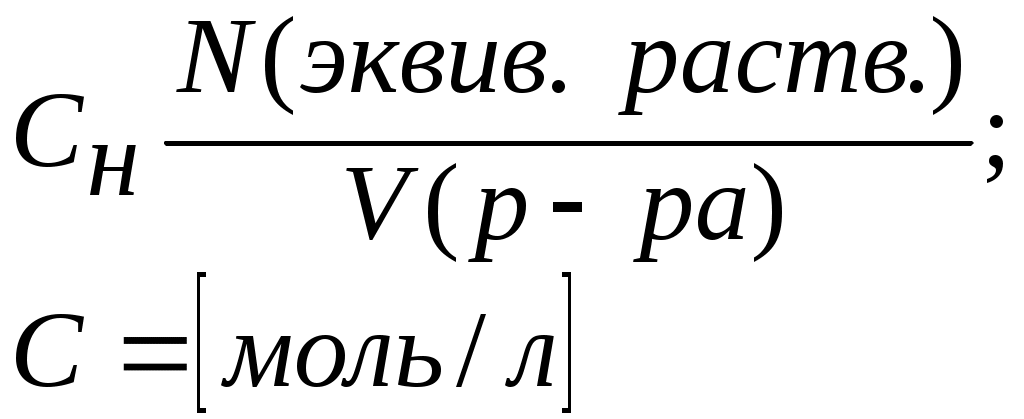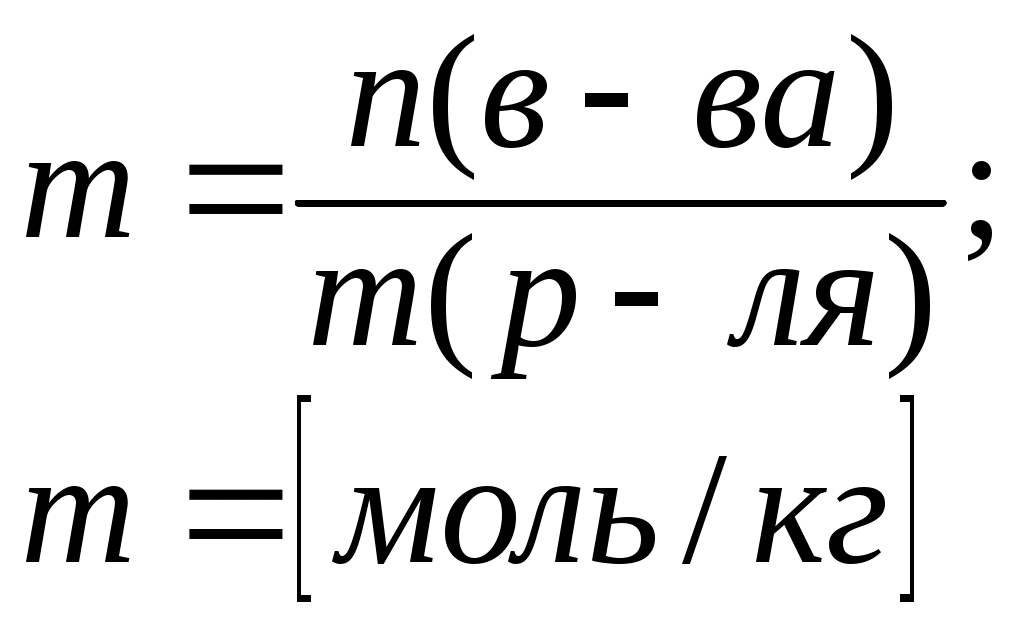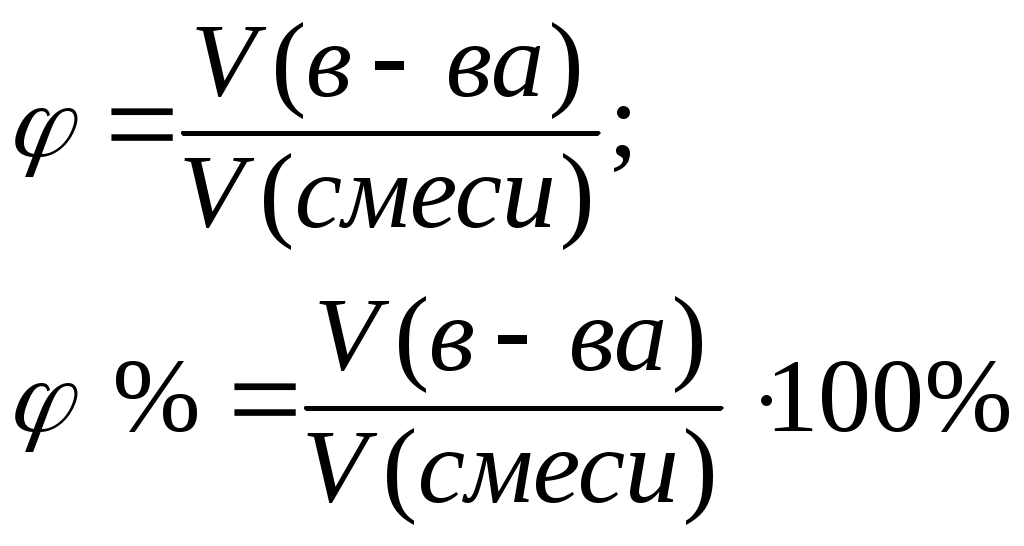элективный курс. Элективный курс по химии по теме Решение расчетных задач
 Скачать 332.5 Kb. Скачать 332.5 Kb.
|
1 2
Литература для учащихся 1. Габриелян О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И. Химия. 10 класс: Учеб. для общеобразовательных учреждений – М.: Дрофа, 2009. 2. Габриелян О. С., Лысова Г. Г. Химия. 11 класс: Учеб. для общеобразовательных учреждений – М.: Дрофа, 2009. 3. Егоров А. С. Самоучитель по решению химических задач (для учащихся и абитуриентов) – Ростов н/Д: Феникс, 2007. 4. Единый государственный экзамен 2007. Химия. Учебно-тренировочные задания для подготовки учащихся/ ФИПИ – М.: Интеллект-Центр, 2007. 5. Никитюк Т. В., Никитюк А. М., Остроумов И. Г. Химия. Тесты для повторения и подготовки – Саратов: Лицей, 2006. 6. Репетитор по химии /под ред. Егорова А. С./ – Ростов н/Д: Феникс, 2007. 7. Хомченко Г. П., Хомченко И. Г. Сборник задач и упражнений по химии для средней школы – М.: Новая волна, 2006. 8. Хомченко Г. П., Хомченко И. Г. Сборник задач по химии для поступающих в ВУЗы – М.: Новая волна, 2006. Литература для учителя 1. Артемов А. В. Школьные олимпиады. Химия. 8-11 классы – М.: Айрис-пресс, 2007. 2. Врублевский А. И. Задачи по химии с примерами решений для школьников и абитуриентов – Мн.: ООО «Юнипресс», 2006. 3. Врублевский А. И., Барковский Е. В. Задачи по органической химии с примерами решений для школьников и абитуриентов – Мн.: ООО «Юнипресс», 2005. 4. Выполнение заданий и решение задач повышенной сложности с комментариями и ответами для подготовки к единому государственному экзамену по химии (Алгоритмы выполнения заданий и способы решения задач)/ Сост. Денисова В. Г. – Волгоград: Учитель, 2004. 5. Дзуцова Д. Д. Окислительно-восстановительные реакции. – М.: Дрофа, 2005. 6. Кузьменко Н. Е., Еремин В. В. 2400 задач для школьников и поступающих в ВУЗы. – М.: Дрофа, 2008. 7. Кузьменко Н. Е. Начала химии. Современный курс для поступающих в ВУЗы. – М.: Экзамен. Оникс 21 век, 2009. 8. Новошинский И .Н., Новошинская Н. С. Типы химических задач и способы их решения. 8-11 классы. – М.: ООО Оникс. Мир и образование, 2008. 9. Рябов М. А. 375 проверочных заданий по химии для поступающих в ВУЗы. – М.: Компания «Евразийский регион». Российский Университет Дружбы Народов. Уникум-Центр, 2006. 10. Слета Л. А., Черный А. В., Холин Ю. В. 1001 задача по химии с ответами, указаниями, решениями. – М.: Илекса, 2005. Приложение 1 Алгоритм решения задач на вычисление массы (объема) продукта реакции, если одно из исходных веществ дано в избытке. Запись краткого условия задачи. Запись уравнения реакции. Надписание над формулами веществ в уравнении реакций данных условия задачи. Определение мольных отношений, мольных масс (М), масс веществ (m) и надписание их под формулами веществ, с которыми необходимо вести расчеты. Определение массы вещества, которое расходуется в реакции полностью, т.е. в недостатке. Определение массы, количества или объема искомого вещества. Запись ответа задачи. Алгоритм решения задач на вычисления, связанные с использованием понятия «выход продукта реакции». Запись краткого условия задачи. Запись уравнения реакции. Надписание над формулами веществ в уравнении реакций данных условия задачи. Определение мольных отношений, мольных масс (объемов) и масс (объемов) веществ и запись их под формулами веществ, с которыми необходимо вести расчеты. Определение теоретического выхода искомого вещества по уравнению реакции. Вычисление массовой доли практического выхода продукта в процентах то теоретически возможного. Запись ответа задачи. Алгоритм решения задач на вычисление массы (объема) продукта реакции, если исходное вещество содержит примеси. Запись краткого условия задачи. Определение массы чистого вещества, исходя из содержания массовой доли (%) примесей в исходном материале. Запись уравнения реакции. Надписание над формулами веществ в уравнении реакций данных условия задачи. Определение мольных отношений, мольных масс (М), масс веществ (m), молярных объемов (Vm) и объемов (V) и надписание их под формулами веществ, с которыми необходимо вести расчеты. Определение объема (или массы) искомого вещества. Запись ответа задачи. Алгоритм решения задач на нахождение молекулярной формулы вещества по относительной плотности и массовой доли элемента в соединении Запись краткого условия задачи. Нахождение относительной молекулярной массы искомого вещества. Нахождение простейшей формулы искомого вещества. Нахождение относительной молекулярной массы по простейшей формуле искомого вещества. Сравнение относительных молекулярных масс, найденных по истинной и простейшей формулам искомого вещества. Нахождение истинной формулы искомого вещества. Запись ответа задачи. Алгоритм решения задач на нахождение молекулярной формулы вещества по массе (объему) продуктов сгорания Запись краткого условия задачи. Нахождение относительной молекулярной массы искомого вещества. Нахождение массы искомого вещества. Нахождение масс элементов в исходном веществе. Определение, входит ли еще какой-либо элемент в состав искомого вещества. Если входит, то определяют его массу. Определение простейшей формулы искомого вещества. Нахождение истинной формулы искомого вещества. Запись ответа задачи. Приложение 2 (10-й класс) Решение задач по разделу 3: «Количественная характеристика растворов». СПРАВОЧНИК ФОРМУЛ ДЛЯ РЕШЕНИЯ ЗАДАЧ ПО ТЕМЕ «КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ»
Задача 1. Сероводород объемом 14 мл растворили в воде массой 500 г (н.у.). Вычислите массовую долю сероводорода в растворе. Решение. 1. Вычислим m (H2S) в 14 мл: 2. Вычислим массу раствора: m(p-p) = m(в-ва) + m(р-ля) = 500 + 0,0213 = 500,0213 г. 3. Вычислим массовую долю вещества в растворе: Ответ: 0,0000424. Задача 2. Рассчитайте мольные доли спирта и воды в 96%-ном растворе этилового спирта. Решение. 1. Вычислим количества вещества спирта и воды, содержащихся в 96%-ном растворе. 100 г р-ра содержит 96 г спирта и 4 г воды. N = m/M n (спирта) = 96/46 = 2,09 моль. n (воды) = 4/18 = 0,222 моль. 2. Вычислим мольную долю каждого вещества в растворе: N(x) = n(x)/(n(x) + n(s)) N (спирта) = 2,09/(2,09 + 0,222) = 0,9. N (воды) = 0,222/(2,09 + 0,2220 = 0,096. Ответ: 0,9; 0,096. Задача 3. В растворе объемом 500 мл содержится хлорид магния массой 9,5 г. Определите молярную и нормальную концентрации растворенного вещества. Решение: 1. Определим молярную концентрацию раствора: C(MgCl2) = 2. Для определения нормальной концентрации раствора необходимо определить молярную массу эквивалента соли: а затем нормальную концентрацию раствора: Ответ: С(MgCl2) = 0,2 М; Сэкв(MgCl2) = 0,4 н. Задача 4. Вычислите, какой объем раствора с массовой долей серной кислоты 70% ( = 1,622 г/мл) нужно взять для приготовления растворов объемом 25 мл с концентрацией H2SO4: а) 2 М; б) 2 н. Решение: 1. Находим массу серной кислоты, которая содржится в растворе объемом 25 мл с концентрацией 2 М H2SO4. Из формулы С(H2SO4) = 2. Вычисляем массу раствора с массовой долей серной кислоты 70%, в котором будет содержаться Из формулы 3. Определяем необходимый объем раствора: Задачу можно решить в одно действие. Из формулы 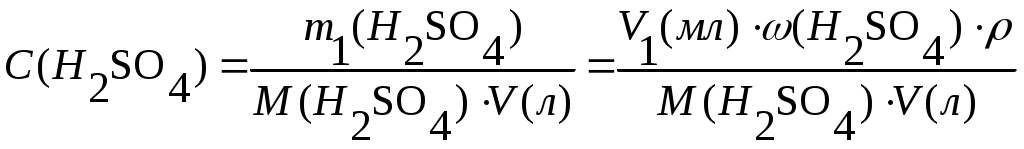 следует, что 4. Определяем необходимый объем раствора для приготовления 25 мл раствора с концентрацией 2 н. Из формулы 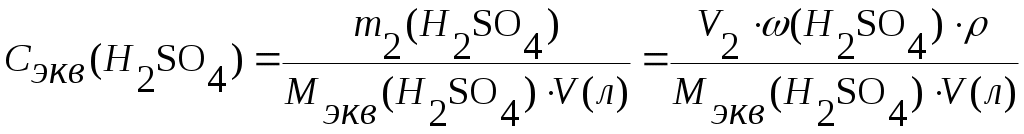 следует, что Ответ: V1 = 4,32 мл; V2 = 2,16 мл. Задача 5. Сколько граммов сульфата калия выпадет в осадок из 400 г раствора, насыщенного при 800С, при охлаждении его до 200С? Растворимость сульфата калия составляет 21,4 г при 800С и 11,1 при 200С. Решение. 1) Вычислим массу вещества в 400 г раствора при 800С. Растворимость показывает, какая максимальная масса вещества может быть растворена в 100 г растворителя. Таким образом, 121,4 г раствора содержат 21,4 г вещества; 400 г раствора содержат х г вещества. Х = 70,51 г. 2) Вычислим массу воды в исходном растворе. M(H2O) = m(р-ра) – m(в-ва) = 400 – 70,51 = 329,49 г. 3) Вычислим массу вещества в растворе, охлажденном до 200С. 100 г воды содержат 11,1 г вещества; 329,49 г воды содержат y г вещества. Y = 36,57 г. 4) Вычислим массу вещества, выпавшего в осадок. m(осадка) = m(в-ва)исх – m(в-ва)ост = 70,51 – 36,57 = 33,94 г. Ответ: 33,94 г. Приложение 3 (10-й класс) к занятию 31 «Решение контрольных задач по материалу курса». А-1 В результате реакции: 2C4H10(г) + 13O2(г)→ 8CO2(г) + 10H2O(г). Образовалось 5 моль оксида углерода (). Объем кислорода (н.у.), который потребуется для смешивания метана равен: 1) 180л 2)182л 3)212л 4)160л А-2 При взаимодействии16,25г цинка с разбавленной соляной кислотой выделится газ, объем которого (н.у.) равен 1) 5,6л 2) 8,4л 3) 11,2л 4) 16,8л А-3 Для полного гидрирования 10,5г пропена потребуется водород (н.у.) объемом: 1) 2,8л 2) 5,6л 3) 8,4л 4) 11,2л Часть В. В-1 Масса метилового эфира масляной кислоты, полученного при взаимодействии 48г метилового спирта и 100г 44% раствора масляной кислоты, равна ___ г. В-2 При действии избытка серной кислоты на 780г технического хлорида натрия, содержащего 25% примесей, выделится хлороводород объемом (н.у.) ___ л. В-3 Масса хлорида железа (), образующегося при взаимодействии 16г оксида железа () с 20г 73% раствора соляной кислоты, равна ___ г. часть С. С-1 Рассчитайте массовую долю серной кислоты в растворе, полученном при пропускании 2,24л (н.у.) сероводорода через 250г 10%-ного раствора сульфата меди. С-2 Гидрид кальция внесли в избыток раствора соляной кислоты (масса раствора кислоты 150г, массовая доля HCl 20%). При этом выделилось 6,72л (н.у.) водорода. Рассчитайте массовую долю хлорида кальция в полученном растворе. Критерии оценивания. Оценка “3” – выполнено 2 задания из части А. Оценка “4” – выполнено 1 задание из части А и одно из части В Оценка “5” – выполнено 1 задание из части С или два задания из части В Приложение 4 (11-й класс к занятиям 31-33разделу 5: «Решение комбинированных и усложненных задач по химии» Задача № 1 Вычислите массу метилового эфира масляной кислоты, полученного при взаимодействии 48 г. метилового спирта и 100 г. 44 % раствора масляной кислоты. Д  ано: Решение: ано: Решение: m(CH3OH)=48г 1.5 моль 0.5 моль 0.5 моль mр-ра(C3H7COOH)=100г CH3OH+C3H7COOH→C3H7-C-O-О-CH3+H2O ω%(C3H7COOH)=44% 1 моль 1 моль  m(эфира) - ? m(эфира) - ?mр-ра(C3H7COOH)→m(C3H7COOH)→ n(C3H7COOH) n(эфира)→m(эфира) (CH3OH)→n(CH3OH) n(CH3OH) = m/M=48/32 = 1,5моль-избыток M(CH3OH) = 12+4+16 = 32 г/моль m(C3H7COOH) = mр-ра* ω%(C3H7COOH)/100% = = 100*44/100 = 44г n(C3H7COOH) = m/M = 44/88 = 0,5 моль M (C3H7COOH) = 12•4+8+16•2 = 88 г/моль n(эфира) = 0,5моль M (эфира) = 102г/моль m(эфира) = 102г/моль•0,5моль = 51г Ответ:m(эфира) = 51г. Задача № 2 Рассчитайте массовую долю серной кислоты в растворе, полученном при пропускании 2,24л (н.у.).сероводорода через 250г 10% раствора сульфата меди. Д  ано: Решение: ано: Решение:V(H2S)=2,24л СuSO4+H2S = CuS↓+H2SO4 mр-ра(СuSO4)=250г 1моль 1моль 1моль ω  %(СuSO4)=10% V(H2S)→n(H2S) %(СuSO4)=10% V(H2S)→n(H2S) n(H2SO4)→m(H2SO4)→ω%(H2SO4)  mр-ра(CuSO4)→m(CuSO4)→n (CuSO4) mр-ра(CuSO4)→m(CuSO4)→n (CuSO4)ω%(H2SO4)-? n(H2S)=2,24/22,4=0,1моль m(CuSO4)=250•10/100=25г n (CuSO4)=m/M=25/160=0,156моль-избыток M(CuSO4)=160г/моль n (H2SO4)=n(H2S)=0,1моль m (H2SO4)=n•M = 0,1•98=9,8г M(H2SO4)=98г/моль ω% (H2SO4)=m(H2SO4)/mр-ра•100% mр-ра2=mр-ра(H2SO4)+m(H2S)-m(CuS) n(CuS)=n(H2S)=0,1моль m(СuS)=0,1•96=9,6г M(CuS)=96г/моль m(H2S)=n•M=0.1•34=3,4г mр-ра2=250+3,4-9,6=243,8г ω% (H2SO4)=9,8/243,8=4% Ответ: ω% (H2SO4)= 4% Задача № 3 Напишите уравнения реакций, соответствующие следующей последовательности превращений: 1       ). КАlО2 X1 2). Fe(OH)3 X1 ). КАlО2 X1 2). Fe(OH)3 X1  Х2 А1(ОН)3 Х2 FeS Х2 А1(ОН)3 Х2 FeSНазовите неизвестные вещества. Решение: 1) Алюминат калия КАlO2 взаимодействует с кислотой НС1 с образованием хлоридов калия и алюминия. При их обработке расчетным количеством щелочи осаждается гидроксид алюминия, который растворяется в избытке КОН. Если отфильтровать и прокалить тетрагидроксоалюминат КА1(ОН)4, получается исходный КАlO2. КА1О2 + 4НС1 = КС1 +А1С13 + 2Н20; А1С13 + ЗКОН = А1(ОН)3 + ЗКС1; А1(ОН)3 + КОН = КА1(ОН)4; КА1(ОН)4 = КАlO2 + 2Н2О (прокаливание). 2) Гидроксид железа (III) при прокаливании с углем восстанавливается до металлического железа. Железо при нагревании с серой образует сульфид железа (II). Этот сульфид разлагается соляной кислотой с образованием хлорида двухвалентного железа. Едкие щелочи в отсутствие воздуха осаждают из раствора раствора хлорида железа(II) гидроксид железа (II) , который быстро окисляется на воздухе в гидроксид Fe(OH)3. 2Fe(OH)3 + 2С = 2Fe + CO2 + СО + ЗН2О, X1 = Fe; Fe + S = FeS; FeS + 2HC1 = FeCl2 + H2S, X2 = FeCl2; 4FeCl2 + 8NaOH + O2 + 2H2O = 4Fe(OH)3 + 8NaCl. F  e2+ - e —> Fe3+ 4 e2+ - e —> Fe3+ 4O2 + 2H2O + 4e —> 40Н-- 1 Задача № 4 Определите массу кристаллогидрата Cr2(SO4)3 *18 H2O и раствора с массовой долей Cr2(SO4)3 0,15, которые надо взять для приготовления раствора с массовой долей Cr2(SO4)3 0,2 и массой 795г. Решение: для решения задачи можно использовать правило смешения. Выбираем для расчетов образец кристаллогидрата кол-вом в-ва 1 моль. Из формулы кристаллогидрата следует: V (Cr2 (SO4)3) =V (Cr2(SO4)3 * 18 H2O)= 1моль, М (Cr2(SO4)3)=V * М=392г М (Cr2(SO4)3)=52*2+3*32+12*16=104+96+192=392г/моль М (Cr2(SO4)3 * 18 H2O)= V * М=716гМ(Cr2(SO4)3 * 18 H2O)=392+324=716 г/мольОпределяем W(Cr2(SO4)3) в кристаллогидрате W(Cr2(SO4)3)= М (Cr2(SO4)3) = 392г =0,547 М (Cr2(SO4)3 * 18 H2O) 716г 0 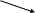 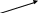 ,547 0,05 ,547 0,05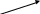 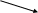 0,2 0,20,15 0,347 Относительная масса кристаллогидрата равна 0,05 из общей относительной массы: Мр-ра(Cr2(SO4)3*18 H2O)=(М 0,5)/0,397=(795 0,5)/0,397=695г. Ответ: Мр-ра(Cr2(SO4)3*18 H2O)=695 г. 1 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||