Электрофорез и ультрацентрифугирование как методы исследования белков и нуклеиновых кислот
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
| Методы исследования | Признак, свойство белка, используемые для выделения, разделения, очистки |
| Электрофорез Ионообменная хроматография | Знак и величина заряда |
| Электрофорез в полиакриламидном геле | Величина заряда и молекулярная масса белков |
| Изоэлектрофокусирование | Изоэлектрические точки белков в градиенте рН |
| Высаливание Диализ Гель-хроматография Ультрацентрифугирование Ультрафильтрация | Размеры белка |
| Адсорбционная хроматография | Сродство белков к неполярному адсорбенту |
Таблица 1.Основные методы исследования белка .
Глава 2.Центрифугирование.
Разделение веществ с помощью центрифугирования основано на разном поведении частиц в центробежном поле. Суспензию частиц, помещённую в пробирку, загружают в ротор, установленный на валу привода центрифуги. В центробежном поле частицы, имеющие разную плотность, форму и размеры, осаждаются с разной скоростью.
а. Препаративное центрифугирование.
Препаративное центрифугирование заключается в выделении биологического материала для последующих биохимических исследований. При этом можно брать большие количества исходного биологического материала, например посевы микробных клеток из периодических и непрерывных культур, а также посевы растительных и животных клеток из культур ткани и плазмы крови. С помощью препаративного центрифугирования выделяют большое количество клеточных частиц для изучения их морфологии, структуры и биологической активности. Методы применяются также для выделения таких биологических молекул, как ДНК и белки из предварительно очищенных препаратов.
б. Ультрацентрифугирование
Ультрацентрифугирование используется для разделения и очистки белков.
Метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия). Скорость седиментации является функцией размера и формы молекулы и постоянна для конкретного вещества. Она также зависит от плотности частиц растворенного вещества и растворителя. Ускорение, с которым движется частица при центрифугировании, выражается формулой
| G = ω ⋅ 2 ⋅ r, |
где ω — угловая скорость; r — расстояние от оси вращения до частицы.
Константа седиментации выражается в единицах Сведберга (S)*, по фамилии шведского ученого — разработчика этого метода. При центрифугировании в градиенте плотности вначале пробирку заполняют раствором сахарозы, концентрация которого линейно увеличивается от 5 % у верхнего края пробирки до 20 % у ее нижнего края. При центрифугировании частицы оседают с разной скоростью, в результате происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой
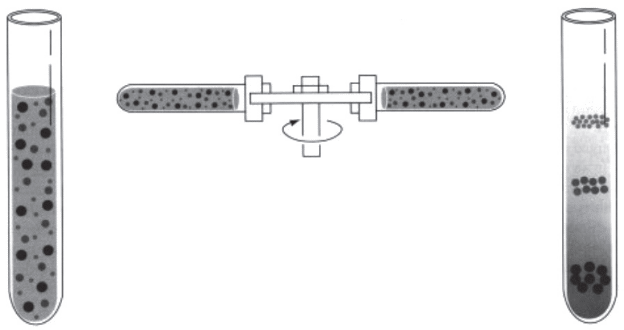
Рисунок 1.Разделение белков методом ультрацентрифугирования:
а)однородная смесь образца и вещества, формирующего градиент; б)центрифугирование; в )сформированный градиент и полосы разделенных молекул
В пробирке обычно прокалывают дно и собирают вытекающую по каплям жидкость при помощи коллектора. Полученные фракции можно сразу или после предварительной очистки использовать для дальнейших исследований.
в. Зонально-скоростное центрифугирование.
Этот метод, называемый ещё s-зональным центрифугированием, заключается в наслаивании исследуемого образца на поверхность раствора с непрерывным градиентом плотности. Затем образец центрифугируют до тех пор, пока частицы не распределятся вдоль градиента в виде дискретных зон или полос. Благодаря созданию градиента плотности удаётся избежать смешивания зон, возникающего в результате конвекции. Этот метод применяется для разделения гибридов РНК-ДНК, субъединиц рибосом и других клеточных компонентов.
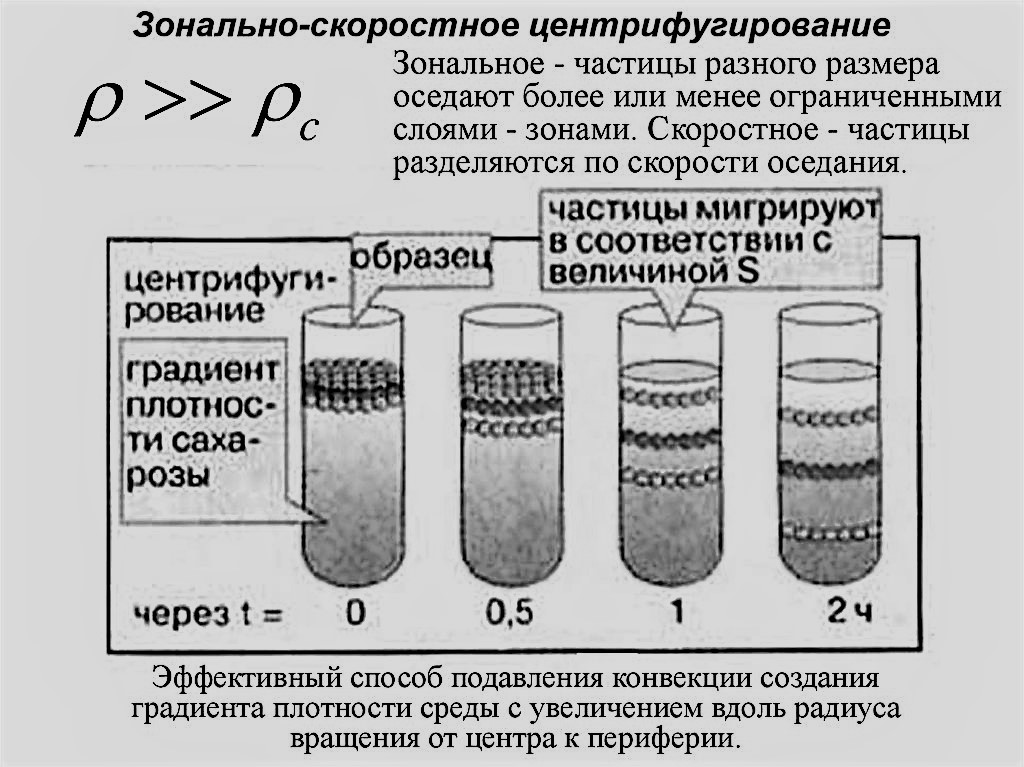
Рисунок 2. Зонально-скоростное центрифугирование.
г. Равновесное центрифугирование в градиенте плотности.
Для создания градиента плотности используют соли тяжёлых металлов, например, рубидия или цезия, а также растворы сахарозы. Образец, например, ДНК, смешивают с концентрированным раствором хлористого цезия. И растворённое вещество (ДНК), и растворитель сначала распределяют по всему объёму равномерно. В ходе центрифугирования устанавливается равновесное распределение концентрации, а, следовательно, и плотности CsCl, так как ионы цезия обладают большой массой. Под действием центробежного ускорения молекулы ДНК распределяются, собираясь в виде отдельной зоны в части пробирки с соответствующей им плотностью. Метод применяется главным образом в аналитическом центрифугировании, и был использован Нельсоном и Сталем для изучения механизма репликации ДНК E.coli. равновесное центрифугирование в градиенте плотности является также методом разделения и изучения липопротеидов плазмы крови человека.
д. Аналитическое центрифугирование
Применяется главным образом для изучения чистых или практически чистых препаратов макромолекул или частиц, например рибосом. В данном случае используется небольшое количество материала, а седиментация исследуемых частиц непрерывно регистрируется с помощью специальных оптических систем.
Метод позволяет получить данные о чистоте, молекулярном весе и структуре материала. Не смотря на то, что в основе, препаративного и аналитического центрифугирования, лежат общие принципы, в практикуме препаративное центрифугирование применяется чаще, чем аналитическое.
В отличие от препаративного центрифугирования, целью которого является разделение веществ и их очистка, аналитическое ультрацентрифугирование применяется в основном для изучения седиментационных свойств биологических макромоекул и других структур. Поэтому в аналитическом центрифугировании применяют роторы и регистрирующие системы особой конструкции: они позволяют непрерывно наблюдать за седиментации материала центробежном поле.
Аналитические ультрацентрифуги могут развивать скорость до 70000 об/мин -1, создавая при этом центробежное ускорение до 500000g. Ротор у них, как правило, имеет форму эллипсоида и соединён посредством струны с мотором, что позволяет варьировать скорость вращения ротора. Вращается ротор в вакуумной камере, снабженной холодильным устройством, и имеет две ячейки, аналитическую и балансировочную, которые устанавливаются в центрифуге строго вертикально, параллельно оси вращения. Балансировочная ячейка служит для уравновешивания аналитической и представляет собой металлический блок с прецизионной системой. В ней имеются также индексные отверстия, находящиеся на строго определённом расстоянии от оси вращения , с помощью которых определяют соответствующие расстояния в аналитической ячейке. Аналитическая ячейка, ёмкость которой, как правило, равна 1 см3, имеет секториальную форму. При правильной установке в роторе она, несмотря на то что стоит вертикально, работает по тому же принципу, что и ротор с подвесными стаканами, создавая почти идеальные условия седиментации. На торцах аналитической ячейки имеются окошки с кварцевыми стёклами. Аналитические ультрацентрифуги снабжены оптическими системами, позволяющими наблюдать за седиментацией частиц в течение всего периода центрифугирования. Через заданные промежутки времени седиментирующий материал можно фотографировать. При фракционировании белков и ДНК за седиментацией наблюдают по поглощению в ультрафиолете, а в тех случаях, когда исследуемые растворы имеют разные коэффициенты преломления – с помощью шлирен-системы или интерференционной системы Рэлея. Два последних метода основаны на том, что при прохождении света через прозрачный раствор, состоящий из зон с различной плотностью, на границе зон происходит преломление света. При седиментации между зонами с тяжелыми и лёгкими частицами образуется граница, которая действует как преломляющая линза; при этом на фотопластинке, использующейся в качестве детектора, появляется пик. В ходе седиментации происходит перемещение границ, а следовательно, и пика, по скорости передвижения которого можно судить о скорости седиментации материала. Интерферометрические системы отличаются большей чувствительностью, чем шлирен-системы. Аналитические ячейки бывают односекторные, которые применяют наиболее часто, и двухсекторные, которые используются для сравнительного изучения растворителя и растворённого вещества.
Применение аналитического ультрацентрифугирования
1.Оценка чистоты препаратов.
Аналитическое ультрацентрифугирование широко применяется для оценки чистоты препаратов ДНК, вирусов и белков. Чистота препаратов несомненно очень важна в тех случаях, когда требуется точно определить молекулярный вес молекулы. В большинстве случаев о гомогенности препарата можно судить по характеру границы седиментации, используя метод определения скорости седиментации: гомогенный препарат обычно дает одну резкоочерченную границу. Присутствующие в препарате примеси проявляются в виде дополнительного пика или плеча; они же обусловливают асимметрию основного пика.
2.Исследование конформационных изменений в макромолекулах.
Ещё одна область применения аналитического ультрацентрифугирования исследование конформационных изменений макромолекул. Молекула ДНК, например, может быть одно- или двухцепочечной, линейной или кольцевой. Под действием различных соединений (таких, например, как органические растворители) или при повышенных температурах ДНК претерпевает ряд обратимых и необратимых конформационных изменений, которые можно установить по изменению скорости седиментации образца. Чем компактнее молекула, тем меньше её коэффициент трения в растворе и наоборот: чем меньше она компактна, тем больше коэффициент трения и следовательно, тем медленнее будет она седиментировать. Таким образом, различия в скорости седиментации образца до и после различных воздействий на него позволяют обнаруживать конформационные изменения, происходящие в макромолекулах.
У аллостерических белков, таких, например, как аспартаттранскарбамоилаза, конформационные изменения возникают в результате связывания их с субстратом и (или) малыми лигандами (активаторами или ингибиторами). Диссоциацию белка на субъединицы (протомеры) можно вызывать, обработав его такими веществами, как мочевина парахлормеркурибензоат. Все эти изменения легко можно проследить при помощи аналитического ультрацентрифугирования.
Глава 3.1.Электрофорез
Этот метод впервые предложил шведский ученый А. Тизелиус .Он основан на движении заряженных частиц через электролит при воздействии электрического поля. Положительно заряженные частицы (катионы) движутся к катоду, отрицательно заряженные частицы (анионы) к аноду.
Факторы, влияющие на электрофорез:
Разделение белков (частиц) при электрофорезе зависит от следующих
факторов:
1)суммарный заряд частиц (ИЭТ-белков);
2) масса и форма частиц;
3) рН среды (выбирая pH буферного раствора, можно управлять характе-
ром распределения белков в электрическом поле; как правило, рН буферного
раствора выбирается так, чтобы разделяемые молекулы несли отрицательный
заряд и двигались в электрическом поле слева направо);
4)сила электрического поля;
5)свойства поддерживающей среды;
6) температура.
Вначале разделение белков проводили методом электрофореза в буферном растворе, а затем большее распространение получил электрофорез на носителях. Носителями для электрофореза выступают фильтровальная бумага, мембраны из ацетата целлюлозы, агароза, полиакриламидный гель.
Электрофорез на бумаге проводят в течение 16–18 ч при низком напряжении. Диффузия частиц, приводящая к размыванию краев фракций, и длительность проведения являются недостатками этого метода.
В последнее время предпочтительной твердой поддерживающей средой для электрофореза по горизонтали считаются мембранные полоски из ацетата целлюлозы. В этом случае процесс занимает менее 1 ч, при этом достигается хорошее разделение без диффузии. Полоски из ацетата целлюлозы широко используются для разделения и идентификации липопротеинов, изоферментов и гемоглобина.
Агар, или агароза — это гетерогенный полисахарид. При нагревании образует вязкую жидкость, затвердевающую в гель при охлаждении. Агаровый гель используется для разделения различных видов белковых смесей, а такженуклеиновых кислот.
Полиакриламидный гель (ПААГ) обладает эффектом молекулярного сита и тем самым делает разделение очень эффективным. Например, если при электрофорезе в геле агарозы белки сыворотки разделяются на 5 фракций, то при разделении тех же белков в ПААГ можно получить более 20 фракций. Поскольку разделяемые молекулы движутся в геле, те из них, которые имеют большие размеры, будут задерживаться при прохождении через его поры. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате после проведения электрофореза большие молекулы будут находиться ближе к месту нанесения, чем меньшие. Следует иметь в виду, что этот метод позволяет разделять молекулы большей частью по размеру, но необязательно по молекулярной массе.
Вариант электрофореза в полиакриламидном геле в присутствии додецил (лаурил) сульфата натрия (ДСН-ПААГ) основан на разделении белков в электрическом поле в зависимости от их молекулярной массы. Обычно скорость миграции анализируемых белков зависит от суммарного заряда, величины и формы молекул. Как известно, все белки обладают вторичной и третичной структурой. При этом их молекулы не всегда несут отрицательный заряд в растворе. Чтобы устранить влияние различий в форме и оставить только различия в молекулярной массе, разделяемые молекулы должны иметь развернутую конформацию. Для разрушения вторичной и третичной структуры и образования на поверхности белков отрицательного заряда их кипятят в течение 5 мин в буферном растворе, содержащем додецилсульфат натрия и β-меркаптоэтанол. Додецилсульфат натрия (ДСН) является дифильным веществом (детергентом), содержащим полярную заряженную группу и гидрофобную часть молекулы.
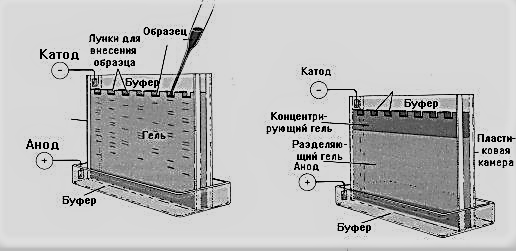
Рисунок 3. Разделение белков методом электрофореза в геле.
Белки с четвертичной структурой при этих условиях распадаются на субъединицы. ДСН прочно связывается с гидрофобными радикалами белка, а меркаптоэтанол восстанавливает дисульфидные связи, стабилизирующие третичную структуру в белках. Таким образом, каждый белок полностью денатурируется и формирует линейную структуру (белки выравниваются по форме) с серией отрицательных зарядов, образуемых при помощи ДСН вдоль полипептидной цепи (белки выравниваются по заряду). Такой отрицательно заряженный комплекс ДСН-белок мигрирует через пористый гель полиакриламида (Рисунок 3)
Поскольку скорость передвижения в этих условияхтем выше, чем меньше размеры полипептида, метод находит широкое применение для определения молекулярной массы белка с помощью калибровочной кривой. Для построения калибровочного графика используют белки-стандарты с известными молекулярными массами. Их наносят рядом с опытными пробами, что позволяет установить графическую зависимость между пробегом молекул на электрофореграмме и их молекулярной массой.
Глава 3.2.Двумерный электрофорез
Двумерный электрофорез представляет собой метод разделения смеси белков, основанный на последовательном использовании двух свойств белков: заряда и молекулярной массы. Использование таких не связанных между собой свойств белков необходимо, чтобы разделение смеси было максимальным. Вначале смесь белков разделяют методом изоэлектрофокусирования. Затем полученный гель помещают горизонтально вдоль края нового геля, содержащего додецилсульфат натрия, и проводят электрофорез во втором направлении, при этом белки разделяются по молекулярной массе.(Рисунок 4)
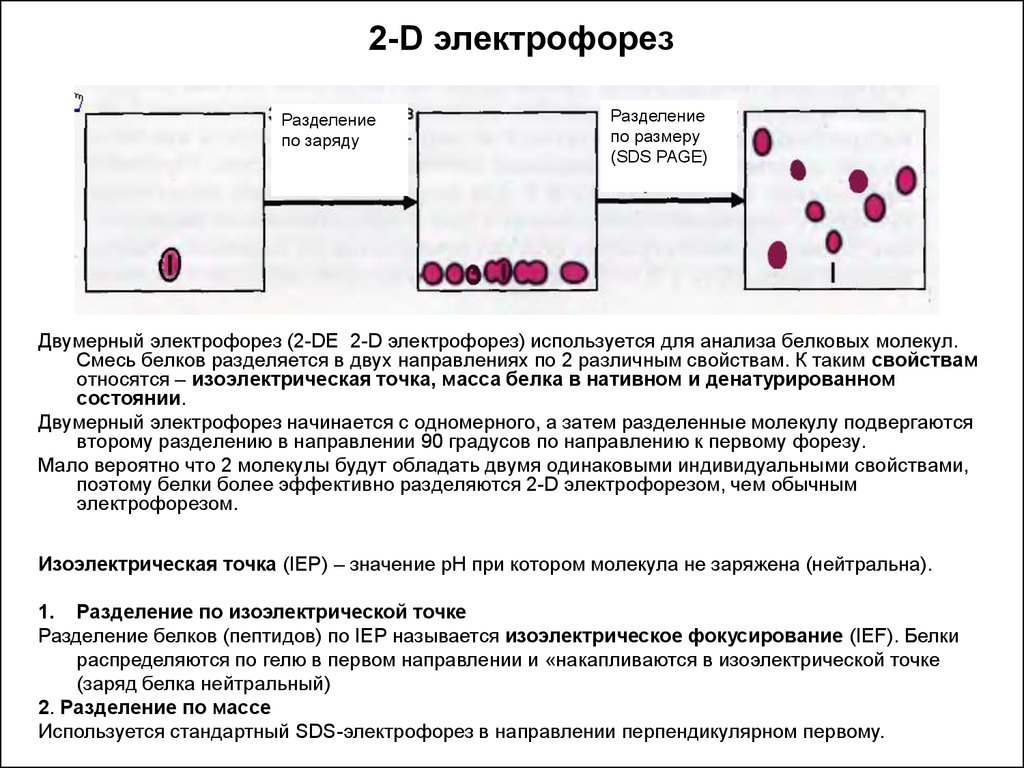
Рисунок 4.Двумерный электрофорез.
Глава 3.3 Система электрофореза на микрочипе MultiNA для исследования нуклеиновых кислот
Сочетание технологии электрофореза на микрочипе, автоматизированной пробоподготовки и чувствительного флуориметрического детектирования предлагает высокоэффективную замену традиционному агарозному гель-электрофорезу. Качественный и количественный анализ нуклеиновых кислот становится теперь как никогда быстрым, недорогим и высокоточным. В настоящее время при проведении исследований нуклеиновых кислот основным методом изучения распределения фрагментов ДНК и РНК по молекулярной массе (размеру) остается агарозный гель-электрофорез. К основным недостаткам этого метода следует отнести достаточно высокую стоимость анализа при использовании готовых пластин геля, высокую трудоемкость, связанную с большим количеством ручных операций, длительность анализа, необходимость использования дополнительного весьма дорогостоящего оборудования для визуализации и последующей цифровой обработки электрофореграмм, использование небезопасных для здоровья реагентов (бромистого этидия). Всех этих недостатков лишена последняя разработка компании Shimadzu – прибор для электрофоретического разделения нуклеиновых кислот с использованием микрочипа MCE®-202 MultiNA.
Основные преимущества системы электрофореза на микрочипе:
Низкая стоимость анализа. Конструкция и материал микрочипа позволяют использовать его для нескольких тысяч анализов, при этом используется крайне незначительное количество расходных материалов. Тем самым достигается существенное снижение стоимости (в 1,5 – 3 раза) одного анализа ДНК по сравнению с агарозным гель-электрофорезом. Если сравнивать систему электрофореза на микрочипе с существующими сейчас на рынке системами капиллярного электрофореза, то снижение стоимости анализа может достигать 6 и более раз. В случае анализа РНК экономия может быть еще более существенной (рассчитано, исходя из стоимости оборудования и реагентов на японском рынке).
Высокая скорость анализа. Высокоскоростной автоматизированный анализ до 108 образцов (96 + 12 дополнительно). С использованием одного микрочипа полный цикл анализа ДНК составляет 255 секунд. Для увеличения производительности в прибор может быть установлено до четырех микрочипов для параллельной работы. В этом случае время одного анализа сокращается до 75 секунд.
Высокая чувствительность. Флуориметрический детектор с фотоумножителем и источником возбуждения флуоресценции на основе светодиода обеспечивает примерно 10-кратное увеличение чувствительности по сравнению с традиционным окрашиванием бромистым этидием (данные получены в ходе внутренних испытаний в лаборатории Shimadzu). К тому же используемые флуоресцентные красители, такие как SYBR green II и SYBR gold, абсолютно безвредны для здоровья в отличие от бромистого этидия.
Микрочип MultiNA
Микрочип, изготовленный из кварца высокой чистоты, включает микроемкости для загрузки образца и реагентов и электрофоретический канал 23 × 0,09 × 0,05 мм (д ×ш × г). Напряжение подается при помощи напыленных платиновых электродов. Канал и микроемкости выполнены с высочайшей точностью при помощи уникальной фотолитографической технологии Shimadzu. Специальное покрытие обеспечивает возможность многократного использования одного и того же микрочипа ( 3600 анализов). Следствием малой длины электрофоретического канала и его оптимальной формы является непревзойденная на сегодняшний день скорость электрофоретического разделения нуклеиновых кислот. Наборы реагентов для анализа ДНК и РНК. Прибор может комплектоваться тремя наборами реагентов для анализа ДНК различного размера и набором реагентов для анализа РНК.
Заключение
Итак, из данного реферата можно сделать следующий вывод: Многообразие методов позволяет нам производить оценку частоты препаратов ,производить очистку белков и аминокислот, а так же использовать их в качестве лекарственных средств . Так же методы применяют для выделения и анализа белков и нуклеиновых кислот. Электрофорез и центрифугирование играет огромную роль в фармации .
Список Литературы
1.Духин С.С., Дерягин Б.В., 1976. Электрофорез
2. С.Жохов. Аналитика научно технический журнал.№1.2015.
3.Улащик. В. Электрофорез лекарственных веществ.2010.
4.Остерман.Л.А Электрофорез и ультрацентрифугирование (практическое пособие). Методы исследования белков и нуклеиновых кислот .
5. Шарипова С.Х. Курс лекция в рамках программы "Коллоидная химия"
6.Наука и биохимия .методы разделения белков (https://murzim.ru/nauka/biohimija/24518-metody-razdeleniya-belkov.html)
