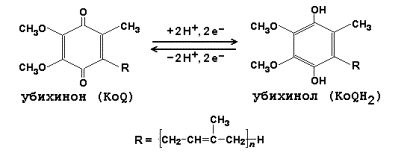БХ Занятие 8. Эндергонические и экзергонические реакции в клетке макроэргические соединения
 Скачать 479.28 Kb. Скачать 479.28 Kb.
|
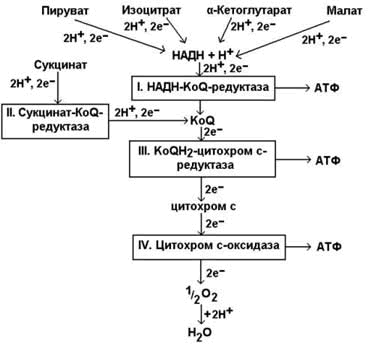
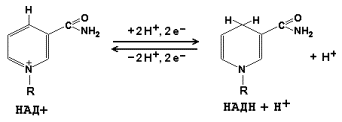
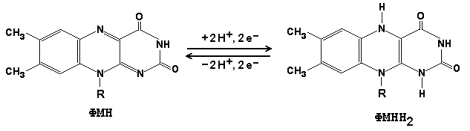
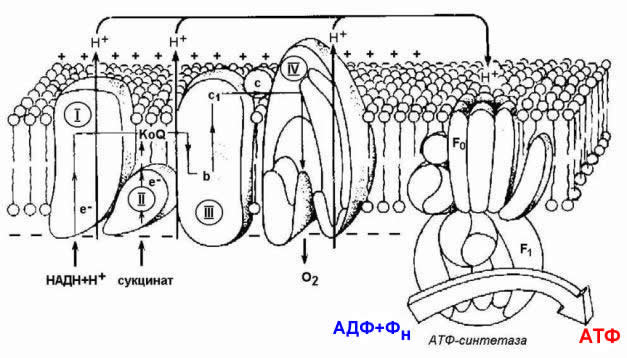
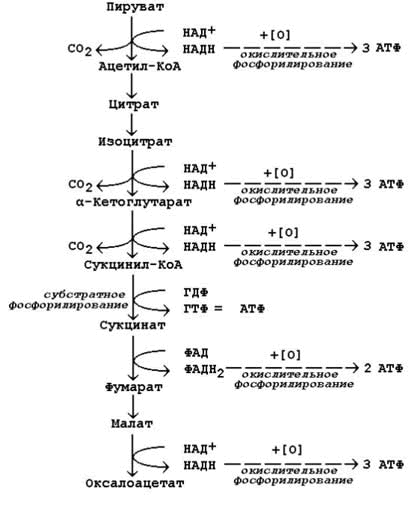
СоА и все соединения, содержащие сложную тиоэфирную группу,и производные фосфорной кислоты.(карбоксилфосфатные)Эндергонические и экзергонические реакции в клетке; макроэргические соединения. В свою очередь АТФ – источник энергии для важных метаболических путей, в которых идут превращения глюкозы, фруктозы и многих других молекул. Получая фосфатную группу от АТФ, эти молекулы увеличивают уровень своей свободной энергии (G), что обеспечивает течение ряда ферментативных реакций и клеточных процессов. Вместе с тем, АДФ универсальный акцептор энергии (и фосфатной группы) от клеточных макроэргов, которые обладают более высоким уровнем свободной энергии. Цикл АТФ-АДФ — основной механизм обмена энергии в клетке. Субстратное фосфорилирование.Одним из источников нуклеозидтрифосфатов, главным образом АТФ, является субстратное фосфорилирование, в процессе которого они могут синтезироваться в реакциях переноса фосфорильной группы от содержащих остаток фосфорной кислоты макроэргических соединений на нуклеозиддифосфаты. Реакции субстратного фосфорилирования являются важным источником получения АТФ, особенно в анаэробных условиях. Для эукариотов главным источником АТФ является окислительное фофорилирование, использующее энергию электронов, освобождающихся при дегидрировании субстратов, при восстановлении кислорода, через реализацию трансмембранного протонного градиента потенциала. Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической: (1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль). Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы. (2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль). При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой, фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима: (3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль). В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами (макроэргические соединения) 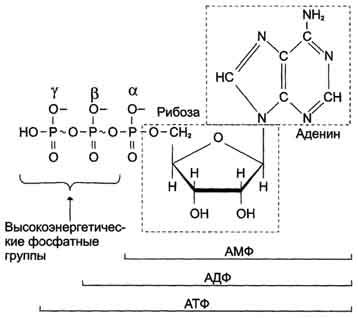 АТФ - молекула, богатая энергией, поскольку она содержит две фосфоаншдридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ. Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч. Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта". Биологическое окисление; дегидрирование субстратов и восстановление кислорода как источник энергии для синтеза АТФ. Биологическое окисление – процесс окисления биологических веществ с выделением энергии. Тканевое дыхание – процесс поглощения кислорода (О2) при окислении органического субстрата с выделением углекислого газа (СО2) и воды (Н2О). Окислительное фосфорилирование – синтез АТФ при тканевом дыхании. Дегидрирование субстратов и восстановление кислорода (образование воды) как основной источник энергии для синтеза АТФ АТФ – чрезвычайно важная молекула клетки. Она непрерывно синтезируется и используется. Энергия для синтеза АТФ поступает от субстратов, отдающих электроны в ходе их дегидрирования. Электроны извлекаются из субстратов в ходе гликолиза и гликогенолиза (в цитозоле), при окислении жирных кислот и в общих путях метаболизма: при преобразовании пирувата в ацетил-КоА и в цикле трикарбоновых кислот (в митохондриальном матриксе). Молекулы НАДН и ФАДН2 переносят эти электроны в дыхательную цепь, локализованную во внутренней митохондриальной мембране. Энергия этих электронов используется для создания трансмембранного протонного градиента потенциала, используемого для синтеза АТФ. Окислительное, субстратное и фотофосфорилирование - реакции образования АТФ. Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием. Отношение количества связанного фосфата к количеству поглощенного кислорода (О) называют коэффициентом фосфорилирования и обозначают как Р/О. Как было показано, коэффициент Р/О равен 3. Эта величина отражает теоретически возможный выход АТФ. В действительности часть энергии электрохимического потенциала используется не на синтез АТФ, а на перенос веществ через митохондриальную мембрану при участии ферментов транслоказ. Суммарный результат окисления (НАДН + Н+) и фосфорилирования АДФ в дыхательной цепи можно представить следующим образом: НАДН + Н++ ½О2 → НАД+ + Н2О; 3АДФ + 3Н3РО4 → 3АТФ + 3Н2О. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ - это синтез АТФ из аденозиндифосфата и неорганического фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении органических веществ в в процессе клеточного дыхания. СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ - это синтез АТФ, не связанный с электрон-транспортной системой, при котором остаток фосфорной кислоты (Н2РО3) переносится на АДФ от высокоэнергетического (фосфорилированного) соединения. Для ряда анаэробов (осуществляющих брожение) является единственным способом получения энергии. В процессе биологического окисления около 50% энергии резервируется клетками тканей в макроэргических соединениях, преимущественно АТФ. Синтез АТФ из АДФ и фосфорной кислоты, который происходит с использованием энергии, выделяющееся при окисления веществ в живых клетках, и связанный с переносом электронов по дыхательной цепи, называется окислительным фосфорилированием. Окислительного фосфорилирования может осуществляться на уровне субстрата (субстратное фосфорилирование), но главным образом на различных этапах дыхательной цепи. Субстратное фосфорилирование, как отмечалось выше, происходит путем непосредственной передачи молекулы активного фосфата с субстратов, содержащих макроэргических связь, на АДФ с образованием АТФ (см. Обмен углеводов, липидов). Например, промежуточный продукт распада глюкозы и триацилглицеры-нов 2-фосфоенолпировиноградна кислота отдает свой активный фосфат на АДФ с образованием АТФ за реакцией. Однако субстратное фосфорилирование дает незначительное количество молекул АТФ. Основное их количество синтезируется в процессе фосфорилирования, которое связано с клеточным дыханием. Установлено, что на каждом этапе переноса электронов от одного переносчика на другой они переходят с одного энергетического уровня на другой (ниже), в результате чего происходит высвобождение определенного количества энергии. Однако существует три этапа, когда энергии, высвобождаемой, достаточно для синтеза АТФ Строение митохондрий, строение и функция митохондриальной дыхательной цепи, окислительное фосфорилирование, коэффициент Р\О, особенности состава, строение и функций компонентов (комплексов) дыхательной цепи.
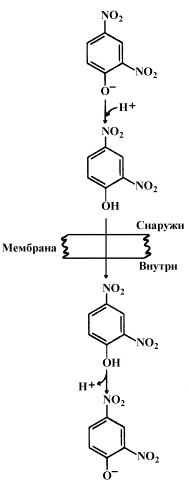
5. Протонный градиент и электрохимический потенциал. Хемиосмотическия гипотеза сопряжения окисления и фосфорилирования Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ. Протоны, перенесённые из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несёт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный - на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования (рис. 6-11, 6-13). Механизм транспорта протонов через мито-хондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса. Хемиосмотическая теория сопряжения окисления и фосфорилирования. Эта гипотеза предложена в 1961 г. П. Митчеллом; причем значительный вклад в се доказательство был сделан В. П. Скулачсвым с соавторами. Согласно этой теории, фактором, сопрягающим окисление с фосфорилированием, является электрохимический, протонный потенциал ДрН+, возникающий на внутренней мембране митохондрий в процессе транспорта электронов. При этом предполагается, что мембрана непроницаема для ионов, особенно протонов, их гранслокация с внутренней стороны мембраны (из матрикса) на наружную сторону внутренней мембраны митохондрий осуществляется за счет процесса окисления в дыхательной цепи, т. е. транспорта высокоэнергетических электронов. Возникающий электрохимический потенциал ДрН + является аддитивным; он складывается из химического потенциала ДрН и электрического со знаком (+) на наружной стороне мембраны (Ду): В настоящее время удалось измерить величину ДцН+, которая равна 0,25 В, следовательно, является вполне достаточной для синтеза АТФ, при этом большую часть потенциала составляет Ду, т. е. электрический потенциал. Градиент протонов, создающий разность химических и электрических потенциалов, и является источником энергии, необходимой для реакции Дыхательная цепь ферментов, образующая комплексы I, III и IV, как бы трижды «перешнуровывает» мембрану митохондрий. Таким образом, каждая пара электронов, транспортирующаяся от НАДН к кислороду, извлекает из матрикса три пары Н+, которые транслоцируются на наружную поверхность мембраны, в результате чего образуется три молекулы АТФ (рис .15.7). 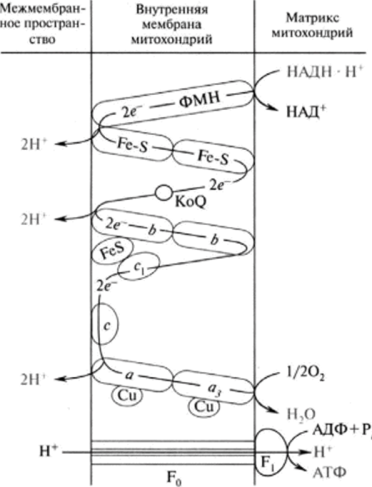 Рис. 15.7. Возможная конфигурация переносчиков электронов Н* вдыхательной цепи 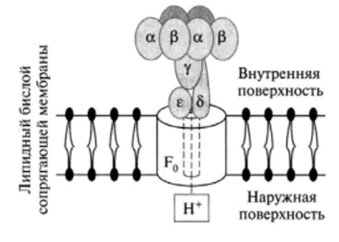 Рис. 15.8. Модель молекулярной организации Независимого АТФ- синтетазного комплекса Каким же образом электрохимический потенциал протонов используется в синтезе ЛТФ? Процесс фосфорилирования катализируется Независимым АТФ-азным комплексом: Н+-АТФ-синтетаза. Этот сложный комплекс состоит из растворимого каталитического компонента F, и мембранного компонента F0 (рис. 15.8). Компонент F, — белок с молекулярной массой 36—38 kDa — состоит из пяти типов субъединиц: а, (3, у, 6, е. Его вероятная формула основные каталитические свойства компонента F, (синтез АТФ) обеспечиваются а- и (3-субъединицами, у- и 8-белки осуществляют связь компонента F, с остальными компонентами комплекса, а е-субъсдиница является ингибитором АТФ-азной активности. Компонент F0 является интегральным белком мембраны и, по-видимому, насквозь пронизывает се. В состав Р0-компонента входит четыре типа субъединиц, в том числе белок, сообщающий данному компоненту чувствительность к олигомицину (следовательно, поэтому компонент обозначается с индексом «о» — олигомицин). Компонент F0, во-первых, участвует в связывании F, с мембраной и, во-вторых, в нем имеется протон-проводящий канал, через который происходит перенос Н+ с внешней стороны мембраны (по градиенту электрохимического потенциала) к компоненту F,, который при этом активируется и становится способным осуществить каталитическую ступень процесса синтеза АТФ. Таким образом, так же как и комплексы дыхательных ферментов, АТФ-синтетазная система фиксирована в мембране векторно, т. е. харастеризуется определенной пространственной направленностью, а комплекс F, выступает в матрикс и обеспечивает синтез АТФ (см. рис. 15.8). Стадией, лимитирующей синтез АТФ, является высвобождение синтезированного АТФ из активного центра фермента в матрикс. Полагают, что энергозависимое протонирование отдельных функциональных групп АТФ-азного комплекса, происходящее за счет энергии ДрН+, вызывает конформационные изменения в F,-компоненте, которые приводят к быстрому высвобождению синтезированного АТФ из активного центра фермента. Важным моментом является обратимость реакции, катализируемой АТФ-азным комплексом. При соответствующих условиях комплекс F0—F, может расщеплять молекулу АТФ и использовать полученную при этом энергию для транспорта протонов, т. е. для образования на мембране ДрН+. Согласно концепции, постулированной В. П. Скулачевым, ДцН+ наряду с АТФ используется как конвертируемая «валюта» для энергетических превращений, протекающих на мембране. В связи с этим было предложено все энергетические превращения в клетке подразделить на две группы: протекающие в цитоплазме (источник энергии — АТФ, крсатинфосфат и другие макроэрги) и локализованные в мембране, использующие энергию ДцН+ (рис. 15.9). Следует отметить, что Н+ не уникален в качестве сопрягающего иона и у некоторых видов организмов при определенных условиях его может заменить ион натрия. 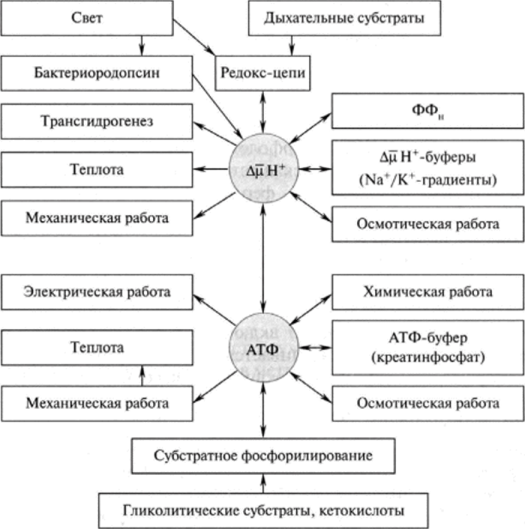 Рис. 15.9. Схема энергетики клетки, использующей ДцН* в качестве мембранной конвертируемой формы энергии (по В. П. Скулачеву) Таким образом, ДцН*-зависимое образование АТФ — главный, но не единственный процесс трансформации ДцН+ в химическую работу. К этому же типу энергетических превращений относятся синтез неорганического пирофосфата и перенос восстановительных эквивалентов в направлении более отрицательных редокс-потенциалов, например обратный перенос электронов вдыхательной цепи и трансгидрогеназная реакция. Зависящий от ДрН4 транспорт через мембрану различных веществ в сторону большей их концентрации представляет собой трансформацию энергии по типу ДцН+ —? осмотическая работа, а вращение бактериального жгутика за счет энергии ДцН+ служит примером превращения ДцН+ —*• механическая работа. Образование теплоты митохондриями животных описывается превращениями типа ДцН+ —> теплопродукция. АТФ-синтаза: локализация, строение, механизм синтеза АТФ АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1. Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс. Строение и механизм действия АТФ-синтазы. А - F0 и F1 - комплексы АТФ-синтазы, В состав F0 входят полипептидные цепи, которые образуют канал, пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β ("головка"), прикрывающие стержневую часть, которая состоит из 3 субъединиц γ, δ и ε. γ и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание АДФ, неорганического фосфата (Рi) и АТФ. Б - Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерёдно в 3 активных центрах: 1 - связывание АДФ и Н3РО4; 2 - образование фосфоангидридной связи АТФ; 3 - освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ. Регуляция функционирования системы окислительного фосфорилирования, дыхательный контроль. Регуляция процессов окисления и фосфорилирования осуществляется путем дыхательного контроля – изменение скорости окисления в дыхательной цепи при изменении соотношения концентраций АТФ и АДФ. При увеличении концентрации АТФ, скорость переноса электронов по дыхательной цепи замедляется, и, наоборот, при увеличении концентрации АДФ скорость переноса электронов увеличивается. Дыхательный контроль приводит в соответствие процессы образования и использования энергии в организме. В физиологических условиях процессы окисления и процессы синтеза АТФ тесно сопряжены. Степень сопряжения увеличивает гормон инсулин, витамины Е, К. В то же время в физиологических условиях и в патологических условиях возможно явление разобщения окисления и фосфорилирования. Разобщение – частичное или полное прекращение синтеза АТФ при сохранении транспорта электронов по дыхательной цепи. Способствуют частичному разобщению высокие концентрации гормонов щитовидной железы, билирубина, свободных жирных кислот, динитрофенола. Механизм действия разобщителей заключается в том, что, будучи жирорастворимыми веществами, они обеспечивают транспорт Н+ через внутреннюю мембрану митохондрий из межмембранного пространства в матрикс, минуя протонную АТФ-азу. Это снижает протонный потенциал и, следовательно, синтез АТФ. В физиологических условиях частичное разобщение выполняет важную терморегуляторную роль. В норме свободная энергия, равная 52 ккал/моль, распределяется следующим образом: 60% - используется на выполнение работы, 40% на согревание организма. При увеличении теплоотдачи организма при низкой внешней температуре происходит частичное разобщение окисления и фосфолирирования и в результате снижается доля свободной энергии использующейся на работу, но одновременно увеличивается энергия, расходуемая на поддержание температуры тела. Дыхательный контроль Скорость дыхания митохондрий может контролироваться концентрацией АДФ. Это объясняется тем, что окисление и фосфорилирование жестко сопряжены. Энергия, необходимая клетке для совершения работы, поставляется за счет гидролиза АТФ. Концентрация АДФ при этом увеличивается; в результате создаются условия для ускорения дыхания, что и ведет к восполнению запасов АТФ. Таким образом повышение концентрации АДФ стимулирует работу ЦПЭ, а увеличение содержания АТФ ее снижает. Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания. Особенности энергетического обмена в бурой жировой ткани. Разобщение дыхания и фосфорилированияНекоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт или метаболиты, которые образуются в организме, билирубин - продукт катаболизма тема, тироксин - гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации. +Терморегуляторная функция ЦПЭНа синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнес-пящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями.На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только "топливом", но и важнейшим регулятором разобщения дыхания и фосфорилирования. 9. Образование активных форм кислорода при биологическом окислении. Физиологические и токсические эффекты активных форм кислорода. Активные формы кислорода химически очень агрессивны: они повреждают белки и ДНК и, главное, вызывают перекисное окисление липидов - самоподдерживающийся процесс, ведущий к тяжелому повреждению мембран. К активным формам кислорода (АФК) относятся супероксид (O2), синглетный кислород, Н2О2 и радикал гидроксила (ОН'). В организме человека и животных первичным АФК служит супероксид, возникающий при одноэлектронном восстановлении молекулярного кислорода. Активные формы кислорода могут образовываться как в результате процесса "разобщения" на цитохроме Р-450, так и при окислении некоторых эндогенных субстратов. Функций активных форм кислорода, образующихся в процессе промоции канцерогенеза, несколько: - стимуляция митоза, - блокирование межклеточных коммуникаций, препятствующее апоптозу, - освобождение из ферритина ионов железа, катализирующих образование гидроксирадикалов, - высвобождение свободной арахидоновой кислоты из мембраны с последующим ее метаболизмом на цитохроме Р-450 с образованием высокоактивных метаболитов. АФК активно участвуют в процессах передачи клеточного сигнала. Так, например, свободные радикалы, которые образуются в цитозоле клетки в ответ на стимуляцию факторами роста, участвуют в регуляции пролиферативного. Имеется много публикаций, свидетельствующих, что активные формы кислорода стимулируют деление различных типов клеток. Самым распространенным патологическим состоянием, приводящим к значительной вспышке продукции АФК, является гипоксия и последующая реоксигенация. В ходе продолжительной гипоксии происходит множество изменений в активности ряда клеточных ферментов, истощение и повреждение антиоксидантных защитных систем и быстрое восстановление компонентов дыхательной цепи за счет обращения АТФ-синтазной реакции, используемой для создания протонного градиента в условиях недостатка кислорода. В результате всех этих изменений при последующей реоксигенации утечка электронов с комплексов дыхательной цепи и генерация супероксида значительно увеличивается. В условиях нормоксии повышенная генерация активных форм кислорода, приводящая к окислительному стрессу, наблюдается обычно только в очагах воспаления. В данном случае кислородный взрыв обусловлен деятельностью НАДФН-оксидазных систем макрофагов и является жестко регулируемым, оказывая деструктивное влияние только на клетки, на которые направлена иммунная реакция. Поскольку образование АФК в клетках любых аэробных организмов происходит непрерывно, то клетках должны быть и защитная система против их пагубного влияния. |