Задачи с решением ТЛФ. Фармацевтическая технология Recipe
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
|
5. Проверка доз веществ списка А и Б и норм одноразового отпуска. Лекарственная форма для наружного применения. Дозы не проверяются. 6. Паспорт письменного контроля.  7.Технология лекарственной формы с теоретическим обоснованием Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ ЗФ № 309 от 21.10.97 г. Изготовление мази ведут в соответствии с требованиями статьи ГФ ХI «Мази». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97 г. Содержание твердой фазы (кислоты салициловой) – 2,5%. 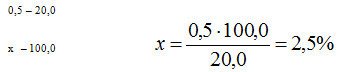 Прописанное количество салициловой кислоты не обеспечивает растворимость в основе. Ее необходимо ввести по типу суспензии. Анестезин растворим в основе, следовательно, его вводят в мазь по правилам приготовления мазей – растворов. Новокаин, как водорастворимый препарат, необходимо после растворения в воде, ввести по типу эмульсии. В фарфоровой выпарительной чашке на водяной бане расплавляют 16,0 вазелина при температуре не выше 40-50°С и в нем растворяют 1,0 предварительно измельченного анестезина. В ступку помещают 0,5 салициловой кислоты и тщательно растирают с 12 каплями вазелинового масла (0,25 по массе), так как прописанная основа углеводородного характера. К измельченному таким образом препарату добавляют раствор анестезина в вазелине и перемешивают до отсутствия видимых частиц кислоты салициловой. Полученную смесь отодвигают на край ступки. С помощью пипетки в ступку отмеривают 12 капель дистиллированной воды, растворяют в ней при растирании 0,5 новокаина. Раствор эмульгируют 1,4 безводного ланолина. Заэмульгированный раствор смешивают с ранее полученной мазью. 8. Упаковка и оформление. Мазь помещают в стеклянную баночку на 20,0 с навинчивающейся крышкой. Наклеивают номер рецепта. Оформляют этикеткой «Наружное», предупредительные надписи: «Хранить в прохладном, защищенном от света месте». 9. Оценка качества. – Анализ документации. Рецепт выписан правильно. Ингредиенты совместимы. Паспорт письменного контроля и номер соответствуют рецепту. – Правильность упаковки и оформления. Емкость банки соответствует количеству мази. Укупорка правильная. Оформление соответствует приказу МЗ РФ № 120 от 05.09.97 г. – Органолептический контроль. Мазь желтовато – бурого цвета, однородная. – Масса мази 20 ± 1,6, что соответствует нормам допустимых отклонений (± 8%) в общей массе мазей (приказ МЗ РФ № 305 от 16.10.97 г.). 11. Применение. Обезболивающее средство. №37. 1. Recipe: Chinini hydrochloridi 0,2 Olei Cacao 1,0 Misce fiat globulus Da tales doses № 6 Signa: По 1 шарику на ночь. 2. Свойства ингредиентов. Chinini hydrochloridum (ГФ X, ст. 147) – бесцветные шелковистые иголочки или белый мелкокристаллический порошок, растворим в воде, легко в горячий. Oleum Cacao (ГФ IX, ст. 339) – плотная однородная масса желтоватого цвета, слабого ароматного запаха какао, плавится при температуре 30-34°С, превращаясь в прозрачную жидкость. 3. Ингредиенты: совместимы. 4. Характеристика лекарственной формы. По определению приказа МЗ РФ № 82 от 29.02.2000 суппозитории – твердая дозированная лекарственная форма. Данные суппозитории предназначены для ректального введения, выписаны распределительным способом на липофильной основе с веществом хинина гидрохлоридом. По дисперсологической классификации свободная, всесторонне дисперсная система с твердой дисперсионной средой и твердой дисперсной фазой (хинина гидрохлорид вводится по типу суспензии). 5. Проверка доз. Веществ списка А и Б нет. 6. Паспорт письменного контроля. 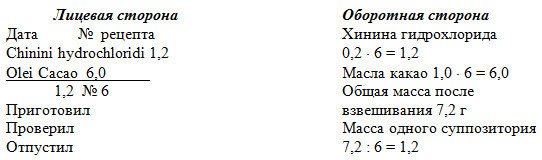 7. Технология лекарственной формы с теоретическим обоснованием. Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97 г. Изготовление суппозиториев ведут в соответствии с требованиями общей статьи ГФ ХI суппозитории. Паспорт письменного контроля оформляется на основании приказа МЗ ЗФ № 214 от 16.07.97 г. Хинина гидрохлорид растворим в воде, и для растворения 1,0 требуется большое количество воды. Это может повлиять на консистентные свойства суппозиторной массы, поэтому хинина гидрохлорид вводят в суппозитории по типу суспензий. В ступке измельчают 1,2 г хинина гидрохлорида, затем добавляют 0,6 измельченного масла какао и тщательно смешивают, получая тонкую суспензию. Затем частями добавляют измельченное масло какао, каждый раз, уминая до получения пластичной массы. Массу собирают на капсулу из парафинированной бумаги, взвешивают, отмечают ее количество на оборотной стороне рецепта и в ППК. Полученную массу переносят на стекло пилюльной машинки, где и формируют вагинальные суппозитории в форме шариков, овулей и пессариев. Для этого при помощи дощечки выкатывают (формируют) брусок (стержень), который с помощью резака пилюльной машинки дозируют на 6 доз, затем стержень разрезают и с помощью дощечки формируют вагинальные суппозитории. 8. Упаковка и оформление. Полученные вагинальные суппозитории заворачивают в «квадратики» из вощеной бумаги, упаковывают в картонную коробку, сверху прикрывают вощеной бумагой. Оформляют этикеткой «Наружное» и предупредительными надписями: «Хранить в прохладном месте», «Беречь от детей», наклеивают номер рецепта. 9. Оценка качества. – Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют. Расчеты сделаны верно. – Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97г. – Внешний вид (форма, размер) соответствуют форме вагинальных суппозиториев, размер одинаковый. – Однородность – на продольном разрезе масса однородна, отсутствуют вкрапления. – Средняя масса и отклонение в массе суппозиториев находятся в пределах ± 5% от 1,14 до 1,26 г (приказ МЗ РФ № 305 от 16.10.97 г.). Время полной деформации не более 15 мин. 10. Применение. Противозачаточное средство. № 38. 1. Recipe: Bismuthi subnitratis 0,15 Butyroli quantum satis ut fiat suppositorium. Da tales doses № 6. Signa: По одному суппозиторию 2 раза в день. 2.Свойства ингредиентов. Bismuthi subnitras (ГФ Х, ст.107) – белый аморфный или микрокристаллический порошок. Практически нерастворим в воде и спирте, легко растворим в азотной и соляной кислотах. Butyrolum – гидрофобная суппозиторная основа, состоящая из масла какао 30% гидрогенизированного жира (tпл 36°С )– 50%; гидрогенизированного жира (tпл 49°С) – 10%; парафина – 10%. Температура плавления бутирола 37°. 3. Ингредиенты: совместимы. 4. Характеристика лекарственной формы. По определению приказа Минздрава России № 82 от 29.02.2000г. суппозитории – твердая дозированная лекарственная форма. Данные суппозитории предназначены для ректального введения, выписаны распределительным способом на липофильной основе. По дисперсологической классификации – свободная всесторонне дисперсная система c твердой дисперсионной средой и твердой дисперсной фазой (висмута нитрата основной вводится по типу суспензии). 5. Проверка доз и норм одноразового отпуска. Веществ списков А и Б, наркотического и одурманивающего действия в рецепте не прописано. 6. Паспорт письменного контроля.  7.Технология лекарственной формы с теоретическим обоснованием. Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97г. Изготовление суппозиториев ведется в соответствии с требованиями общей статьи ГФ ХI «Суппозитории». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97г. Поскольку висмута нитрат основной не растворяется ни в воде, ни в масле, его вводят в суппозиторную массу по типу суспензии. Объем гнезд формы обеспечивает получение суппозиториев массой 3,0, поэтому для приготовления 6 суппозиториев на бутироле следовало бы взять 18,0 основ. Учитывая объем, который занимает 0,9г висмута нитрата основной, бутирола отвешивают 17,81г, измельчают, помещают в выпарительную чашку и расплавляют на водяной бане. В ступке тщательно растирают 0,9 висмута нитрата основного с частью расплавленного бутирола – готовят тонкую суспензию. Далее, частями добавляют расплавленную основу, тщательно перемешивают. В разъемные, предварительно смазанные глицерином формы, разливают суппозиторную массу. Охлаждают, освобождают суппозитории путем разъема формы, подсушивают на воздухе несколько минут. |
