КОМПЛЕКСООБРАЗОВАНИЕ В СИСТЕМЕ: Fe (III) – ПИРИДИЛАЗОРЕЗОРЦИН. Федеральное агенство по образованию рф гоу впо бурятский государственный университет
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| рН | 8,0 | 8,1 | 8,2 | 8,3 | 8,4 | 8,5 | 8,6 | 8,7 | 8,8 | 8,9 |
| [H+]∙108 | 1 | 0,79 | 0,63 | 0,50 | 0,40 | 0,30 | 0,25 | 0,20 | 0,16 | 0,13 |
| Ск*105 | 0,938 | 0,942 | 0,949 | 0,954 | 0,959 | 0,966 | 0,972 | 0,977 | 0,984 | 0,988 |
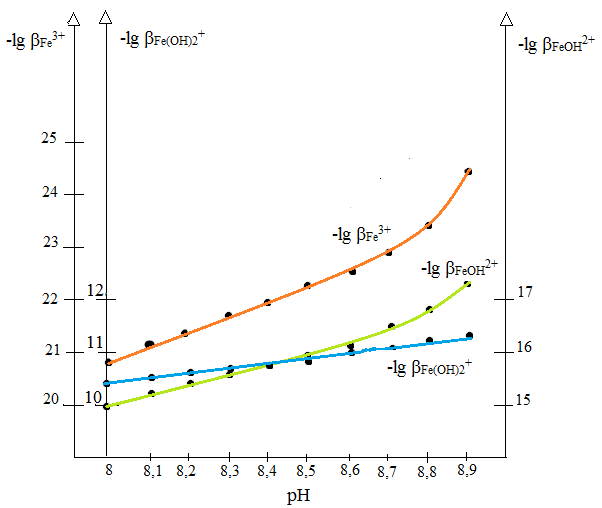
| βFe3+ | 1.45*10-21 | 8.34*10-22 | 4.38*10-22 | 2.33*10-22 | 1.21*10-22 | 5.74*10-23 | 2.74*10-23 | 1.24*10-23 | 4.64*10-24 | 3.01*10-25 |
| -lg βFe3+ | 20.84 | 21.08 | 21.34 | 21.63 | 21.92 | 22.24 | 22.56 | 22.91 | 23.33 | 24.50 |
| βFeOH2+ | 9.23*10-16 | 7.04*10-16 | 4.66*10-16 | 3.12*10-16 | 2.04*10-16 | 1.22*10-16 | 7.31*10-17 | 4.16*10-17 | 1.96*10-17 | 7.08*10-18 |
| -lg βFeOH2+ | 15.01 | 15.15 | 15.33 | 15.51 | 15.69 | 15.91 | 16.13 | 16.38 | 16.71 | 17.15 |
| βFe(OH)2+ | 4.10*10-11 | 4.09*10-11 | 3.62*10-11 | 3.18*10-11 | 2.68*10-11 | 2.05*10-11 | 1.57*10-11 | 1.13*10-11 | 6.76*10-12 | 5.62*10-12 |
| -lg βFe(OH)2+ | 10.38 | 10.39 | 10.44 | 10.49 | 10.57 | 10.69 | 10.8 | 10,95 | 11,17 | 11,25 |
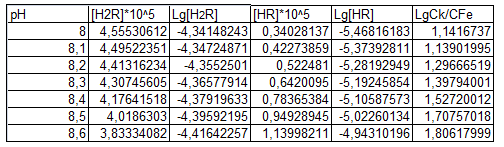
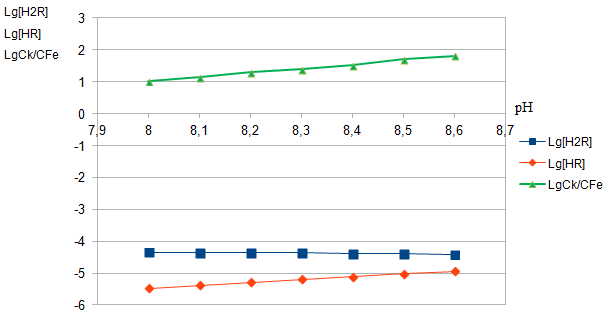
| рН | 8,0 | 8,1 | 8,2 | 8,3 | 8,4 | 8,5 | 8,6 |
| Ах | 0,530 | 0,532 | 0,536 | 0,539 | 0,542 | 0,546 | 0,549 |
| Ск*105 | 0,938 | 0,942 | 0,949 | 0,954 | 0,959 | 0,966 | 0,972 |
| СFe*106 | 0,660 | 0,540 | 0,480 | 0,360 | 0,310 | 0,270 | 0,200 |
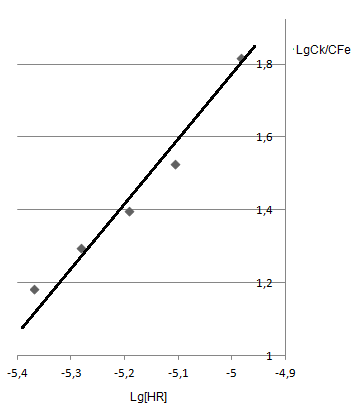
| [HR-]*105 | 0.340 | 0.423 | 0.523 | 0.642 | 0.784 | 0.949 | 1.140 |
| lg Куст | 12.089 | 11.989 | 11.859 | 11.808 | 11.702 | 11.599 | 11.573 |
| | 11.803 | ||||||
| d | 0,286 | 0,186 | 0,056 | 0,005 | 0,101 | 0,204 | 0,230 |
| | 0,153 | ||||||
| V | 0,037 | ||||||
| S | 0,193 | ||||||
| δ | 0,179 | ||||||
| μ± δ | 11,803±0,179 | ||||||
| рН | Cк∙105 | А | ε∙10 -5 | | d∙10 -5 | 10 -5 | V∙ 10 -11 | S∙ 10 -5 | δ∙ 10 -5 | ( 10 -5 |
| 8,0 | 0,938 | 0,530 | 0,605 | 0,589 | 0,016 | 0,008 | 0,001 | 0,01 | 0,009 | 0,589± 0,009 |
| 8,1 | 0,942 | 0,532 | 0,597 | 0,008 | ||||||
| 8,2 | 0,949 | 0,536 | 0,593 | 0,004 | ||||||
| 8,3 | 0,954 | 0,539 | 0,586 | 0,003 | ||||||
| 8,4 | 0,959 | 0,542 | 0,582 | 0,007 | ||||||
| 8,5 | 0,966 | 0,546 | 0,581 | 0,008 | ||||||
| 8,6 | 0,972 | 0,549 | 0,577 | 0,012 |
Влияние посторонних ионов на аналитические характеристики реакции ПАР с Fe(III) рассматривали с учетом тех ионов, которые могут сопутствовать железу в пищевых продуктах и для которых известны цветные реакции с ПАР (табл.12).
Таблица 12
Влияние посторонних ионов на реакцию комплексообразования железа(III) с ПАР (Fe:ион=1:Х )
| Ион | Zn2+ | Cu2+ | Cd2+ | Pb2+ | Со2+ | Ni2+ | Mn2+ |
| Х | - | - | 25 | 10 | - | - | - |
| ПДК, мг/кг | 35,0 | 7,0 | 0,07 | 0,35 | - | - | - |
Влияния ионов цинка, меди, кобальта, никеля и марганца не отмечено, хотя в литературе имеются сведения о их взаимодействии с ПАР. Это связано с тем, что с данными металлами ПАР образует комплексные соединения в кислой среде ( рН менее 5). Оптимальным рН комплексообразования железа с ПАР является рН=9, при котором комплексы указанных металлов разрушаются. Влиянием кадмия и свинца можно пренебречь, поскольку данная фотометрическая реакция рассматривается с целью практического применения для анализа пищевых продуктов, а в большинстве пищевых продуктов содержание железа значительно превышает содержание данных компонентов.
2.3. Фотометрическое определение Fe(III) в пищевых продуктах
Железо это жизненно – важный для человека микроэлемент, который участвует в процессах кроветворения, внутриклеточного обмена и регулирования окислительно-восстановительных процессов. Поэтому необходимо обеспечивать поступление этого элемента в организм человека в т.ч. использование комплексных препаратов поливитаминов с микроэлементами( в условиях обычного умеренного климата здоровому человеку необходимо 11-30 мг Fe в день). Кроме того, имеется ряд продуктов лечебного и лечебно-профилактичекого назначения, в состав которых входят различные добавки, содержащие железо.
Хлеб «Флагман» («Бурятхлебпром») хорошо зарекомендовал себя как продукт профилактического назначения. Изготовляется хлеб по ТУ 9110-002-50151448-04 «Изделия хлебобулочные с витаминами и железом от «Михалыча» [33]. В состав этого продукта входит одноименная добавка- «Флагман»: по нормативным документам содержание железа составляет 2,41-3,20мг/100г.
Отбор проб для последующего определения железа производился непосредственно перед анализом по ГОСТ 5667[34].
Подготовка к анализу
Процедура отбора состояла в отделении мякиша от корки с последующим его измельчением и квартованием. Взвешивали две навески по 10 г крошки исследуемого образца хлеба и количественно переносили в чашки для озоления. Чашки помещали на электрическую плиту и обугливали в течении 1-2 часов, периодически перемешивая. После озоления на плитке, чашки помещали в муфель, предварительно разогретый до 2500С и через каждые 20мин повышали температуру на 500С до 4500С (1ч20мин). Выдерживали при этой температуре до получения серой золы в течение 2-3часов. Затем навески вынимали и охлаждали до комнатной температуры. Сухой остаток обрабатывали несколькими капелями HNO3 (к.) и прокаливали на плитке досуха. Операции озоления в муфеле повторяли до получения бело-серой золы без черных вкраплений.
После охлаждения, золу растворяли в 2-5 см3 HCl (1:1) и количественно переносили в мерные колбы (Vк=50см3) (не доводя дистиллированной водой до метки). Далее раствором NH4OH (0,1н) устанавливали рН 5,0 (контроль по универсальной индикаторной бумаге). После этого дистиллированной водой растворы доводили до метки и проводили спектрофотометрическое определение железа.
Построение градуировочного графика.
В сухие конические колбы (Vк=50см3) вносили 0,5 1,0 2,0 3,0 4,0 5,0 см3 стандартного раствора соли железа (СFe2(SO4)3(NH4)2SO4*24H2O = 5,0∙10-4М). Добавляли в каждую колбу по 5,0см3 раствора ПАР (СПАР=1,0∙10-3М), 2,5см3 боратногобуферного раствора (рН=9,0) и доводили до метки дистиллированной водой.
Измерение оптической плотности проводили на фоне раствора ПАР V=5см3 (СПАР=1,0∙10-3М, рН=9,0) при λ=540нм и l=1cм. Строили график А=f(aFe) (зависимость оптической плотности от содержания железа (мг)) (рис.15). Фактор пересчета: F Fe2(SO4)3(NH4)2SO4*24H2O / Fe=0,1162
Данные для построения градуировочного графика представлены в таблице 13.
Таблица 13
Данные для построения градуировочного графика
| V Fe2(SO4)3(NH4)2SO4*24H2O, см3 | 0,5 | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 |
| С Fe2(SO4)3(NH4)2SO4*24H2O, моль/дм3∙104 | 0,05 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 |
| СFe, мг/см3∙104 | 0,325 | 0,650 | 1,250 | 1,875 | 2,499 | 3,125 |
| аFe,мг∙103 | 1,625 | 3,250 | 6,250 | 9,375 | 12,495 | 15,625 |
| А, усл.ед. | 0,080 | 0,150 | 0,320 | 0,530 | 0,710 | 0,870 |
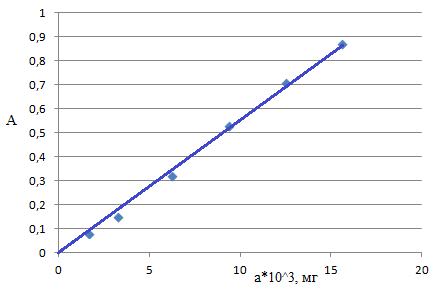
рис.15. Зависимость оптической плотности от содержания железа
(рН=9,0, λ=540нм, l=1см)
Фотометрическое определение железа.
В стеклянные стаканы(50см3) вносили по 1см3растворов, полученных по п.п.1.1. Добавляли по 1см3раствора ПАР (СПАР=2,5∙10-3М) устанавливали рН =9 и измеряли оптическую плотность растворов на фоне раствора ПАР (СПАР=1,0∙10-3М, рН=9,0) при λ=540нм и l=1cм. По градуировочному графику находили содержание железа в пробах.
Метрологическая оценка результатов фотометрического определения железа.
Контроль правильности результатов анализа осуществлялся методом «введено-найдено», для этого определение железа проводилось в 3-х параллелях проб без добавки и 3-х параллелях с добавками железа (mн=10г). Согласно нормативным документам, содержание железа в пробе(mн=10г) составляет 0,21-0,32мг (Vк=50см3), т.е. концентрация железа в колбе (4,2-6,2)∙10-3мг/см3. С учетом аликвоты (1см3) содержание железа в фотометрируемом растворе должно находится в интервале 4,2-6,2∙10-3мг.
Добавка составляла 0,388 мг железа, т.е., в пробу массой 10г вводилось 1,0 см3 раствора с концентрацией железа 0,388мг/см3.
Измерение оптической плотности проводилось трижды из каждой пробы. Результаты определения железа в пробах хлеба «Флагман» без добавки железа и с добавлением железа представлены в таблице 14.
Расчет содержания железа в пробе: аi=аграф.∙Vк /Val
Статистическая обработка данных приведена в таблице 15.
Таблица 14
Результаты определения железа в хлебе «Флагман»
| Проба | Данные | Хср | Хi -Хср | (Хi -Хср)2*106 | V*106 | S | |
| Без добавки | 1 2 3 | 0,252 0,248 0,250 0,260 0,245 0,254 0,251 0,252 0,249 | 0,251 | 0,001 -0,003 -0,001 0,009 -0,006 0,003 0,000 0,001 -0,002 | 1,00 9,00 1,00 81,00 36,00 9,00 0,00 1,00 4,00 | 17,75 | 0,00421 |
| С добавкой | 1 2 3 | 0,636 0,628 0,637 0,651 0,628 0,644 0,644 0,637 0,631 | 0,637 | -0,001 -0,009 0,000 0,014 -0,009 0,007 0,007 0,000 -0,006 | 1,00 81,00 0,00 196,00 81,00 49,00 49,00 0,00 36,00 | 61,63 | 0,00785 |
Доверительный интервал определения железа
в пробе без добавки:
δ = t•S/√n =2,31•0,00421/3 = 0,003
в пробе с добавкой:
δ = t•S/√n =2,31•0,00785/3 = 0,006
Содержание железа в пробе без добавки составляет: (0,251 + 0,003)мг
Содержание железа в пробе с добавкой составляет: (0,637+0,006)мг
Таблица 15
Оценка правильности методом «введено-найдено»
| № | Введено Fe(мг): а0 | Найдено Fe(мг): аij | Преобразование значений | | σΣ | σΣ r(относ.) (или σ(Δ)) | |
| аij-а0 | (аij-а0)2.106 | ||||||
| 1 | 0,388 | 0,384 0,380 0,387 | -0,004 -0,008 -0,001 | 16,00 64,00 1,00 | 189·10 -6 | 0.00486 | 1,26 |
| 2 | 0,391 0,383 0,390 | 0,003 -0,005 0,002 | 9,00 25,00 4,00 | ||||
| 3 | 0,393 0,385 0,382 | 0,005 -0,003 -0,006 | 25,00 9,00 36,00 | ||||
аij ср.=0.386 ∑= 0,017
d = ∑(аij-а0)/n = 0.017/9 = 0.0019 dr = d·100/ аij = 0.0019*100/0.386 = 0.49%
σΣ=
tэксп. = dr* √n/ σΣ r = 0.49*3/1,26 = 1.17 tтабл. = 2.31 (Р=0.95, f=8)
δ = t•S/√n =2,31•0,00486/3 = 0,004 μ = аij ср.+δ = 0.386+0,004
С учетом среднего квадратического отклонения были назначены нормативы контроля сходимости, воспроизводимости и точности. При расчете нормативов контроля опирались на алгоритм расчета, приведенный в работах [36,37].
Значение характеристики суммарной погрешности оценивали по значениям характеристик составляющих погрешности (случайной и систематической).
Δ = 1.96√Δ2с/3 + σ(Δ)
Поскольку tэксп
Нормативы оперативного контроля:
Сходимости: d = D/1.5 = 3.49/1.5 = 2.33% отн. от среднего результата анализа (0.02·х)
Воспроизводимости: D= Qp,n·σ(Δ), где Qp,n – квантиль, равная 2.77 для двух параллелей и Р = 0.95, σ(Δ) – случайная составляющая погрешности анализа = 1.26%.
D = 2.77·1.26= 3.49% отн. от среднего результата анализа (0,03∙х);
Точности: К=Δ = 2.47% отн. (внешнелабораторный контроль);
K=0,84· Δ = 2.47· 0.84 = 2.08% отн. (внутрилабораторный контроль).