КОМПЛЕКСООБРАЗОВАНИЕ В СИСТЕМЕ: Fe (III) – ПИРИДИЛАЗОРЕЗОРЦИН. Федеральное агенство по образованию рф гоу впо бурятский государственный университет
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
ГЛАВА I. Органические реагенты в аналитической химии.Гетероциклические азосоединения как металлоиндикаторы. Азооксисоединения являются органическими реагентами успешно используемыми в аналитической химии. Однако большинство этих реагентов координирует ионы металлов за счет оксигрупп поэтому их селективность снижена. Введение в молекулу реагентов гетероатомов (азота, кислорода, серы), которые избирательно координируют ионы металлов, значительно повышает их селективность. Первыми гетероциклическими азосоединениями,которые использовались для определения ионов металлов, были реагенты, содержащие в своей структуре группу: 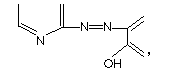 где диазосоставляющей компонентой является азотсодержащий гетероцикл, а азосоставляющей являются различные фенолы и нафтолы с оксигруппой в орто-положении. Впервые пиридиновые азосоединения как родоначальники гетероциклических азосоединений были получены Чичибабиным с сотрудниками в 1918 г. [4,5]. Однако они долгое время не находили практического применения. В 1951 г. Лью [6] исследовал реакции 1-(2-пиридилазо)-2-нафтола (ПАН-2) с рядом ионов металлов. Первая публикация о возможности использования ПАН-2 как комплексонометрического индикатора принадлежит Ченгу и Брею [7], а в 1957 г. Вебер [8] сообщил об аналогичных возможностях 4-(2-пиридилазо)резорцина. Позже в качестве комплексонометрических индикаторов стали использовать и другие гетероциклические азосоединения. В настоящее время известно около 15 аминов гетероциклического ряда, используемых в качестве диазосоставляющих, и около 30 соединений (в основном оксипроизводные бензола, нафталина, хинолина), используемых в качестве азосоставляющих. Все реагенты поглощают свет в видимой области спектра. Изменение ионного состояния реагентов резорцинового ряда приводит к сдвигу полосы максимального поглощения в длинноволновую область при переходе от молекулярных форм к катионным, а также батохромным сдвигом при переходе от молекулярных форм к однократно диссоциированным и далее к двукратно диссоциированным. При этом положение максимумов светопоглощения смещается на 30-100 нм. Положения максимумов светопоглощения и их молярные коэффициенты погашения для различных форм гетероциклических азосоединений приведены в таблице 1[9]. Таблица 1 Спектрофотометрические характеристики гетероциклических азосоединений
Как видно из табл.1 стерические препятствия, которые возникают при введении заместителей в диазосоставляющую, приводят к понижению значений молярных коэффициентов, что можно проследить на примере метильных производных ПАР [10]. Реагенты, образующие окрашенные соединения с ионами металлов, являются металлоиндикаторами. Индикаторы - вещества указывающие на состояние системы относительно избранного компонента, или на степень равновесия системы. Кислотно-основные индикаторы претерпевают хорошо заметное изменение окраски в некоторой определенной области значений рН. Окраска органических красителей обусловлена хромофорными группами: присоединение протона или катиона какого-либо металла изменяет распределение электронов в молекуле красителя. Индикаторы, с которыми происходят такие изменения, Шварценбах[11], а так же Кёрбль и Пршибил [12] назвали металлоиндикаторами (металлохромными или хелатохромными индикаторами). Индикаторы, образующие с ионами металла окрашенные комплексы и в которых ион металла является хромофором составляют вторую группу индикаторов. Индикатором последнего типа является тайрон, который реагирует с Fe(III) с образованием соединения темно-зеленого цвета. К третьей группе индикаторов относятся металлы с незаполненной 3d-орбиталями, образующие окрашенные ионы в растворе. Так как интенсивность окраски таких растворов слабая, эти ионы используются лишь в исключительных случаях [13]. Часто металлоиндикаторами являются многоосновные кислоты, которые меняют окраску с изменением кислотности раствора, поэтому при проведении анализа с такими индикаторами необходимо добавлять в раствор буферную смесь. При выборе условий, при которых происходит изменение окраски, необходимо учитывать побочные реакции не только индикатора, но и металла: влияние щелочно-земельных металлов можно не учитывать, поскольку их комплексообразующие способности сравнительно слабы; только в сильнощелочных растворах образуются гидроксокомплексы. Однако очень большое значение имеют побочные реакции ионов тяжелых металлов (например, компоненты буферных растворов могут образовывать достаточно устойчивые комплексные соединения с определяемым ионом и тем самым снижать концентрацию металла, влиять на прочность основного комплекса и т.д.). Следует отметить, что образование протонированных, гидроксо- и других смешанных комплексов повышает чувствительность металлоиндикатора [13]. Органические красители, используемые в качестве металлоиндикаторов, содержат, по меньшей мере, две ауксохромные группы, которые сами по себе не окрашены, но также влияют на поглощение света хромофорными группами. В свою очередь, эти группы могут содержать один или два атома азота либо один атом кислорода, связанный с углеродным скелетом, имеющим сопряженные двойные связи. Обычно молекула красителя присоединяет ион металла только в том случае, если она содержит кроме электродонорных атомов ауксохромных групп еще другие электродонорные атомы, причем в положении, благоприятном для образования с ионом металла пятичленных хелатных циклов, вследствие чего лиганд занимает несколько координационных мест во внутренней сфере комплексного соединения. Если ауксохромной группой металлоиндикатора является азогруппа, то в орто-положении к ней имеется дополнительная группа, содержащая донорный атом (хромофорная группа). Это может быть, например, -ОН, -NH2, -COOHили -CH2N(CH2COOH)2. Во многих случаях, коэффициент молярной экстинкции окрашенного комплекса иона металла с металлоиндикаторным красителем составляет величину порядка 104. Так как ион металла связывает электроны донорного атома индикатора слабее, чем ион водорода, то при образовании или диссоциации комплекса металла наблюдаемое изменение окраски гораздо слабее, чем при присоединении (отделении) иона водорода. Изменение окраски при образовании комплекса металла очень четкое, если при этом происходит замещение протона. Таким образом, металлоиндикаторы содержат специфические группы, способные участвовать в образовании хелатов и поглощать свет [10]. Наиболее применяемыми металлоиндикаторами из гетероциклических азосоединений являются 1-(2-пиридилазо)-2-нафтол (ПАН)и 4-(2-пиридилазо)резорцин (ПАР). 1-(2-пиридилазо)-2-нафтол (ПАН) – фотометрический реагент из класса N-гетероциклических азосоединений, который в зависимости от рН может существовать в растворах в трех формах. При рН < 2 преобладает водорастворимая протонированная форма H2R+, окрашенная в желто-зеленый цвет. В диапазоне рН от 3 до 11 ПАН существует в виде нейтральных молекул HR и даёт растворы жёлтого цвета в органических растворителях (в воде образуются коллоидные растворы). При рН > 11 ПАН существует в виде аниона R- красного цвета. ПАН обычно используют в виде метанольных или этанольных растворов. Он выступает как тридентатный лиганд, координируя ионы металлов по атому кислорода гидроксильной группы, пиридиновому атому азота и одному из атомов азота азогруппы. Комплексы металла с ПАН незаряжены, малорастворимы в воде и экстрагируются неполярными растворителями — хлороформом или бензолом. ПАН применяется для экстракционно-фотометрического определения ионов Mn2+, Zn2+, Cd2+, Ni2+ и др. Молярные коэффициенты поглощения комплексов ионов металлов с ПАН составляют (2– 6)∙104 л·моль-1·см-1. При экстракции в органическую фазу переходят как комплексы ионов металлов, так и свободный реагент. Однако длины волн максимального поглощения реагента и его комплексов обычно сильно различаются. Селективность методик с применением ПАН можно повысить путем варьирования рН и применения маскирующих реагентов. В частности, ионы железа (III), кобальта (II) и никеля (II) взаимодействуют с ПАН при рН 4. Это значение рН недостаточно для образования комплексов с ионами Mn2+, Zn2+ и Cd2+. При более высоких значениях рН в присутствии цианид-ионов можно определять ионы марганца (II) в присутствии ионов Ni2+, Zn2+, Cd2+, Со2+ и Сu2+, образующих устойчивые цианидные комплексы [12]. 4-(2-пиридилазо)резорцин (ПАР) в отличие от ПАН растворим в воде и образует с ионами металлов водорастворимые комплексы. При рН < 2 ПАР существует в виде протонированных форм Н5R3+, Н4R2+ и Н3R+. Нейтральные молекулы ПАР существуют в пределах рН от 2,1 до 4,2, а анион HR- при рН от 4,2 до 7. При рН >11 диссоциируют обе гидроксильные группы реагента и образуется ион R2-. ПАР образует окрашенные комплексы с ионами Cu2+, Bi3+ и Ti3+ в сернокислых растворах, а в ацетатных растворах (рН от 3 до 6) с ионами Zn2+, Cd2+, Co2+, Ni2+ и Mn2+ [12]. Комплексные соединения железа (III) Железо - элемент восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева. В соединениях проявляет валентности I, II, III, IV и VI, степень окисления +2, +3, координационные числа: 4, 6 [14]. Комплексы с неорганическими лигандами Чаще всего железо образует октаэдрические комплексы, но существуют и тетраэдрические, например, в случае FeCl-4 и FeCl2-4. Известно много солей и комплексов двухвалентного железа, но все они в большей или меньшей степени склонны к окислению воздухом до комплексов Fe(III). Fe(III) преимущественно образует соединения ковалентного характера. Поэтому Fe3+aq очень легко гидролизуется и в его растворах с рН > 1 существуют гидроксокомплексы, что значительно усложняет интерпретацию получаемых экспериментальных данных и расчет равновесных констант гидролиза. Установлено [15], что в разбавленных растворах (10-5 -10-4 моль/л) гидролиз ионов металла протекает в основном в направлении образования мономерных гидроксокомплексов, но не исключено и формирование биядерных комплексных соединений. При концентрации ионов металла 10-3 моль/л и выше характер процессов гидролиза резко меняется, процессы гидролиза приводят к образованию гидроксокомплексов сложного строения, поэтому концентрацию ионов металла 10-3 моль/л принято считать порогом полимеризации. В таблице представлены результаты анализа литературных данных по исследованию процессов гидролиза ионов железа (Ш) различными авторами [15]. Таблица 2 Константы гидролиза ионов железа(III)
Продолжение табл. 2
Примечания: При записи формул, отражающих состав частиц, молекулы воды для простоты опущены. Kpq=[Fep(OH)q(OH2)n-q(3p-q)][H+]/[Fe(OH2)n3+]p Потенциометрический метод исследования [16]. Спектрофотометрический метод исследования [17]. Метод ионного обмена [18]. Метод ядерной магнитной релаксации [19]. Весьма обычны для Fe(III) анионные комплексы, например оно адсорбируется из солянокислых сред на анионообменной смоле в виде хлоро-комплекса. Спектр поглощения Fe(III) с хлорид - ионом, находит ограниченное применение для определения железа. Гораздо более широкое применение имеет аналогичный комплекс с роданид-ионами. Константы устойчивости роданидных комплексов невелики, поэтому для определения требуется высокая концентрация лиганда (табл.3) [20]. В ряде случаев, невозможно провести определение Fe(II) или Fe(III) при их одновременном присутствии с помощью неорганических реагентов. Эту проблему можно решить при использовании органических аналитических реагентов, т.к. их комплексы с Fe характеризуются большей устойчивостью (табл.3). Таблица 3 Константы нестойкости некоторых комплексных соединений железа
Комплексы с органическими лигандами Железо(III) почти во всех своих комплексах с органическими лигандами находится в энергетически-выгодном состоянии (симметричность и занятость одним электроном d-орбиталей в электронной конфигурации d5). Именно поэтому железо в этой степени окисления образует свои наиболее прочные комплексы с анионными, а не с содержащими азот лигандами. Так, лиганды, применяемые для фотометрического определения Fe(III), могут связывать его с двумя кислородными анионами (пирокатехин, тайрон, салициловая кислота); кислородным и содержащим серу анионами (тиогликолевая и тиосалициловая кислоты); атомами кислорода и кислородным анионом (8-оксихинолин, салицилальдоксим, феррон) [21]. Подобно этому, Fe(III), образует очень прочный комплекс с ЕDTA. Лимонную, щавелевую и винную кислоты можно использовать для маскирования железа или удерживания его в слабокислых или нейтральных растворах. Основные характеристики комплексообразования Fe(III) c этими реагентами представлены в таблице 4[13, 21, 22]. Таблица 4 Комплексные соединения Fe(III)
Индикаторы, которые используются для определения Fe(III), типа: роданид, салицилат, сульфосалицилат и тайрон (пирокатехин-3,5-дисульфонат натрия) не являются металлохромными, бесцветны и используются в очень высоких концентрациях. Эти индикаторы обычно менее чувствительны, чем индикаторы-красители, а интенсивность окраски, определяемая человеческим глазом, редко соответствует молярности меньше 10-5 [13]. Комплексообразование происходит в кислой среде(ацетатный буфер), иногда реакции протекают медленно, как например с EDTA (рН=2,5 t=600С) и требуют подбора оптимальных условий [23]. Известны соединения Fe(III) с диоксинами. Эти комплексы являются малопрочными. Как правило, они образуются в кислой среде. Салицилальдоксим и его производные используют для определения железа(III)(количество железа в слое раствора с поперечным сечением 1см2, дающее экстинкцию 0,001 составляет 0,011г/см2 при λмах=480нм рН=6,2-6,6 [24]). Метод малоселективен, мешают оксикислоты, фосфат-, борат-, цианидионы и многие катионы. Чаще используют 2-окси5-метилпропиофеноксим как в кислой среде(рН=2, λмах=580нм, Fe:H2L=1:1), так и в щелочной (рН=8-9, λмах=480-510нм, Fe:H2L=1:3). При использовании таких соединений для спектрофотометрического определения железа(Ш), свинец и никель могут присутствовать в750-кратных, хром и кобальт-500-кратных, медь-25-кратных количествах [22]. В водных растворах используют комплексообразование железа (III) с оксиэтилидендифосфоновой кислотой (ОЭДФ), т.к. при этом образуются устойчивые комплексы, которые существуют в широком интервале рН [25]. Для определения железа и ряда других металлов (Cu, Ga, Sc, Zr, Co, Ni, Zn, Cd, Pb, V, Th) применяют глицинтимоловый синий [26]. Известно, что ГТС является чувствительным и избирательным (но не специфичным) спектрофотометрическим реагентом на медь. Большинство других катионов взаимодействует слабо, и многие из них не вызывают заметного мешающего влияния, однако это не ограничивает возможность применения этого реагента и для обнаружения этих элементов, в т.ч. и для Fe(III) [20]. Cреди фотометрических методов наиболее чувствительный и широко применяемый, метод с хромазуролом-S. Комплекс железа(III) с данным реактивом характеризуется спектром поглощения с λопт=575 нм и молярным коэффициентом светопоглощения ε=4,3·104, рН=4,0. Недостатками этого метода являются невысокая чувствительность (13 мкг/л) и низкая избирательность. Определению мешают Cu, Co, Ni, Zn, Pb, Ti, Cr, Al, Ga, In и Ge [27]. 4-(2-пиридилазо)-резорцин (ПАР) применяется для фотометрического определения железа(III) в природной воде. При рН 8,0 - 9,3 образуется комплексное соединение с λопт=530 нм и ε=6,04·104. Предел обнаружения железа 9,3 мкг/л. Но данный метод отличается низкой избирательностью, определению мешают Cu, Ag, Zn, Cd, Hg, Al, Ga, In, Tl, Sc, J, La, Ce(III), Sn(IV) и для устранения их влияния следует добавлять в исследуемый раствор маскирующие реагенты, что снижает точность и чувствительность анализа. Для повышения селективности метода используют экстракционно-фотометрический вариант, который применен для определения железа в морской воде [27]. Анализ литературных данных по комплексообразованию железа с органическими реагентами показал, что есть сведения о комплексообразовании Fe(III) c ПАР, но нет информации о составе комплекса и его устойчивости. Поэтому представляло интерес исследовать эту фотометрическую реакцию, а также возможность ее применения для фотометрического определения Fe(III) в реальных объектах, в частности – в пищевых продуктах. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
