КОМПЛЕКСООБРАЗОВАНИЕ В СИСТЕМЕ: Fe (III) – ПИРИДИЛАЗОРЕЗОРЦИН. Федеральное агенство по образованию рф гоу впо бурятский государственный университет
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
Глава II. Комплексообразование в системе: Fe(III) – пиридилазорезорцинПриборы и реактивы. Исходный раствор Fe(III) с концентрацией 10-2 моль/ дм3 готовили путем растворения навески Fe2(SO4)3(NH4)2SO4*24H2O (m=0,4822 г) в дистиллированной воде (Vк=100 см3). Рабочий раствор получали разбавлением исходного дистиллированной водой. Раствор ПАР с концентрацией 10-2 моль/ дм3 готовили путем растворения навески реагента m=0,255 г в дистиллированной воде (Vк=100 см3) (рабочие растворы готовили разбавлением соответствующей аликвоты исходного раствора). Растворы солей металлов (Zn2+, Cu2, , Cd2+, Pb2+ , Со2+, Ni2+, Mn2+с концентрацией 1∙10-2 моль/дм3 готовили путем растворения точной навески в дистиллированной воде (Vк.=100см3). Боратный буфер[28]. Растворы кислот (соляной, азотной), аммиака: а) с концентрированные: ρ(HCl) = 1,176г/см3, ρ(HNO3) = 1,760г/см3, ρ(NH4OH) = 0,903г/см3 б) с концентрацией 0,1моль/ дм3. Для контроля рН растворов использовали иономер рН Эконикс Эксперт-001 со стеклянным электродом. Спектры поглощения снимали на фотоколориметре КФК-3-01, кюветы стеклянные. 2.1. Спектрофотометрическое исследование аналитических характеристик пиридилазорезорцина П 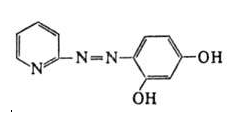 АР [4-(2-пиридилазо)резорцин] является двухосновной пятидентатной кислотой. АР [4-(2-пиридилазо)резорцин] является двухосновной пятидентатной кислотой.В сильнокислой среде он находится в протонированной форме и его растворы окрашены в желтый цвет. С понижением кислотности происходит депротонирование реагента, и в щелочной среде, где диссоциирует фенольный гидроксил, его растворы окрашиваются в оранжевый цвет. С целью расчета констант диссоциации реагента были сняты его спектры поглощения в широком интервале рН. 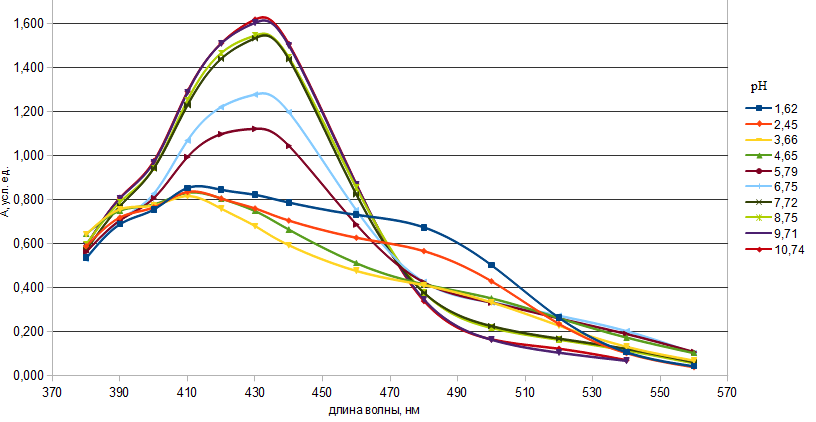 Рис.1. Спектры поглощения ПАР в зависимости от рН (СПАР = 5*10-5 моль/ дм3, l=10мм) По спектрам поглощения видно, что полосы поглощения имеют два максимума: четко выраженный при длине волны 430 нм и сглаженный – при 410 нм. На основе спектров поглощения были построены кривые зависимости оптической плотности от рН при различных длинах волн (рис.2), выбранных по методу Адамовича [29]. 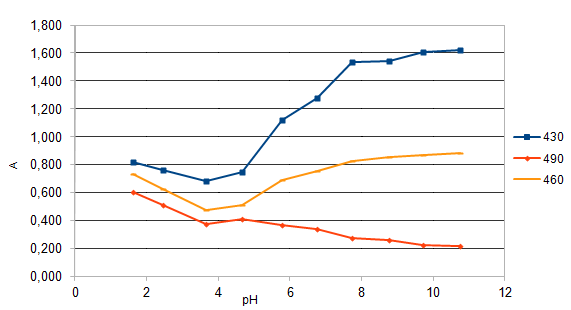 Рис.2. Зависимость оптической плотности ПАР от рН при различных длинах волн (СПАР = 5*10-5 моль/ дм3, l=10мм) Исходя из этих кривых были рассчитаны константы диссоциации реагента по методу Комаря [29]. 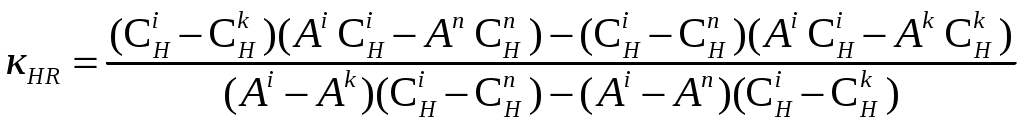 Где i,n,k – номера опытов; СН — равновесные концентрации ионов водорода; Аi,Аn,Аk —соответствующие им оптические плотности. Результаты приведены в таблице 5. Константы диссоциации соответствуют следующим равновесным (учитывая что в сильнокислой области реагент находится в протонированной форме H4R2+): H4R2+↔ H++H3R+ K4=[H3R+][H+]/[ H4R2+] H3R+↔ H++H2R K5=[H2R][H+]/[ H3R+] H2R↔ H++HR- K6=[HR-][H+]/[ H2R] HR-↔ H++R2- K7=[R2-][H+]/[ HR-] Таблица 5 Константы диссоциации ПАР
Так как одной из задач было исследование механизма комплексообразования железа с ПАР, необходимо было выяснить формы существования реагента в определенных областях рН. Для этого с использованием полученных констант, было рассчитано процентное содержание форм реагента при различных рН среды. В растворе ПАР существует в виде всех возможных форм, тогда общая аналитическая концентрация равна: Р  асчет равновесной концентрации каждой из форм осуществлялся по формулам: асчет равновесной концентрации каждой из форм осуществлялся по формулам:где СR=5∙10-4М Данный расчет позволил рассчитать доли каждой формы: α=Сравн./Сан.∙100%, где Сравн.- равновесная концентрация определяемой формы; Сан.-общая аналитическая концентрация реагента Процентное содержание форм ПАР в зависимости от рН представлены в табл. 6, а их графическая интерпретация на рис. 3. Таблица 6 Процентное содержание форм реагента при различных рН
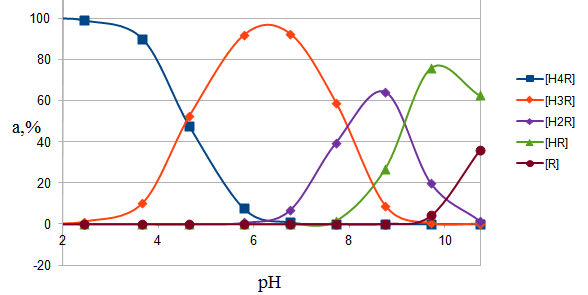 Рис. 3. Распределение форм ПАР в зависимости от рН 2.2. Исследование реакции комплексообразования железа с ПАР Анализ кривых светопоглощения растворов комплексов железа с ПАР, снятых в широком интервале рН позволил сделать вывод о том, что в системе образуется одно комплексное соединение. Максимум полосы поглощения данного комплекса находится при длине волны 540 нм. 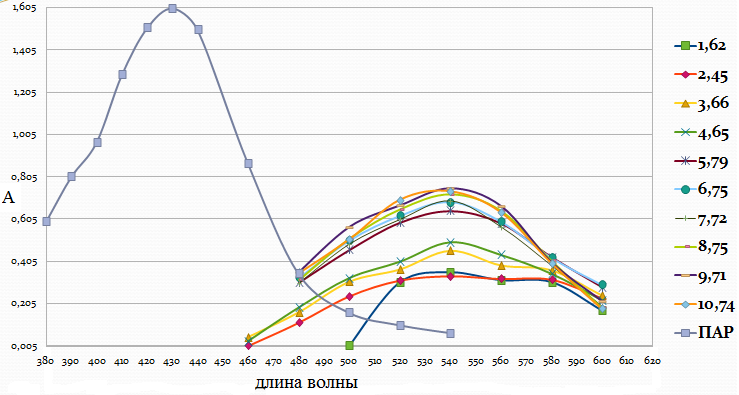 Рис. 4. Спектры поглощения комплекса Fe : ПАР в зависимости от рН раствора (CFe=1*10-5 моль/ дм3, СПАР = 5*10-5 моль/ дм3, l=10мм). 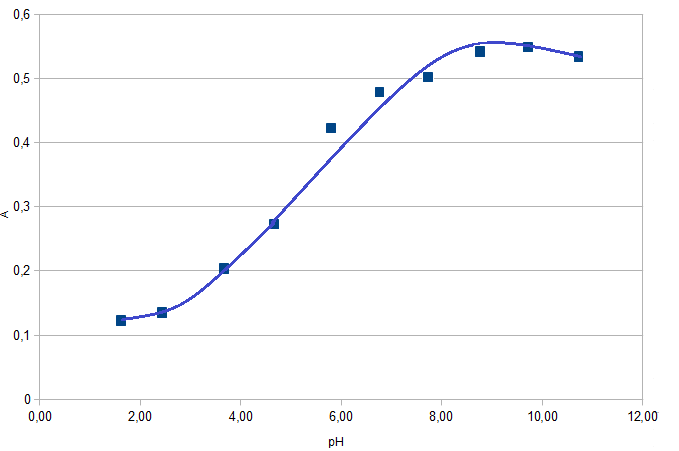 Рис. 5. Зависимость оптической плотности комплекса Fe с ПАР от рН при 540 нм. В условиях максимального светопоглощения был определен состав комплекса. Существует много способов определения состава комплексных соединений. Наиболее простым из них является метод изомолярных серий или метод Остромысленского-Жоба. Для определения состава комплекса этим методом были измерены оптические плотности с различным соотношением Fe : ПАР при постоянной концентрации железа и ПАР (рис. 6). 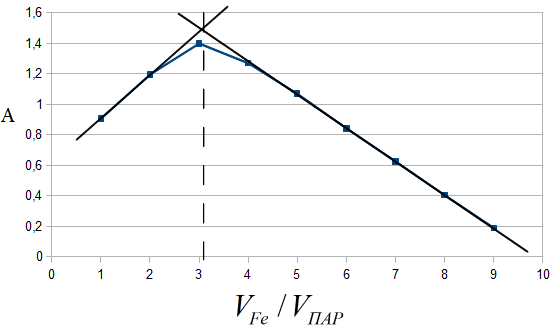 Рис. 6. Метод изомолярных серий ( CFe=СПАР = 1*10-4 моль/ дм3, l=10мм, λ=540 нм) Как видно из рисунка, соотношение Fe : ПАР=1:2. Однако методом изомолярных серий можно определить только простейшую — эмпирическую формулу соединения. Более информативным является метод насыщения (рис.7). Из рисунка видно, что насыщение и по реагенту, и по металлу указывает на образование комплекса состава Ме:R= 1:2. А 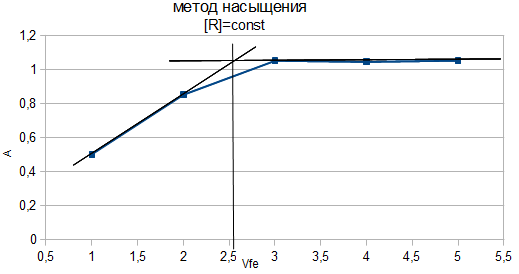 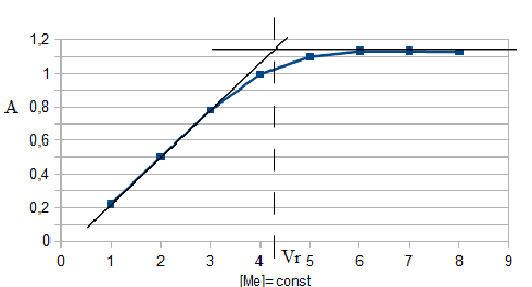 ) )Б) Рис. 7. Определение состава комплекса методом насыщения СFe=CR=1·10-4-исходные, рН=9,0, λ=590нм, Vоб=10см3, а) СR=const=5·10-5моль/ дм3 б) СFe=const=2·10-5моль/ дм3 Экспериментальные данные, полученные при определении состава комплексов методом насыщения, позволили применить расчетные методы: метод прямой линии Асмуса, метод сдвига равновесия и метод отношения наклонов (Гарвея- Меннинга) [29,30]. Данные этих методов приведены на рис. 8-10. 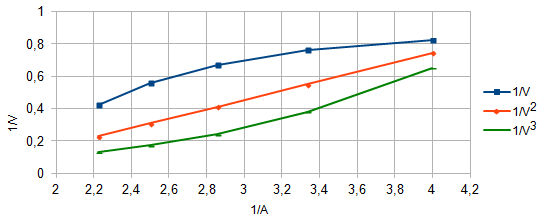 Рис. 8. Метод прямой линии Асмуса 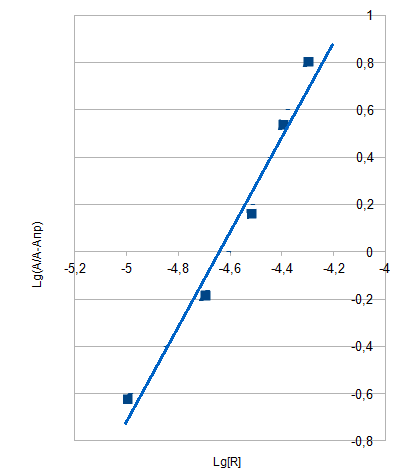 Р 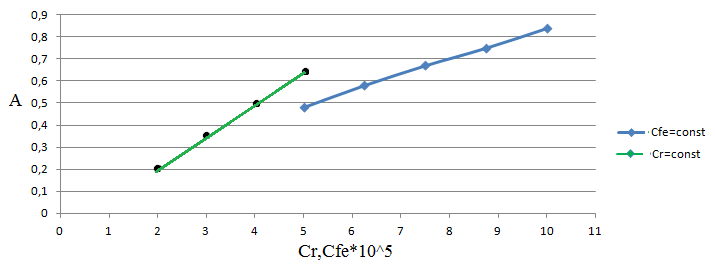 ис 9. Метод сдвига равновесия ис 9. Метод сдвига равновесияРис.10. Метод отношения наклонов (Гарвея-Меннинга) Из сопоставления кривых (рис.8) следует, что только n=2 удовлетворяет требованию прямолинейности функции Асмуса. Прямолинейная зависимость при n=2указывает на образование комплексного соединения состава 1:2. В методе сдвига равновесия (рис. 9) тангенс угла наклона прямой к оси абсцисс имеет значение, близкое к 2, что соответствует образованию комплекса состава 1:2. Метод Гарвея-Меннинга также соответствует соотношению компонентов в комплексе Fe-ПАР 1:2. Таким образом, различными методами показано, что соотношение компонентов в комплексе равно 1:2. Для установления вида образующегося комплекса и определения его константы устойчивости изучали зависимость оптической плотности от рН раствора. Общую схему комплексообразования ионов Fe с ПАР можно представить следующим образом: F Константа равновесия этой реакции равна где СFe , CL - равновесные концентрации железа и ПАР, Ск- концентрация комплекса, СН+- концентрация ионов водорода. Логарифмируя выражение (2): получаем уравнение прямой в координатах Графическое решение уравнения (4)дает возможность определить число протонов (n), участвующих в реакции комплексообразования. Р  авновесные концентрации металла и комплекса находили из зависимости оптической плотности от рН раствора (рис. 5) и рассчитывали по формулам: авновесные концентрации металла и комплекса находили из зависимости оптической плотности от рН раствора (рис. 5) и рассчитывали по формулам:где Ах и А0- оптическая плотность при полном и неполном связывании металла в комплекс, Сfe3+ и С0Fe3+- равновесная (при данном рН) и исходная концентрация Fe, СПАР и С0ПАР- равновесная (при данном рН) и исходная концентрация ПАР. Данные для определения числа протонов приведены в таблице 7. Графическая интерпретация представлена на рис. 11. Таблица 7 Определение числа протонов (С0Fe=2*10-4M, C0ПАР=5*10-4М, А0=0,565)
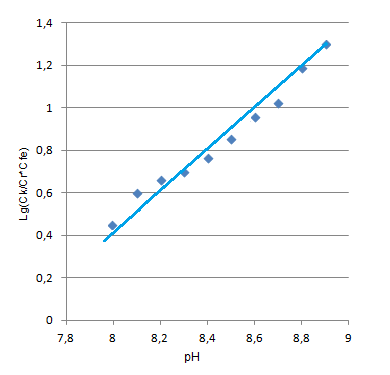 Рис. 11. Определение числа протонов (n=1) Тангенс угла наклона прямой равен 1, т.е. число протонов, выделяющихся при комплексообразовании равно 1. Вид иона металла, участвующего в реакции комплексообразования определяли по методу Назаренко [29]. Все расчеты проводили на основе зависимости оптической плотности от рН раствора. П 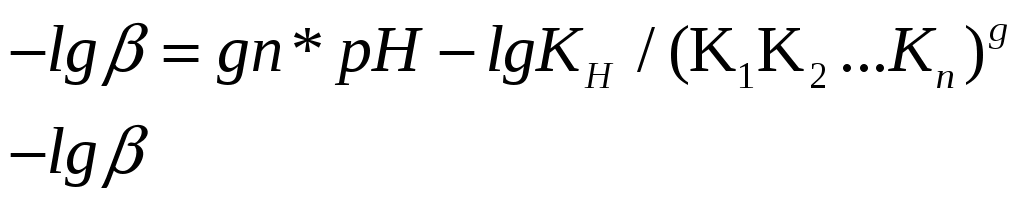 роцесс комплексообразования можно выразить химическим уравнением: роцесс комплексообразования можно выразить химическим уравнением:- является функцией рН, характеризующей степень закомплексованности металла в зависимости от рН; gn-угловой коэффициент прямой, равный произведению числа лигандов, координируемых ионом металла и числа ионов водорода, вытесняемых из молекулы лиганда ионом — комплексообразователем. Величину β можно выразить через равновесные концентрации металла и реагента с учетом констант диссоциации реагента и констант гидролиза металла. Константы гидролиза для железа были вычислены из соответствующих констант диссоциации гидроксида железа (III) [21,31]: КД1=[Fe(OH)+2][OH-]/[Fe(OH)3], КД1=4,80·10-11 КД2=[FeOH2+][OH-]/[Fe(OH)2+],КД2=1,82·10-11 КД3=[Fe3+][OH-]/[FeOH2+],КД3=1,50·10-12 Тогда, КГ1=КW/КД3, КГ1=6,70·10-3 КГ2=КW/КД2, КГ2=5,50·10-4 КГ3=КW/КД1, КГ3=2,10·10-4   Cк = КГ1=6,70∙10-3; КГ2=5,50∙10-4; К3=4,4∙10-7; К4=7,47∙10-10; К5=1,05∙10-11 [32]. Расчетные данные представлены в таблице 8, а графическая интерпретация - на рис. 12. Из рис.12 видно, что координирующим ионом в данном случае является Fe(OH)2+. Далее был установлен вид иона лиганда, входящего во внутреннюю сферу комплекса. Учитывая, что при рН=9 лиганд существует в виде двух форм [H2R] и [HR-], металл вступает в реакцию в форме Fe(OH)2+, и в результате образования депротонированного комплекса из молекулы лиганда вытесняется один протон, была изучена зависимость lgCК/СFe от рН раствора и сопоставлена с изменением концентраций форм ПАР: [HR-] и [H2R]. Равновесные концентрации рассчитывались по формулам:  С0ПАР - исходная концентрация ПАР, К1, К2, К3, К4, К5 - константы диссоциации ПАР. Расчетные данные приведены в таблице 8, графический вариант на рис.12. Таблица 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
