учеб пособие раб тетр к лаб 1 сем в электр библ(5). Федеральное агентство по науке и образованию
 Скачать 0.86 Mb. Скачать 0.86 Mb.
|
|
Опыт 3. Растворение осадков сульфидов меди (II) и железа (II) и произведение растворимости. К осадкам сульфидов меди (II) и железа (II), полученным в опыте 2 прилейте избыток 2 н. раствора соляной кислоты. - Отметить, какой из осадков растворился - Составить уравнение реакции в молекулярной и ионной форме 1) FeS + HCl → (краткое ионное уравнение) - По ионному уравнению составить выражение для константы равновесия и рассчитать её, используя значения произведений растворимости и констант диссоциации сероводородной кислоты. - Уравнения электролитической диссоциации сероводородной кислоты: 1 ст.: H2S → H+ + HS- ; K1(H2S) = [H+] [HS-] / [H2S] = 10-7 2 ст.: HS- → H+ + S2- ; K2(H2S) = [H+] [S2-] / [HS-] = 10-14 - Составить уравнение не протекающей реакции в молекулярной и ионной форме 2) CuS + HCl → (краткое ионное уравнение) - По ионному уравнению составить выражение для константы равновесия и рассчитать её, используя значения произведений растворимости и констант диссоциации сероводородной кислоты. - Объяснить различие в растворимости осадков FeS и CuS в растворе соляной кислоты, используя значения произведений растворимости, констант диссоциации сероводородной кислоты и рассчитанных констант равновесия. Уфимский государственный нефтяной технический университет Кафедра «Общая и аналитическая химия» Дисциплина «Общая и неорганическая химия» ОТЧЕТ по лабораторной работе №4 на тему: «Электролитическая диссоциация кислот и оснований. Водородный и гидроксильный показатели» Выполнил студент группы__________ ______________ Фамилия И.О. (Подпись, дата) Принял доцент кафедры ОАХ ______________ (Подпись, дата) Цель работы: - изучить закономерности протекания электролитической диссоциации кислот и оснований в водном растворе; Краткая теория Кислота Аррениуса – это … Кислота Бренстеда – это … Сильные кислоты диссоциируют в растворе …. Слабые кислоты диссоциируют в растворе …. К сильным кислотам относятся: Основание Аррениуса – это … Основание Бренстеда – это …. Сильные основания диссоциируют в растворе …. Слабые основания диссоциируют в растворе …. К сильным основаниям относятся: Вода – ……………….электролит, проявляет …………………свойства. Уравнение диссоциации воды: Ионное произведение воды: Водородный показатель (рН) – это… Гидроксильный показатель (рОН) – это… Водородный показатель (рН) характеризует … В нейтральной среде: [H+] = [OH–] = ; рН = В кислой среде: [H+] [OH–]; рН В щелочной среде: [H+] [OH–]; рН рН – Индикаторы – это…. Задача 1. Рассчитать концентрацию Н+– ионов и рН- 0,1 М раствора HCl. Задача 2. Рассчитать концентрацию ОН-– ионов и рН- 0,1 М раствора NaOH. Задача 3. Рассчитать степень диссоциации, концентрацию Н+– ионов и рН 0,1 М раствора CH3COOH. Задача 4. Рассчитать степень диссоциации, концентрацию Н+– ионов и рН 0,1 М раствора CH3COOH, содержащего в 1 литре 0,1 моль CH3COONa. Задача 5. Рассчитать степень диссоциации, концентрацию ОН-– ионов и рН- 0,1 М раствора NH4OH. Задача 6. Рассчитать степень диссоциации, концентрацию ОН-– ионов и рН- 0,1 М раствора NH4OH, содержащего в 1 литре 0,1 моль NH4Cl. Опыт 1. Водородный показатель и электролитическая диссоциация кислот и оснований Испытуемые растворы: HCl, CH3COOH, NaOH, NH4OH. На предметное стекло положить четыре полоски универсального индикатора, нанести на каждую из них по 1 капле испытуемых растворов и тотчас сравнить окраску бумаги с эталонной шкалой универсального индикатора. - Записать значения рН в испытуемых растворах; - рассчитать концентрацию ионов Н+ в испытуемых растворах: [H+] = 10- рН; - рассчитать гидроксильный показатель в испытуемых растворах: рОН = (14 – рН); - рассчитать концентрацию ОН– ионов в испытуемых растворах: [OH–] = 10- рОН; - заполнить таблицу:
- кислотные свойства проявляют вещества: - основные свойства проявляют вещества: - сравнить рН и концентрации ионов [H+] в растворах кислот; какая из них лучше диссоциирует на ионы; в каком направлении смещены равновесия диссоциации HCl и CH3COOH; - составить выражение и привести значение константы диссоциации слабой кислоты 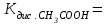 - как связаны рН и сила кислоты для растворов с одинаковыми концентрациями кислот HCl и CH3COOH; - сравнить рН и концентрации ОН– ионов в растворах оснований, какое из них лучше диссоциирует на ионы, в каком направлении смещены равновесия диссоциации NH4OH и NaOH; - составить выражение и привести значение константы диссоциации слабого основания 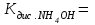 …; …;- как связаны рН и сила основания для растворов с одинаковыми концентрациями оснований NaOH и NH4OH. Опыт 2. Электролитическая диссоциация слабой кислоты в присутствии её соли Налить в две пробирки по 6 капель раствора уксусной (CH3COOH) кислоты и по 1-2 капли раствора метилового оранжевого. Затем в одну из пробирок добавить один микрошпатель кристаллического ацетата натрия (CH3COONa). Пробирку встряхнуть несколько раз. Наблюдать ослабление интенсивности окраски раствора. - Объяснить появление интенсивной окраски метилоранжа в растворе уксусной кислоты; в какой среде метилоранж окрашивается в красный цвет, на присутствие каких ионов в растворе указывает окраска метилоранжа; - составить уравнение диссоциации уксусной кислоты CH3COOH - составить уравнение диссоциации ацетата натрия CH3COONa - объяснить, о чем свидетельствует изменение окраски метилоранжа после добавления ацетата натрия; - объяснить, как изменилась кислотность раствора после добавления ацетата натрия к раствору уксусной кислоты; - используя принцип Ле Шателье, ответить, в каком направлении смещается равновесие диссоциации CH3COOH после добавления CH3COONa (т.е. увеличения концентрации CH3COO-), как это изменяет концентрацию Н+– ионов в растворе и рН-раствора. Опыт 3. Электролитическая диссоциация слабого основания в присутствии его соли Налить в две пробирки по 6 капель раствора гидроксида аммония и по 2 капли раствора фенолфталеина. Затем в одну из пробирок добавить один микрошпатель кристалличекого хлорида аммония. Пробирку встряхнуть несколько раз. Наблюдать ослабление интенсивности окраски раствора. - Объяснить появление интенсивной малиновой окраски фенолфталеина в растворе гидроксида аммония; в какой среде фенолфталеин окрашивается, на присутствие каких ионов в растворе указывает окраска фенолфталеина; - составить уравнение диссоциации гидроксида аммония NH4OH - составить уравнение диссоциации хлорида аммония NH4Cl - объяснить, о чем свидетельствует ослабление окраски фенолфталеина после добавления хлорида аммония; - объяснить, как изменилась щелочность раствора после добавления хлорида аммония к раствору гидроксида аммония; - используя принцип Ле Шателье, ответить, в каком направлении смещается равновесие диссоциации NH4OH после добавления NH4Cl (т.е. увеличения концентрации NH4+), как это изменяет концентрацию ОН-– ионов в растворе и рН - раствора. Уфимский государственный нефтяной технический университет Кафедра «Общая и аналитическая химия» Дисциплина «Общая и неорганическая химия» ОТЧЕТ по лабораторной работе №5 на тему: «Гидролиз солей» Выполнил студент группы__________ ______________ Фамилия И.О. (Подпись, дата) Принял доцент кафедры ОАХ ______________ (Подпись, дата) Цель работы: - изучить закономерности протекания гидролиза солей; - научиться составлять молекулярные и ионные уравнения гидролиза. Краткая теория. Гидролиз соли - … Гидролиз соли – это реакция …………………реакции нейтрализации. Гидролиз соли протекает, если продуктами являются ……………….кислота и/или …………………..основание 1. Не подвергаются гидролизу соли, образованные ………………….. и ……………… основанием. В растворе соли, образованной сильной кислотой и сильным основанием ………………….среда и рН = ……. 2. Соли, образованные слабым основанием и сильной кислотой подвергаются гидролизу по……………….. Составьте молекулярное уравнение гидролиза соли NH4Cl Составьте ионное уравнение гидролиза соли NH4Cl Чем слабее основание, тем ………………….гидролизуется его соль В растворе соли, образованной слабым основанием и сильной кислотой среда ………………………….... и рН 3. Соли, образованные сильным основанием и слабой кислотой подвергаются гидролизу по……………….. Составьте молекулярное уравнение гидролиза соли NaF Составьте ионное уравнение гидролиза соли NaF В растворе соли, образованной сильным основанием и слабой кислотой среда …………………………. и рН Чем слабее кислота, тем …………………. гидролизуется её соль 4. Соли, образованные слабым основанием и слабой кислотой подвергаются гидролизу по……………….. Составьте молекулярное уравнение гидролиза соли NH4F Составьте ионное уравнение гидролиза соли NH4F В растворе соли, образованной слабым основанием и слабой кислотой среда ……………………. и рН Количественно процесс гидролиза характеризуется: Константа гидролиза – это …. Запишите выражение для константы гидролиза соли а) NH4Cl б) NaF в) NH4F Степень гидролиза – это ….. Опыт 1. Определение рН в растворах солей Испытуемые растворы: MgCl2, CuSO4, Na2CO3, NaCl. Определить рН растворов солей. На чистое сухое предметное стекло положить четыре полоски универсального индикатора, нанести на каждую из них по 1 капле испытуемых растворов и сравнить окраску бумаги с эталонной шкалой рН универсального индикатора. - Записать значения рН, указать, какая среда в испытуемых растворах;
- гидролиз не протекает в растворе соли………. - гидролиз по катиону протекает в растворах солей………. - составить уравнение гидролиза MgCl2 в молекулярной и ионной форме: 1 стадия: MgCl2 + H2O (краткое ионное уравнение) 2 стадия: MgOHCl + H2O (краткое ионное уравнение) - составить уравнения гидролиза CuSO4 в молекулярной и ионной форме: 1 стадия: CuSO4 + H2O (краткое ионное уравнение) 2 стадия: (CuOH)2SO4 + H2O (краткое ионное уравнение) - ответить, какая стадия (1-я или 2-я) протекает в большей степени; - ответить, используя значения рН в растворах, какая соль MgCl2 или CuSO4 гидролизуется в большей степени; - ответить, как связаны сила основания и склонность его солей к гидролизу по катиону; - по результатам гидролиза солей MgCl2 и CuSO4 сравнить основные свойства соответствующих гидроксидов: Mg(OH)2 и Cu(OH)2: - гидролиз по аниону протекает в растворах солей: - составить уравнение гидролиза Na2CO3 в молекулярной и ионной форме 1 стадия: Na2CO3 + H2O (краткое ионное уравнение) 2 стадия: NaHCO3 + H2O (краткое ионное уравнение) - составить выражения для констант гидролиза Na2CO3 по 1-й и по 2-й стадии: 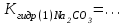 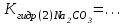 - рассчитать константы гидролиза Na2CO3 по 1-й и по 2-й стадии, используя значения констант диссоциации для угольной кислоты 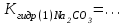 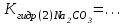 - ответить, какая стадия гидролиза Na2CO3 протекает в большей степени; - ответить, в каком направлении смещено равновесие гидролиза соли Na2CO3 - ответить, в испытуемых растворах протекает частичный или полный гидролиз. Вывод: |
