|
|
Обмен липидов. Функции липидов жестко связаны с их строением
Для синтеза фосфолипидов нужны липотропные факторы Синтез фосфолипидов
Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов ФЛ – фосфатидной кислоты или холина и этаноламина.
1 путь – "спасательный"
Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. Активация холина (или этаноламина) происходит через промежуточное образование фосфорилированных производных с последующим присоединением ЦМФ. В следующей реакции фосфохолин (или фосфоэтаноламин) переносится на ДАГ. Этот путь особенно характерен для легких и кишечника, но идет и в других тканях.
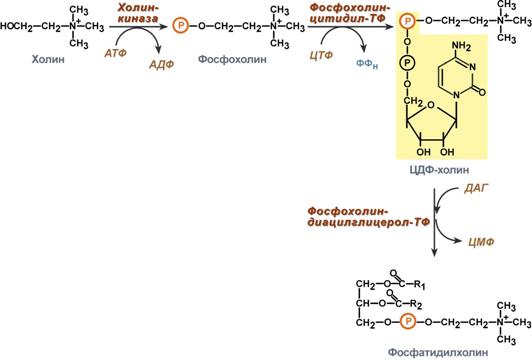
Реакции синтеза фосфолипидов
с использованием 1,2-ДАГ на примере фосфатидилхолина
2 путь – синтез de novo.
Здесь холин не встраивается в готовом виде, а образуется в ряде реакций. Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин.
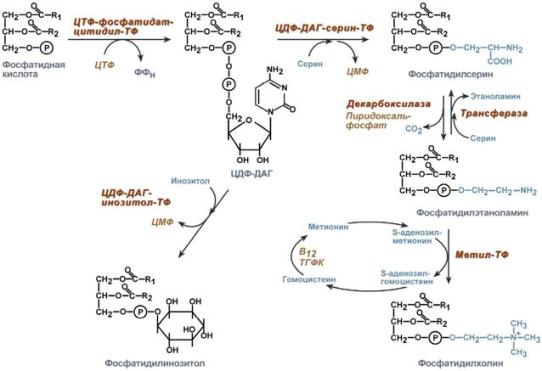
Реакции синтеза фосфолипидов
с использованием фосфатидной кислоты 3 путь – обратное превращение
Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина.
Липотропные вещества
Все вещества, способствующие синтезу ФЛ и препятствующие синтезу ТАГ, называются липотропными факторами. К ним относятся:
1. Структурные компоненты фосфолипидов: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин.
2. Метионин – донор метильных групп для синтеза холина и фосфатидилхолина (каким образом?).
3. Витамины:
пиридоксин (В6), способствующий образованию ФЭА из ФС.
цианкобаламин (В12) и фолиевая кислота, участвующие в образовании активной формы метионина, и, следовательно, в синтезе фосфатидилхолина.
При недостатке липотропных факторов в печени начинается жировая инфильтрация печени.
Обмен жирных кислот и ТАГ регулируется
Гормональная регуляция
Синтез и окисление триацилглицеролов и жирных кислот зависит от соотношения инсулин/глюкагон.
1. Изменение количества ферментов
Ферменты комплекса пальмитатсинтазы и ацетил-SКоА-карбоксилазы являются адаптивными ферментами, количество их возрастает при усиленном питании и уменьшается при голодании и потреблении жира. Индуктором биосинтеза этих ферментов является инсулин.
2. Ковалентная модификация
Благодаря инсулину, глюкагону, адреналину, тиреотропному и адренокортикотропному гормонам происходит ковалентная модификация ферментов ацетил-SКоА-карбоксилазы и ТАГ-липазы путем фосфорилирования-дефосфорилирования.
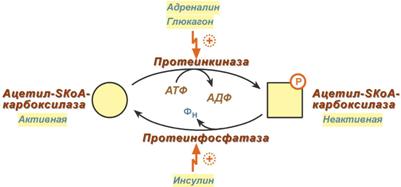
Регуляция активности ацетил-SКоА-карбоксилазы
Инсулин активирует протеинфосфатазу и способствует дефосфорилированию и активации ацетил-SКоА-карбоксилазы. Одновременно в клетке дефосфорилируется и инактивируется ТАГ-липаза.
Глюкагон, адреналин или другие гормоны, действуя по аденилатциклазному механизму с участием цАМФ-зависимой протеинкиназы, вызывают фосфорилирование и ингибирование ацетил-SКоА-карбоксилазы и, следовательно, останавливают липогенез. Одновременно они активируют ТАГ-липазу (механизм).
При уменьшении количества инсулина и возрастании глюкагона усиливаются липолиз в жировой ткани, поступление жирных кислот в печень и другие ткани и реакции их β-окисления. Такое состояние наблюдается при гипогликемии любого происхождения. При обратном соотношении гормонов начинаются реакции синтеза жиров.
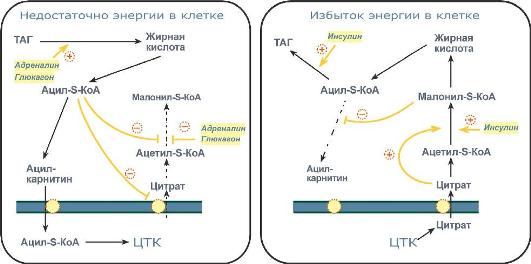
Способы регуляции реакций обмена триацилглицеролов
Метаболическая регуляция
В регуляции синтеза и окисления жирных кислот играют роль три участка:
1. Активность ацетил-SКоА-карбоксилазы регулируется:
цитратом – аллостерический активатор фермента, накапливается в цитозоле при избыточном количестве энергии,
ацил-SКоА по принципу обратной отрицательной связи ингибирует фермент, препятствуя синтезу малонил-SКоА. Т.е. если ацил-SКоА не успевает вступить в этерификацию или усиливается липолиз в клетке или увеличивается поступление жирных кислот извне, то автоматически блокируется синтез новых жирных кислот.
2. Транспорт цитрата из митохондрии в цитозоль подавляется избытком ацил-SКоА, это снижает синтез жирных кислот.
3. Карнитин-ацилтрансфераза ингибируется при образовании малонил-SКоА, что останавливает поступление ацил-SКоА внутрь митохондрий и снижает β-окисление.
Таким образом, когда имеется избыток энергии, то усиление синтеза жирных кислот достигается при поступлении цитрата и при наличии малонил-S-КоА. После синтеза молекулы ацил-SКоА быстро поступают на этерификацию глицерола до ТАГ и не накапливаются в цитозоле.
Если в клетке недостаточно энергии, то необходимо активировать β-окисление жирных кислот для ее получения. В этом случае гормональные влияния вызывают липолиз (или поступление жирных кислот извне) и накопление ацил-SКоА в цитозоле, что автоматически (см пункт 2) через уменьшение количества цитрата и малонил-SКоА препятствует синтезу новых жирных кислот. Параллельно (см пункт 3) убыль малонил-SКоА и активация карнитин-ацил-трансферазы запускает β-окисление.
Попавшая в митохондрию жирная кислота неизбежно окисляется до ацетил-SКоА.
При появлении избытка ацетильных групп и накоплении АТФ в митохондриях печени они перенаправляются на синтез кетоновых тел.
|
|
|
 Скачать 1.24 Mb.
Скачать 1.24 Mb.



