Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
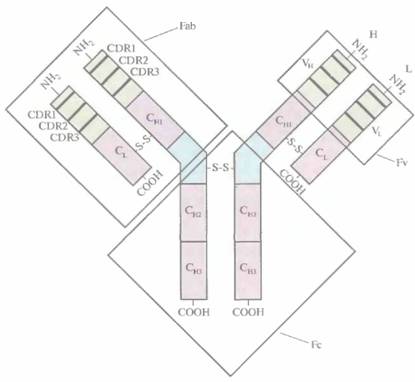
Моноклональные антитела как лекарственные средстваПримерно 100 лет назад была предпринята попытка лечения детей, больных дифтерией, с помощью неочищенной антисыворотки, получен-
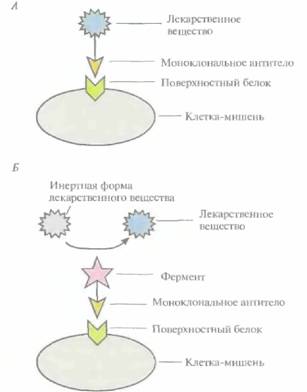
Микробиологическое производство лекарственных средств 211 ной от лошадей, которых инфицировали Corynebacieriumdiphtheriae, вызывающей дифтерию у человека. С. diphtheriae инфицирует горло и миндалины, выделяя экзотоксин, приводящий к гибели клеток человека. Проникая в кровоток, этот токсин поражает органы, удаленные от места первичной инфекции, и в отсутствие лечения болезнь может иметь летальный исход. (В те времена, о которых идет речь, смертность достигала 45%.) Однако, если больному в первые несколько дней после начала инфекции ввести лошадиную антисыворотку, содержащую антитела к этому экзотоксину, то у него возникнет пассивный иммунитет, который позволяет избежать летального исхода. К сожалению, риск, связанный с использованием антител, не позволяет широко применять этот метод терапии. Дело в том, что в организме больного часто вырабатываются собственные антитела на чужеродные белки, присутствующие в цельной или частично очищенной антисыворотке, и ее повторное введение в случае сенсибилизации организма может привести к развитию анафилактического шока и гибели пациента. С развитием гибридомной технологам вновь появилась надежда на то, что антитела можно будет использовать в качестве терапевтических средств для поддержания постоянного уровня чистых моноспецифичных антител в организме. Однако остаются проблемы, связанные с риском развития перекрестных реакций, приводящих к развитию иммунного ответа и анафилаксии: ведь в организме бального могут вырабатываться собственные антитела на детерминанты монокло-нальных антител мыши. Поэтому основная задача в настоящее время состоит в том, чтобы разработать методы получения моноклональных антител человека, обладающих как специфическими иммунотерапевтическими свойствами, так и пониженной иммуногенностью. Структура и функции антителМолекула антитела (иммуноглобулин) состоит из двух «легких» (L) и двух «тяжелых» (Н) белковых цепей, которые соединены водородными связями и расположенными в строго определенных местах дисульфидными мостиками. N-концевые участки L- и Η-цепей образуют антигенсвязывающий сайт. Отдельные домены (области) молекулы антитела выполняют разные функции, что облегчает манипуляции с генами антител (рис. 10.5). Антигенсвязывающие сайты состоят из трех участков, определяющих комплементарность антител к антигену (CDR, от англ, complementarity-determining regions), и образующих вариабельные (VH и Vl) области на N-концах Н- и L-цепей. Для CDR характерна очень высокая изменчивость последовательности аминокислот, поэтому их еще называют гипервариабельными. Помимо вариабельных (VH и Vl), каждая L-цепь содержит одну константную область, или домен (CL), a каждая Η-цепь -три константных области, или домена (СH1, СН2 и СH3). При обработке антитела протеолитическим ферментом папаином образуются три фрагмента: два идентичных (Fab), каждый из которых содержит интактную L-цепь, связанную дисульфидным мостиком с vh- и СH1-доменами Н-цепи, и один Fc, состоящий из двух соединенных дисульфидной связью СН2- и Сн3-доменов Н-цепи, Fab-фрагмент, точнее его N-концевая часть, называемая Fv-фрагментом, обладает антигенсвязывающей активностью, присущей интактной молекуле антитела (рис. 10.5). При этом его аминокислотная последовательность у разных молекул существенно различается. После связывания антигена с интактным антителом запускаются следующие реакции иммунного ответа. • Активируется система комплемента. Компоненты этой системы разрушают клеточные мембраны, активируют фагоциты и генерируют сигналы, мобилизующие другие компоненты системы иммунного ответа. • В результате связывания Fc-участка антитела с Fc-рецептором эффекторной клетки запускается реакция опосредованной антителами клеточной цитотоксичности. Активированная эффекторная клетка высвобождает вещества, лизирующие чужеродную клетку, с которой связан Fab-участок молекулы антитела. • После связывания Fab-участка с растворимым антигеном Fc-участок антитела может присоединяться к Fc-рецепторам фагоцитов, которые захватывают и разрушают комплекс антиген—антитело. 212 ГЛАВА 10 Профилактика отторжения трансплантированных органовВ 1970-х гг. были пересмотрены взгляды на пассивную иммунизацию: ее стали считать профилактическим средством борьбы с отторжением трансплантированных органов. Предлагалось вводить пациентам специфические антитела, которые будут связываться с лимфоцитами определенного типа, уменьшая иммунный ответ, направленный против пересаженного органа. Первыми веществами, рекомендованными Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) для использования в качестве иммуносупрессоров при пересадке органов у человека, были моноклональные антитела мыши ОКТЗ. За отторжение органов отвечают так называемые Т-клетки — лимфоциты, дифференцирующиеся в тимусе. ОКТЗ связываются с рецептором, находящимся на поверхности любой Т-клетки, который называется CD3. Это предупреждает развитие полного иммунного ответа и отторжение трансплантированного органа. Подобная иммуносупрессия весьма эффективна, хотя и оказывает некоторые побочные действия, например вызывает лихорадку и приводит к появлению сыпи. Лекарственные вещества, связанные с моноклональными антителамиЛекарственные вещества, проявляющие высокую ахтивность при тестировании in vitro (обычно в культуре клеток), зачастую оказываются значительно менее эффективными in vivo. Кажущееся снижение их активности объясняется тем, что они не достигают органа или клетки-мишени в нужной концентрации. Увеличение дозы принимаемого препарата не решает проблему, поскольку при этом часто возникают побочные эффекты. Более того, чтобы избежать таких эффектов, многие терапевтические средства заведомо вводят в дозах, не достигающих оптимальных, что дополнительно снижает их эффективность. Для облегчения доставки лекарственного вещества к месту его действия используют несколько приемов. 1. Заключают его в особые частицы — липосомы, липидная обо-
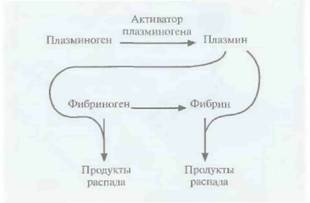
Микробиологическое производство лекарственных средств 213 лочка которых имеет высокое сродство к нужным органам. 2. Встраивают гены специфических токсинов в инфильтрирующие опухоль лимфоциты, которые высвобождают эти токсины непосредственно в опухоли. 3. Присоединяют молекулы лекарственных веществ к моноклональным антителам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например опухолевых (рис. 10.6). 4. Используют лекарственные вещества в неактивной форме, переводя их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют к моноклональному антителу, специфичному к поверхностному антигену этой клетки (рис. 10.6). Для эффективной работы последней из описанных систем необходимо, чтобы а) моноклональное антитело, связанное с ферментом, переводящим лекарственное вещество в активную форму, было в достаточной степени очищено и имелось в нужном количестве; б) связывалось с высокоспецифичным для клетки-мишени белком; в) было стабильным в физиологических условиях, но в то же время быстро выводилось из кровотока; 2) при необходимости могло проникать в опухолевую ткань, обеспечивая действие препарата на все ее клетки. В этом случае мишенями оказываются строго определенные клетки, что позволяет использовать лекарственное вещество в гораздо меньших дозах, чем при прямом введении. Применение в такой системе моноклональных антител мыши может приводить к развитию иммунного ответа, поэтому очень важно использовать фрагменты антител человека или антител, максимально сходных с ними по структуре. Наиболее частой причиной смерти в странах Северной Америки и Европы является тромбоэмболия мозговых или сердечных артерий. Тромб состоит из молекул фибрина, фактора свертывающей системы крови, образующего сеть в ответ на повреждение сосудистой стенки. E норме молекулы фибрина в образовавшемся тромбе расщепляются с помошью плазмина сериновой протеиназы, который образуется из плазминогена под действием активатора (рис, 10.7), Однако нередко эта биологическая
система работает недостаточно эффективно, что приводит к закупорке артерий. В таких ситуациях для повышения уровня плазмина в крови было предложено использовать активатор плазминогена в качестве терапевтического средства. Однако плазмин способен разрушать и предшественник фибрина фибриноген (рис, 10.7), и если уровень последнего в результате терапии с использованием активатора плазминогена снизится слишком сильно, могут произойти обширные внутренние кровотечения. Это привело к необходимости создания тромболитических препаратов, разрушающих только фибрин в 214 ГЛАВА 10
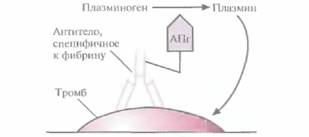
тромбе. Ученые исходили из того, что если к активатору плазминогена «пришить» антитело, специфичное к фибрину, то будет происходить только локальное повышение концентрации плазмина вблизи тромба (рис. 10.8). Для проверки этой гипотезы тканеспецифичный активатор плазминогена был присоединен к моноклональному антителу, специфичному в отношении фибрина. Испытания на модельных системах показали, что комплекс присоединялся к сгусткам крови и лизировал их, не вызывая значительного разрушения фибриногена. Были созданы и другие типы конъюгатов антитело—активатор плазминогена, тоже приводящие к локальному образованию плазмина, разрушающего кровяные сгустки.
|