Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
ГЛАВА 10. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 10.1. Некоторые белки человека, полученные генно инженерны ми методами | |
| Белок | Заболевание/Физиологический процесс |
| Адренокортикотропный гормон | Ревматизм |
| а, - Антитрипсин | Эмфизема |
| Бактерицидный/повышающий проницаемость белок | Различные инфекции |
| Гемоглобин | Анемия |
| Гормон роста (соматотропин) | Задержка роста |
| Инсулин | Сахарный диабет |
| Инсулиноподобный фактор роста | Сахарный диабет, почечная недостаточность |
| Интерлейкины | Злокачественное новообразование, иммунные заболевания |
| Интерфероны (α, β, γ) | Вирусные заболевания, злокачественное новообразование, |
| | рассеянный склероз |
| Кальцитонин | Остеомаляция |
| Лимфотоксин | Злокачественное новообразование |
| Нейротропный фактор, вырабатываемый в мозге | Боковой амиотрофическиЙ склероз |
| Релаксин | Роды |
| Рецептор интерлейкина- 1 | Астма, ревматоидный артрит |
| Соматолиберин | Задержка роста |
| Соматомедин С | Задержка роста |
| Сывороточный альбумин | Дефицит белков плазмы |
| Тиреотропный гормон | Рак щитовидной железы |
| Тканевой активатор плазминогена | Тромбообразование |
| Тромбоцитарный фактор роста | Атеросклероз |
| Урогастрон | Язвы |
| Уроки наза | Тромбообразование |
| Фактор, активирующий макрофаги | Злокачественное новообразование |
| Фактор некроза опухоли | Злокачественное новообразование |
| Фактор роста нервов | Повреждение нервной ткани |
| Фактор роста эпидермиса | Ожоги |
| Фактор VIII | Гемофилия |
| Фактор IX | Гемофилия |
| Факторы роста В-лимфоцитов | Иммунные заболевания |
| Колониестимулирующие факторы | Злокачественные новообразования |
| Хорионический гонадотропин | Женское бесплодие |
| Эндорфины и энкефалины | Боль |
| Эритропоэтин | Анемия, заболевания почек |
щего участка молекулы. Исходя из этого находят кодирующую его нуклеотидную последовательность, синтезируют соответствующий олигонуклеотид и используют его в качестве гибридиза-ционного зонда для выделения нужного гена или кДНК из геномных или кДНК-библиотек. Другой подход состоит в выработке антител к очищенному белку и использовании их для скрининга библиотек, в которых происходит экспрессия определенных генов. Для белков человека, синтезируемых преимущественно в какой-то одной ткани, кДНК-библиотека, полученная на основе мРНК, выделенной из этой ткани, будет обогащена последовательностью ДНК-мишени. Например, основным белком, синтезируемым клетками островков Лангерганса поджелудочной железы, является инсулин, и 70% мРНК, выделенных из этих клеток, кодируют именно его. Однако принцип обогащения кДНК неприменим для тех белков человека, количество которых очень мало или место синтеза которых неизвестно. В этом случае могут понадобиться другие экспериментальные подходы. Интерфероны (ИФ) человека, включающие α-, β- и γ-интерфероны (ИФα, ΗΦβ, ИФγ), — это природные белки, каждый из которых может найти свое терапевтическое применение (табл. 10.3), При выделении их кДНК пришлось разработать новый подход, позволяющий преодолеть трудности, связанные с недостаточным содержани-
206 ГЛАВА 10
| Таблица 10.2. Некоторые рекомбинантные белки, получившие разрешение Департамента по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) на применение для лечения заболеваний человека | ||
| Белок | Фирма | Заболевание |
| Антигемофильный фактор | M ilex, Baxter Healthcare, | Гемофилия А |
| | Genetics Institute | |
| Глюкоцереброзидазa | Genzynie | Болезнь Гоше |
| Гормон роста | Cenentech | Дефицит гормона роста у детей |
| ДНКаза I | Genentech | Муковисцидоз |
| Инсулин | Eli Lilly | Сахарный диабет |
| Интерлейкин-2 | Chiron | Рак почки |
| ИФ2а | Hoffmann- La Roche | Волосистая лейкоплакия, саркома Капоши |
| ИФ2b | Schering-Plough | Волосистая лейкоплакия, остроконечная кондилома, саркома Капоши, гепатиты В и С |
| ИФn3 | Interferon Sciences | Остроконечная кондилома |
| ИФβ1b | Berlex Laboratories and Chiron | Рецидивирующий рассеянный склероз |
| ИФγ1b | Genentech | Хронический гранулематоз |
| Соматотропин | Eli Lilly | Дефицит гормона роста |
| Тканевой активатор плазминогена | Genentech | Острый инфаркт миокарда, острая обширная эмболия легочной артерии |
| Эритропоэтин | Amgen and Ortho Biotech | Анемия, заболевания почек |
ем соответствующих мРН К и белков. Процедура выделения кДНК интерферонов состояла в следующем.
1. Из лейкоцитов человека выделили мРНК и фракционировали ее по размерам; провели обратную транскрипцию и встроили в сайт PstIплазмиды pBR322.
2. Полученным продуктом трансформировали Escherichia coli. Образовавшиеся 6000 клонов подразделили на 12 групп; по 512 клонов в каждой. Тестирования проводили на группе клонов, что позволило ускорить процесс их идентификации.
3. Каждую группу клонов гибридизовали с неочищенным препаратом ИФ-мРНК,
4. Из образовавшихся гибридов, содержащих клонированную ДНК и мРНК, выделили мРНК и провели ее трансляцию в бесклеточной системе синтеза белка.
5. Определили интерферонную противовирусную активность каждой смеси, полученной в результате трансляции. Группы, проявившие интерферонную активность, содержали клон с кДНК, гибридизовшейся с ИФ-мРНК.
6. Позитивные группы разбили на 8 подгрупп, содержащих по 64 клона, и вновь провели тестирование. Разбиение на подгруппы повторяли до тех пор, пока не идентифицировали клон, содержащий полноразмерную ИФ-кДНК человека.
Если нужно получить большие количества ИФ, соответствующую кДНК можно субклонировать в экспрессирующем Е. соli-векторе, который позволяет достичь высокого уровня экспрессии.
| Таблица 10,3. Возможное терапевтическое применение некоторых интерферонов человека | |
| Интерферон 2а | Заболевание |
| Гепатит С, волосистая лейкоплакия | |
| 2b | Рак мочевого пузыря, рак головы и шеи, злокачественная меланома. |
| | множественные миеломы, неходжкинская лимфома, рак почки, болезнь Крона, ВИЧ-инфекция |
| n3 | СПИД, цервикальная дисплазия, папилломавирусные инфекции, хронический гепатит С, остроконечная кондилома |
| β1a β1b | Рассеянный склероз Хронический прогрессирующий рассеянный склероз |
| γ1b | Рак почки, хронический гранулематоз |
Микробиологическое производство лекарственных средств 207
Интерфероны человека, полученные методом генной инженерии
Первый ген интерферона был выделен в начале 80-х гг. С тех пор было обнаружено несколько разных интерферонов. Как мы уже говорили, исходя из химических и биологических свойств всех их можно подразделить на три группы: ИФα, ИΦβ и ИФγ. ИФα и ИΦβ синтезируются клетками, обработанными препаратами вирусов или вирусной РНК, а ИФγ вырабатывается в ответ на действие веществ, стимулирующих рост клеток. ИФα кодируется семейством генов, включающим как минимум 15 неаллельных генов, в то время как ИΦβ и ИФγ колируются одним геном каждый. Подтипы ИФαпроявляют разную специфичность. Например, при проверке эффективности ИФα1 и ИФα2 на обработанной вирусом линии клеток быка эти интерфероны проявляют сходную противовирусную активность, в случае же обработанных вирусом клеток человека ИФα2 оказывается в семь раз активнее, чем ИФα1. Если противовирусная активность проверяется на клетках мыши, то ИФα2 оказывается в 30 раз менее эффективным, чем ИФα1.
Было предпринято несколько попыток создать ИФ с комбинированными свойствами, используя тот факт, что члены семейства ИФα различаются по степени и специфичности своей противовирусной активности. Теоретически этого можно достичь, соединив части последовательностей генов разных ИФα. Это приведет к образованию гибридного белка с другими свойствами, чем у каждого из исходных белков. Сравнение последовательностей кДНК ИФα1 и ИФα2 показало, что они содержат одинаковые сайты рестрикции в позициях 60, 92 и 150. После расщепления обеих кДНК в этих сайтах и последующего лигирования фрагментов было получено несколько гибридных генов (рис. 10.1). Эти гены экспрессировали в Е. coli, синтезированные белки очистили и исследовали их биологические функции. Проверка защитных свойств гибридных ИΦ на культуре клеток млекопитающих показала, что некоторые из них проявляют большую активность, чем родительские молекулы. Кроме того, многие гибридные ИФ индуцировали образование 2'—5'-олигоизоаденилат-синтетазы в контрольных клетках. Этот фермент участвует в синтезе 2'—5'-связанных олигонуклеотидов, которые в свою очередь активируют латентную клеточную эндорибонуклеазу, расщепляющую вирусную мРНК. Другие гибридные ИФ проявляли большую, чем родительские молекулы, антипролиферативную активность в культурах различных раковых клеток человека.
| Рис. 10.1. Структура генов ИФ, ИФ и четырех гибридных генов. Сравнение нуклеотидных последовательностей генов ИФ2 и ИФ3 обнаруживает наличие у них одинаковых сайтов для рестрицирующих эндонуклеаз (RE1, RE2, RE3). Рестрикция по этим сайтам и лигирование полученных фрагментов приводят к образованию различных гибридных генов. В нижней части рисунка представлены четыре из них. | 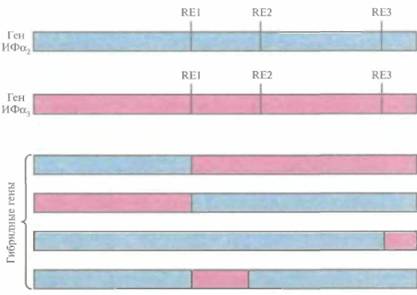 |
208 ГЛАВА 10
Гормон роста человека, полученный методом генной инженерии
Стратегию конструирования новых белков путем замены функциональных доменов или с помощью направленного мутагенеза можно использовать для усиления или ослабления биологического действия белка. Например, нативный гормон роста человека (ГРЧ) связывается в разных типах клеток как с рецептором гормона роста, так и с пролактиновым рецептором.
Чтобы избежать нежелательных побочных эффектов в процессе лечения, нужно исключить присоединение ГРЧ к пролактиновому рецептору. Поскольку участок молекулы гормона роста, связывающийся с этим рецептором, по своей аминокислотной последовательности лишь частично совпадает с участком молекулы, который взаимодействует с пролактиновым рецептором, удалось избирательно снизить связывание гормона с последним. Для этого использовали сайт-специфический мутагенез, в результате которого произошли определенные изменения в боковых группах некоторых аминокислот (His-18, His-21 и Glu-174) — лигандов для ионов Zn2+, необходимых для высокоаффинного связывания ГРЧ с пролакгиновым рецептором (рис. 10.2). Модифицированный гормон роста связывается только со «своим» рецептором. Полученные результаты представляют несомненный интерес, но смогут ли модифицированные ГРЧ найти применение в клинике, пока неясно.
Оптимизация генной экспрессии
Недостаточно создать новый белок, важно оптимизировать экспрессию его гена. Для начала исследователи определяют возможность синтеза достаточных количеств аутентичного белка в прокариотической или эукариотической системах экспрессии. Прокариотическим системам отдается предпочтение, поскольку работа с ними обходится дешевле, а производительность выше. К сожалению, не все микроорганизмы синтезируют функциональные формы гетерологичных белков с одинаковой эффективностью, поэтому необходимо проводить сравнительные количественные оценки.
При изучении экспрессии гена интерлейкина-3 человека в различных клетках-хозяевах «наилучшим» хозяином оказалась Bacilluslicheniformis(табл. 10.4). Хотя в одной из систем Е, coliбыл достигнут несколько более высокий уровень экспрессии, полученный белок мол. массой 20 кДа представлял собой продукт слияния интерлейкина-3 с участком ß-галактозидазы Е. coli, a не зрелый аутентичный белок мол. массой 15 кДа. Как правило, подобный химерный белок нельзя использовать в качестве лекарственного средства. Клетки дрожжей Kluyveromyceslactisи Saccharomyces cerevisiae, а также клетки человека были способны гликозилировать интерлейкин-3, однако уровень экспрессии в них был относительно низок. Гликозилирование не оказывает заметного влияния на активность интерлейкина-3, но ведет к ощутимой разнице в размерах молекулы.
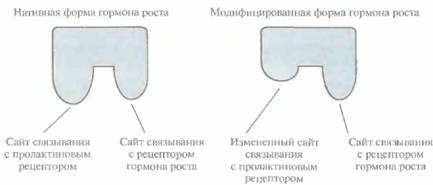 | Рис. 10.2. Схематическое изображение нативной и модифицированной форм гормона роста человека (ГРЧ). С помощью олигонуклеотид-направленного мутагенеза получена форма ГРЧ, утратившая способность связываться с пролактиновым рецептором, но сохранившая специфичность к рецептору гормона роста. |
Микробиологическое производство лекарственных средств 209
| Таблица 10.4. Уровень экспрессии гена интерлейкина-3 в разных системах клеток-хозяев1) | |||
| Клетка-хозяин | Промотор2) | Уровень экспрессии, ЕД | Мол. масса белка, кДа |
 |  |  |  |
| 1) Из работы van Leen et al, Bio/Technology 9: 47-52, 1991, с изменениями. 2)В каждом случае использовался один из наиболее сильных промоторов, «работающих» в данной системе. | |||
