Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
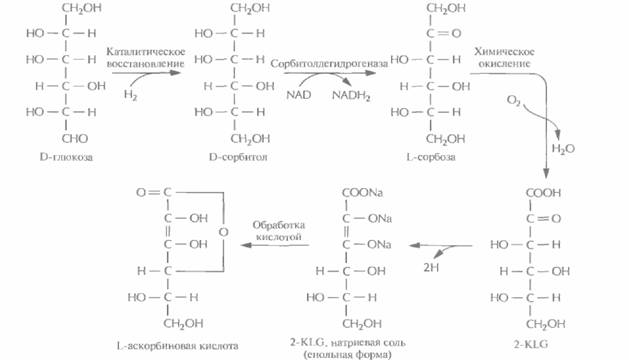
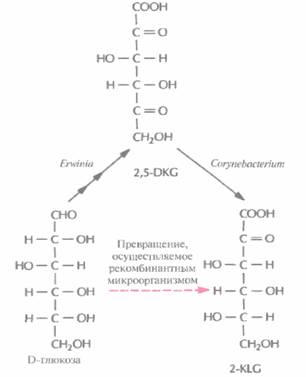
Малые биологические молекулыИспользуя технологию рекомбинантных ДНК, можно направленно изменять метаболизм микроорганизмов, вводя в них новые гены или модифицируя уже существующие. Основной целью таких изменений является создание рекомбинантного микроорганизма с новой ферментативной активностью, способного превращать существующий субстрат в ценный продукт, который обычно получают только сочетанием химических и микробиологических методов. Синтез L-аскорбиновой кислотыВ настоящее время для крупномасштабного производства L-аскорбиновой кислоты (витамина С) используют весьма трудоемкий процесс, включающий одну микробиологическую стадию и несколько химических; исходным субстратом для него является D-глюкоза (рис. 12.2). На последнем этапе этого процесса 2-кето-L-гулоновая кислота (2-KLG) превращается в кислых условиях в L-аскорбиновую кислоту. Биохимические исследования метаболизма различных микроорганизмов показали, что 2-KLG можно получить другим путем. Так, одни бактерии (Acetobacter, Gluconobacterи Erwinia) могут превращать глюкозу в 2,5-дикето-О-глюконовую кислоту (2,5-DKG), а другие (Corynebacterium, Brevibacteriumи Arthrobacter), синтезирующие фермент 2,5-DKG-редуктазу, — преобразовывать 2,5-DKG в 2-KLG. Использующийся в настоящее время способ получения аскорбиновой кислоты можно усовершенствовать, если включить в него совместное культивирование указанных микроорганизмов для превращения глюкозы в 2-KLG. К сожалению, такое культивирование имеет свои трудности. Например, используемые микроорганизмы могут иметь разные оптимумы температуры и pH, могут различаться также состав среды и скорость роста. Иными словами, условия культивирования, оптимальные для одного организма, могут быть неприемлемы для другого, что приведет к спонтанному «вымыванию" из среды одного из них. В подобных случаях можно культивировать микроорганизмы последовательно (рис. 12.3), правда такой процесс трудно будет сделать непрерывным, если для роста микроорганизмов необходимы существенно разные среды. Наилучшим выходом из этой ситуации было бы создание одного микроорганизма, синтезирующего все ферменты, необходимые для превращения глюкозы в 2-KLG. Erwiniaherbicolaосуществляет превращение D-глюкозы в 2,5-DKG в несколько стадий, катализируемых разными ферментами, в то время как Corynebacteriumsp. для превращения 2,5-DKG в 2-KLG необходима только одна стадия. Следовательно, наиболее простой способ создания одного микроорганизма, способного превращать D-глюкозу в 2-KLG, состоит в выделении гена 2,5-ОКО-редуктазы Coiynebacteriumsp. и введении его в Erwmiaherbicoia. Первый шаг на этом пути состоит в выделении и очистке 2,5-DКG-редуктазы Coiynebacteriumsp. и определении последовательности ее первых 40 N-концевых аминокислот. Исходя из этих данных были синтезированы два 43-нуклеотидных гибридизационных зонда, соответствовавших разным частям белковой молекулы. Поскольку 71% нуклеотидов ДНК Corynebacteriumsp. представляют собой либо G, либо С, зонды синтезировали таким образом, чтобы в третьем положении кодонов по возможности находились именно они. Это позволяло минимизировать число неспаренных оснований между зондами и искомой ДНК. Синтезированные зонды использовали для скрининга банка клонов ДНК Corynebacterium·, клоны, гибридизующиеся только с одним из зондов, исключали из дальнейшего рассмотрения, считая, что соответствующая ДНК не является искомой. Выделяли клон, содержащий ген 2,5-DКG-редуктазы, и секвенировали его. Нуклеотидные последовательности, расположенные до стартового кодона ATG, вырезали и заменяли их сигналами транскрипции и трансляции, функционирующими в Е. coli, поскольку регуляторные последовательности грамположительных микроорганизмов типа Corynebacteriumspp. не функционируют в клетках этого микроорганизма. Полученную конструкцию вводили в Использование рекомбинантных микроорганизмов для получения коммерческих продуктов 251
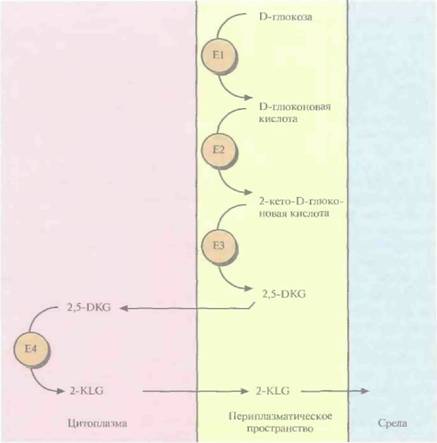
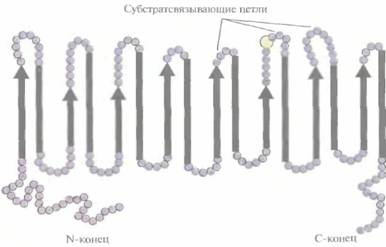
Е. coli(при этом синтезировалась активная 2,5-DKG-редуктаза), а затем переклонировали в векторе с широким кругом хозяев и трансформировали им Erwinia herbicola. Трансформированные клетки Erwinia активно превращали D-глюкозу непосредственно в 2-KLG, при этом собственные ферменты Erwinia, локализованные во внутренней мембране бактериальной клетки, преобразовывали глюкозу в 2,5-DKG, а 2,5-DКG-редуктаза, локализованная в цитоплазме, катализировала превращение 2,5-DKG в 2-KLG (рис. 12.4). Таким образом, с помощью генетических манипуляций метаболические реакции, протекающие в столь разных микроорганизмах, удалось осуществить в одном из них. Этот гибрид приобрел способность синтезировать конечный продукт комбинированного метаболического пути. Такой организм можно использовать как фабрику для производства 2-KLG, заменяющую первые три стадии в том процессе получения L-аскорбиновой кислоты, который используется в настоящее время (рис. 12.2). Коммерческую ценность 2,5-DKG-редуктазы можно повысить, если произвести аминокислотные замены, повышающие каталитическую активность фермента и его термостабильность. В то время, коша был идентифицирован ген 2.5-DKG-редуктазы, аминокислотные остатки, участвующие в образовании активного центра этого фермента, еще не были установлены. Однако, исходя из данных об аминокислотной последовательности фермента, была воссоздана его вторичная структура, состоящая из восьми тесно расположенных параллельных β-слоев, перемежающихся восемью α-спиралями, которые соединялись с β-слоями петлями разной длины (рис. 12.5). Такой характер укладки полипептидной цепи был установлен для 17 других ферментов с уже известной кристаллической структурой, и по аналогии с ними были идентифицированы три петли, возможно участвующие в связывании субстрата. С помо- 252 ГЛАВА 12
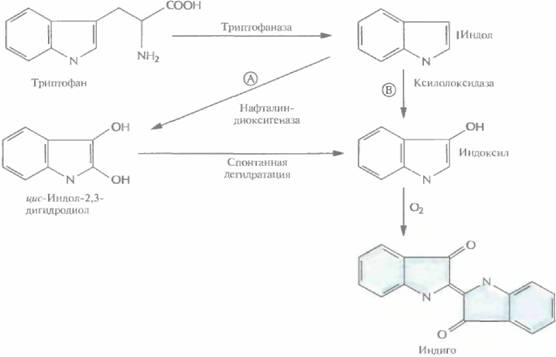
щью олигонуклеотид-направленного мутагенеза были получены 12 мутантных белков, каждый из которых содержал одну аминокислотную замену в одной из петель. 11 мутантных форм 2,5-DKG-редуктазы обладали более низкой удельной активностью, чем нативный фермент, а 12-я, у которой остаток глутамина в положении 192 был заменен на аргинин, была примерно в два раза более активной. По данным кинетических исследований, повышение активности было связано с увеличением в 1,8 раз максимальной скорости (Vmax) и уменьшением на 25% константы Михаэлиса (КM) реакции, катализируемой ферментом. Замена глициновых остатков в положениях 55 и 57 на аланиновые позволила получить более термостабильный фермент по сравнению с нативной формой. Дальнейшие усилия будут, вероятно, направлены на получение фермента, сочетающего оба этих свойства. Синтез индигоМножество бактерий, особенно бактерии вида Pseudomonas, способны утилизировать различные органические соединения типа нафталина, толуола, ксилола и фенола, которые являются для них единственным источником углерода. Очень часто гены ферментов, катализирующих расщепление этих органических соединений, располагаются в крупных природных плазми-дах (длиной 50—200 т.п.н.). Чтобы ставить эксперименты с этими бактериями, в частности проводить целенаправленную модификацию генов ферментов, катализирующих те или иные метаболические реакции, приходится предпринимать детальные генетические и биохимические исследования, и нередко в ходе этих исследований делаются неожиданные и весьма интересные открытия. Рассмотрим следующий пример. Плазмида NAH7 содержит два разных оперона, которые позволяют несущим ее псевдомонадам использовать нафталин как единственный источник углерода. Для характеристики соответствующих генов расщепили плазмидную ДНК с помощью HindIII и лигировали фрагменты с линеаризованной HindIII плазмидой pBR322. Полученные гибридные молекулы ввели в клетки Е. соliи отобрали трансформантов, устойчивых к ампициллину, но чувствительных к тетрациклину. Затем проверили всех трансформантов на способность образовывать нелетучие метаболиты — возможные продукты гидролиза радиоактивно меченного нафталина. При исследовании одного из трансформантов, содержащего вставку длиной 10,5 т.п.н. и способного превращать нафталин в салициловую кислоту, обнаружилось, что минимальная ростовая среда, содержащая триптофан, приобретает синюю окраску. Тщательный анализ этого явления показал, что трансформированные клетки E. coli синтезировали краситель индиго. Синтез происходил в четыре стадии (рис. 12.6). Использование рекомбинантных микроорганизмов для получения коммерческих продуктов 253
254 ГЛАВА 12 1. Превращение триптофана в индол с помощью триптофаназы, которая синтезируется в хозяйских клетках Е. coli. 2. Окисление индола до цис-индол-2,3-дигидродиола под действием нафталин-диоксигеназы, которая кодируется ДНК, переклонированной из плазмиды NAH7. 3. Спонтанная дегидратация. 4. Окисление на воздухе с образованием индиго. Таким образом, комбинация ферментов двух разных метаболических путей двух разных организмов привела к неожиданному синтезу красителя индиго. Введение в Е. coliгена ксилолоксидазы, содержащегося в плазмиде TOL, может обеспечить превращение триптофана в индоксил, спонтанно окисляющийся до индиго (рис. 12.6). Индиго, синий пигмент, который применяется для окрашивания хлопка и шерсти, был впервые выделен из растений; сейчас его получают путем химического синтеза. По оценкам, в год производится примерно 1,5·107 кг этого красителя на сумму около 200 млн. долл. Индиго окрашивают джинсовую ткань, и объем его продаж больше, чем любого другого красителя. Возможность получения индиго с помощью микроорганизмов позволяет разработать весьма эффективный и экономичный крупномасштабный микробиологический способ его производства, что дает возможность обойтись без использования таких токсичных веществ, как анилин, формальдегид и цианид, которые необходимы при химическом синтезе индиго. В настоящее время биотехнологи пытаются подобрать оптимальные условия выращивания больших количеств штамма Е. coli, способного к синтезу индиго. Среди подбираемых параметров температура, pH и количество триптофана в среде, обеспечивающее максимальный выход
Использование рекомбинантных микроорганизмов для получения коммерческих продуктов 255
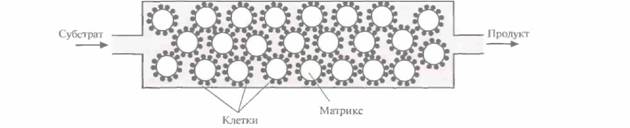
продукта. Эта система еще не готова для коммерческого использования, но уже ясно, что микробиологический процесс мог бы проходить в биореакторе, в котором рекомбинантные E. coli химически иммобилизованы на твердой матрице (например, на целлюлозе или силикагеле). Реактор мог бы работать в непрерывном режиме, с поступлением триптофана с одной его стороны и удалением индиго с другой (рис. 12.7). Синтез аминокислотАминокислоты широко применяются в пищевой промышленности — в качестве усилителей вкуса и аромата, антиоксидантов и пищевых добавок; в сельском хозяйстве — в качестве кормовых добавок; в медицине — для терапии послеоперационных больных; в химической промышленности -в качестве исходных веществ при синтезе полимеров и производстве косметических средств (табл. 12.1). По оценкам, ежегодно в мире производится более 800 000 т аминокислот стоимостью более 5 млрд. долларов. При этом больше половины общего объема производства приходится на долю L-глутаминовой кислоты, которая используется для получения широко известного усилителя вкуса и аромата – глутамата натрия. В промышленном масштабе аминокислоты получают в основном либо экстракцией из белковых гидролизатов, либо как продукты метаболизма двух неспорулирующих грамположительных почвенных бактерий, Corynebacterium или Brevibacterium spp. Обычно для повышения продуктивности этих микроорганизмов используется мутагенез с последующим отбором штаммов — сверхпродуцентов определенных аминокислот. Однако такой способ получения штаммов требует много времени, а эффективность его невелика. Альтернативный подход мог бы состоять в выделении и изменении специфических генов, кодирующих ключевые ферменты определенных биохимических реакций, на основании детальных биохимических данных об этих ферментах. Впрочем, такой генноинженерный подход может оказаться не столь простым. Так, в биосинтезе некоторых аминокислот могут участвовать несколько ферментов, которые активируются или ингибируются различными метаболитами, присутствующими в клетке. В такой ситуации трудно определить, какой фермент нужно модифицировать, чтобы увеличить выход конечного продукта. Кроме того, ученые пока не располагают исчерпывающими данными о биохимических свойствах указанных выше микроорганизмов, а соответствующие генноинженерные подходы находятся на стадии разработки. В частности, только создаются экспрессирующие векторы и методики трансформации для грамположительных организмов типа Corynebacterium и Brevibacterium spp. Большинство плазмидных векторов с широким кругом хозяев реплицируются только в грамотрицательных микроорганизмах, поэтому необходимо создать векторы, специально предназначенные для экспрессии в Corynebacîenum и Brevibacterium spp. Это могли бы быть челночные векторы Е. coli—Corynebacterium. Ta их часть, которая происходит из плазмид E. coli, может со- 256 ГЛАВА 12
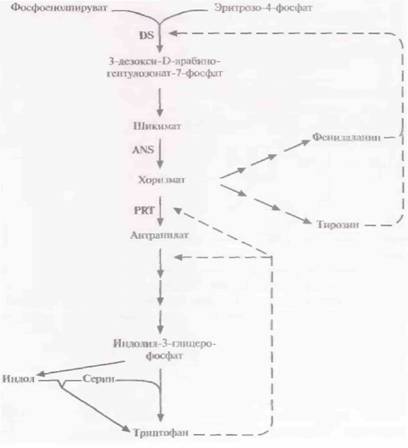
держать гены устойчивости к тетрациклину, хлорамфениколу или канамицину. Поскольку и E. coli, и Corynebacterium spp. чувствительны к данным антибиотикам, эти гены могли бы служить селективными маркерами для обоих микроорганизмов. Эффективный метод трансформации С. glutamicum, одного из видов Corynebacterium, часто используемых в такого рода экспериментах, до сих пор не разработан. Многие гены С. glutamicum неэффективно экспрессируются в Е. coli. Поэтому для систем отбора, основанных на экспрессии гена (например, при комплементации), клетки С, glutamicum должны быть трансформированы полным банком клонов. К сожалению, частота трансформации при введении ДНК в С glutamicum обычным способом или электропорацией очень низка. Ее можно существенно повысить, если для введения чужеродной ДНК использовать конъюгацию или удалить клеточные стенки трансформируемых клеток лизоцимом (использовать протопласты). Проникновение экзогенной плазмидной ДНК в протопласты облегчается в присутствии полиэтиленгликоля. Получены первые положительные результаты в увеличении выхода незаменимой аминокислоты триптофана, синтезируемой С glutamicum, Для этого в клетки С. glutamicum дикого типа была введена вторая копия гена, кодирующего антранилатсинтазу, фермент, лимитирующий синтез триптофана (рис. 12.8). Ниже описан один из способов выделения этого гена. 1. Библиотеку хромосомной ДНК Brevibacteriumflavum клонировали в челночном векторе С. glutamicum—E. coli и ввели в мутантный штамм С. glutamicum, не синтезирующий активной антранилатсинтазы. 2. Трансформантов отобрали по их способности расти в отсутствие антраниловой кислоты. Этим они отличались от мутантных нетрансформированных клеток. 3. Вектор, содержащий ген антранилатсинтазы, перенесли в штамм С. glutamicumдикого типа. В табл. 12.2 представлены результаты определения количества триптофана, синтезированного мутантным штаммом С. glutamicum и штаммом дикого типа, которые содержали или не содержали вектор с клонированным геном антранилатсинтазы. Как видно из таблицы, клони-
Использование рекомбинантных микроорганизмов для получения коммерческих продуктов 257
рованный ген практически полностью восстанавливал способность мутантного штамма синтезировать триптофан. Однако эффект введения этого гена в штамм дикого типа был еще сильнее: уровень синтеза триптофана в этом случае увеличивался примерно до 130%, что связано с более эффективным использованием доступных предшественников. Еще более высокий уровень синтеза триптофана достигался при введении в клетки С. glutamicum модифицированных генов трех ключевых ферментов: 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазы, антранилатсинтазы и антранилатфосфорибозилтрансферазы. Гены, кодирующие эти ферменты, благодаря внесенным в них мутациям стали нечувствительны к ингибированию конечным продуктом (ингибирование по типу обратной связи). В качестве альтернативы для синтеза аминокислот можно использовать E. coli. Этот микроорганизм хорошо изучен, а генноинженерные методы работы с ним более или менее детально разработаны. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||