Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
| ||||||||||||||
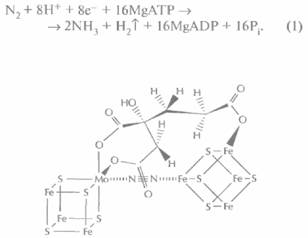 |
| Рис. 14.1. Предполагаемая структура железомолибденового кофактора, связанного с молекулой азота (N2). |
Бактерии, стимулирующие рост растений 309
Помимо фиксации азота, нитрогеназа катализирует также восстановление газообразного ацетилена до этилена:
Н-С≡С-Н + 2Н+ --> Н2=С=С=Н2. (2)
Определяя с помощью газовой хроматографии количество синтезированного этилена, можно оценивать активность нитрогеназы. Определения можно проводить на целых клетках в растворе (рис. 14.2), на бактериях, ассо-
циированных с корнями растений, на грубых экстрактах клеток или на высокоочищенных препаратах фермента. Компонент I катализирует собственно восстановление N2, a компонент 11 служит донором электронов. Оба они чрезвычайно чувствительны к кислороду и при слишком высоких его концентрациях быстро и необратимо инактивируются. Функционирование нитрогеназы зависит также от 15—20 вспомогательных белков. Роль некоторых из них состоит в передаче электронов
| Рис. 14.2. Определение активности нитрогеназы по восстановлению ацетилена до этилена. А, Бактерии (в культуре или ассоциированные с корнями растения), синтезирующие нитрогеназу, либо препарат очищенного фермента (не показано) помещают в герметичную емкость в атмосферу ацетилена. Б. Из емкости периодически отбирают пробы и методом газовой хроматографии измеряют количество ацетилена и этилена. Активность нитрогеназы пропорциональна количеству образовавшегося этилена. | 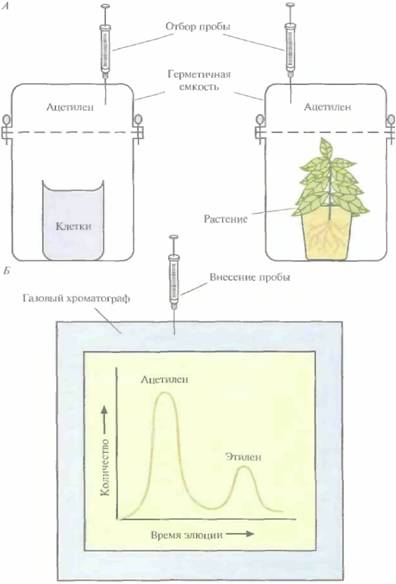 |
310 ГЛАВА 14
компоненту II, а также в биосинтезе железомолибденового кофактора.
Генная инженерия кластера генов нитрогеназы
Фиксация азота — очень сложный процесс, требующий согласованного действия множества разных белков. Поэтому вряд ли можно было ожидать, что вся генетическая информация, необходимая для фиксации азота, будет содержаться в каком-то одном фрагменте ДНК и что этот фрагмент удастся вычленить из генома диазотрофного микроорганизма и перенести в недиазотрофный организм. Следует еще учесть, что физиологические условия в организме реципиента должны быть подходящими для функционирования активной нитрогеназы. Более приемлемый способ выделения генов азотфиксации (nif-генов) состоял в том, чтобы идентифицировать и охарактеризовать те клоны библиотеки ДНК дикого типа, которые восстанавливают способность различных мутантов данного микроорганизма фиксировать азот. Такой метод называется генетической комплементацией.
Первые nif-гены, идентифицированные методом комплементации, были выделены из банка клонов диазотрофиой бактерии Klebsiellapneumoniae. Эта хорошо изученная энтеробакте-рия, которая обнаруживается в почве и воде, а также в кишечнике человека. Схема выделения состоит в следующем (рис. 14.3).
1. Клетки К. pneumoniaeобрабатывают такой дозой мутагена, чтобы выживаемость составила примерно 0,1—1,0%. Некоторые из мутантных клеток, способные расти на минимальной среде, содержащей источник связанного азота типа NH4C1, но не в отсутствие связанного азота, вероятно, несут мутацию в nif-гене; их обозначают Nif --.
2. Используя экспрессирующие плазмидные векторы с широким кругом хозяев, создают банк клонов хромосомной ДНК К. pneumoniaeдикого типа (Nif+) и поддерживают его в Е. coli.
3. Проводят конъюгацию Nif–-клеток К. pneumoniaeс клетками E. coli, несущими банк клонов в плазмидных векторах.
4. Трансформированные клетки К. pneumoniae, приобретшие фенотип Nif+, отбирают, высевая их на минимальную среду, не содержащую источника связанного азота. В этих условиях растут только Nif–-клетки К. pneumoniaeс плазмидой, кодирующей белок, который отсутствует или не функционирует в Nif–-мутанте.
Фрагмент ДНК в плазмиде, комплементирующий хромосомную мутацию Nif–, содержит nif-ген, который можно детально охарактеризовать и использовать для выделения других nif-генов.
Для выделения других генов, участвующих в фиксации азота, применяли два подхода. Во-первых, использовали банк клонов К. pneumoniaeдля комплементации независимо возникающих Nif–-мутантов, увеличивая тем самым вероятность того, что в каждом случае будет выделен другой nif-ген. Во-вторых, выделенные nif-гены использовали в качестве гибридизационных зондов для скрининга банка клонов хримосомной ДНК К. pneumoniae, несущих большие вставки (от 7 до Шт. п. н.), исходя из того, что у прокариот гены одного пути биосинтеза обычно образуют кластеры.
В результате всесторонних исследований был идентифицирован и охарактеризован весь набор nif-генов К. pneumoniae. Эти гены организованы в один кластер длиной примерно 24 т. п. н. (рис. 14.4), который содержит семь отдельных оперонов, колирующих в общей сложности 20 разных белков (табл. 14.2). Для того чтобы образовалась активная нитрогеназа, все nif-гены
| Таблица 14.2. Гены К. pneumonias, участвующие в фиксации азота, и кодируемые ими белки (или функции) | |
| nif- Ген | Белок (функция) |
 |  |
Бактерии, стимулирующие рост растений 311
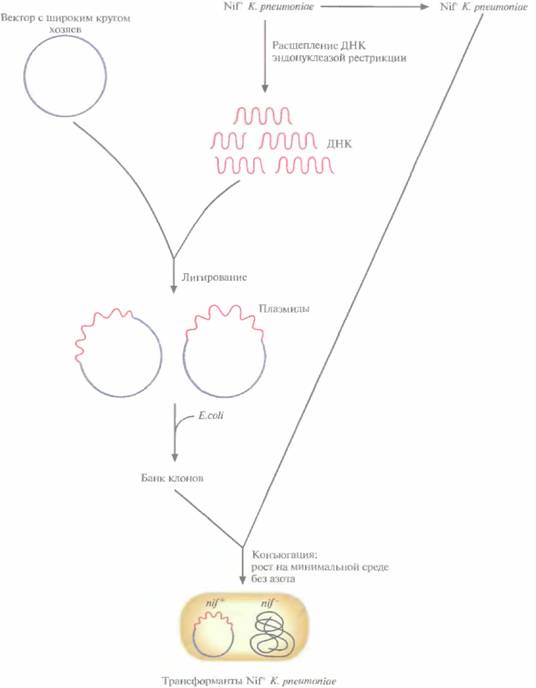 |
| Рнс. 14.3. Выделение nif-генов методом генетической комплементации. Для комплементации Nif -штамма К. pneumoniaeиспользуется банк клонов ДНК Nif+-клеток. Трансформированные клетки отбирают по их способности расти на минимальной среде, не содержащей связанного азота. |
312 ГЛАВА 14
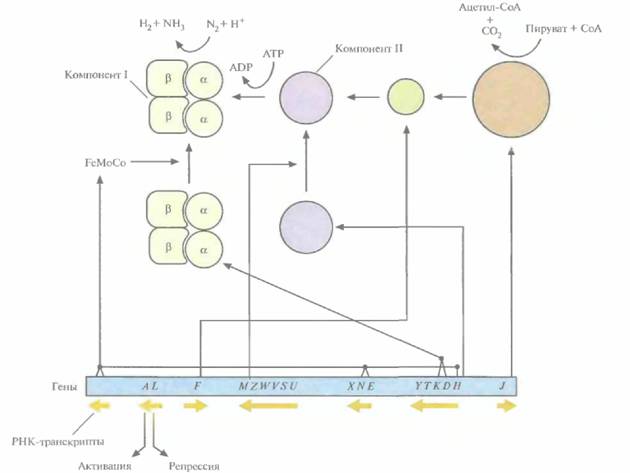 |
| Рис. 14.4. Расположение nif-генов в кластере и некоторые кодируемые ими функции. Гены обозначены заглавными буквами; красная стрелка под каждой из групп этих букв обозначает специфический nif-оперон и указывает направление его транскрипции. Стрелки, отходящие от обозначений генов, показывают, какое участие в фиксации азота принимают продукты некоторых из этих генов. F — флаводоксин, FO — пируват : флаводоксин окcидоредуктаза. |
должны транскрибироваться и транслироваться одновременно (под регуляторным контролем nifA- и nifL-генов). Белок NifA — это активатор транскрипции всех nif-оперонов, кроме своего собственного. Он связывается со специфической последовательностью ДНК (5'-TGT-N10-ACA-3'), которая находится в каждом промоторе каждого nif-оперона. Сайт связывания белка NifA находится примерно в 80—150 нуклеотидах перед каждым сайтом инициации транскрипции. Перед началом транскрипции с nif-промотора связавшийся с ДНК белок NifA взаимодействует со специфическим белком инициации транскрипции σ54. Белок NifL — репрессор. В присутствии либо кислорода, либо связанного азота он действует как антагонист NifA и в результате ингибирует транскрипцию всех других rtif-генов.
Роль К. pneumoniae в общем биологическом процессе связывания азота не является основной. Поэтому в целях модификации процесса фиксации азота почвенными бактериями, представляющими большой интерес с точки зрения стимуляции роста растений, были кло-
Бактерии, стимулирующие рост растений 313
нированы и охарактеризованы nif-гены из других источников. При этом nif-гены К. pneumoni· ае использовались в качестве гибридизационных зондов для выделения соответствующих генов из банков клонов других диазотрофных микроорганизмов. Большннство диазотрофов имеет сходный набор генов, кодирующих аппарат фиксации азота, и последовательности ДНК этих генов у разных организмов мало различаются.
Принимая во внимание результаты молекулярно-генетических исследований, вероятно, можно повысить уровень фиксации азота диазотрофными бактериями, модифицируя nifA- и nifL-гены. После введения с помощью методов генной инженерии дополнительных копий nifA-гена в штамм Rhizobiummelilotiрастения люцерны, зараженные этим рекомбинантным штаммом, достигали больших размеров и давали больше биомассы, чем растения, обработанные нетрансформированным штаммом. По-видимому, аналогичным образом можно поступить с nifL-геном, так чтобы белок NifL (негативный регуляторный фактор) стал бы менее чувствительным к присутствию связанного азота. При таком нарушении регуляции микроорганизм поставлял бы больше азота своему симбиотическому партнеру. Однако имеющиеся данные указывают на то, что не все азотфиксирующие организмы синтезируют белок NifL (y некоторых из них существенные области NifL могут быть составной частью NifA), так что подобный подход не является универсальным. Кроме того, увеличение количества азота, которое может фиксировать микроорганизм, приводит к увеличению количества энергии (обычно в форме связанного углерода), необходимой для обеспечения метаболизма. Следовательно, рекомби-нантный микроорганизм может оказаться неспособным стимулировать рост растения просто вследствие замедления своего роста.
Имея в виду всю сложность процесса фиксации азота микроорганизмами, можно сделать вывод, что простого введения в недиазотроф-ную клетку-реципиент одного или двух nif-генов недостаточно для того, чтобы она приобрела способность связывать азот. Более того, даже введение в геном растений полного кластера nif-генов длиной 24 т, п. н. не даст необходимого эффекта, поскольку при той концентрации кислорода, которая характерна для растительной клетки, нитрогеназа инактивируется. Если же концентрацию кислорода понизить, то растительная клетка вероятнее всего погибнет. Но в первую очередь попытки создания растительных клеток, способных связывать азот, требуют решения фундаментальных проблем транскрипции, трансляции и регуляции. Например, трудно представить, как будет осуществляться регуляция фиксации, поскольку у растений нет промоторов, с которыми связывался бы белок NifA. Следовательно, в таком трансгенном растении транскрипция nif-генов не будет инициироваться. Кроме того, чтобы реагировать на уровень связанного азота в клетке, все nif-гены должны находиться под контролем отдельных промоторов, поскольку растительные клетки неспособны процессировать мультигенные транскрипты. Учитывая все сказанное выше, приходится констатировать, что создание растений, способных фиксировать азот, вряд ли возможно.
