Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||
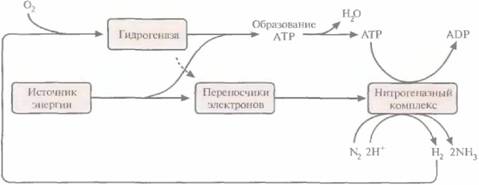 |
| Рис. 14.5. Рециркуляция газообразного водорода - побочного продукта фиксации азота. Нитрогеназа катализирует образование водорода, используя энергию гидролиза АТР, а гидрогеназа катализирует его утилизацию. |
низкой концентрации кислорода), используя в качестве источника энергии водород. Для этого они синтезируют фермент гидрогеназу, способную превращать атмосферный Н2 в Н+ (рис. 14.5). Чтобы проверить, можно ли с помощью этих штаммов влиять на рост сои, растения инфицировали В. japonicutn, синтезирующими гидрогеназу (Нuр+). Растения давали большую биомассу и усваивали больше азота, чем те, которые были заражены Ηuρ-штаммами, даже несмотря на более высокий уровень нитрогеназной активности последних (табл. 14.3). По результатам этого и аналогичных экспериментов был сделан вывод, что наличие системы ассимиляции водорода у симбиотических диазотрофов типа В. japonicum повышает их способность стимулировать рост растений, по-видимому, в результате связывания и рециркуляции газообразного водорода, образующегося в клубеньках при участии нит-рогеназы (рис. 14.5).
Несмотря на выгоды, которые получает растение от симбиоза с диазотрофным микроорганизмом, обладающим системой повторного использования водорода, в природных условиях такая система при участии штаммов Rhizobium встречается редко. Согласно результатам тестирования, представленным в табл. 14,4, большинство рассмотренных природных штаммов Rhizobium и Bradyrhizobiumимеют фенотип Hup. Было проверено по несколько штаммов каждого из указанных видов, а для В. japonicumих было более 1400. Ясно, что как только удастся достаточно подробно изучить генетическую природу гидрогеназной системы и идентифицировать соответствующие гены, коммерческие Нир-штаммы Rhizobium будут первыми кандидатами на превращение в штаммы с фенотипом Нир+.
Модификация генов гидрогеназ
На изучение гидрогеназ как диазотрофных, так и недиазотрофных микроорганизмов в послед-
| Таблица 14.3. Относительная активность нитрогеназы и гидрогеназы и способность В. japonicum Hup+ (SR) и трех Hup -мутантов (SRI, SR2 и SR3) стимулировать рост растений1) 2) | | ||||
| Штамм В, japonicum | Относительная активность нитрогеназы | Относительная активность гидрогеназы | Относительная сухая масса растения | Относительное содержание азота | |
 | | ||||
| | |||||
| | |||||
| | |||||
| " Из работы Albrecht et al. Science 203: 1255-1257, 1979. | | ||||
| г> Активность нитрогеназы оценивали по зависимости количества ацетилена, восстановленного до этилена, от времени; активность гидрогеназы определяли при помощи водородного электрода. Сухая масса растения включает массу листьев и корней. Содержание азота рассчитывали как долю сухой массы, приходящуюся на азот. Все величины нормированы относительно таковых для родительского штамма. | | ||||
Бактерии, стимулирующие рост растений 315
| Таблица 14.4. Доля природных штаммов Rhizobiumи Bradyrhizobium, у которых есть система ассимиляции водорода (Hup+) 1) |
| Бактерия Штаммы Ηuρ+, % |
 |
| 1) Из работы Evans et al. Anna. Rev. Mlcrobiol. 41: 335-361, 1987. |
ние 20 лет было затрачено много усилий, и тем не менее строение и функции этих ферментов до конца не установлены. Многие микроорганизмы синтезируют более одной гидрогеназы, при этом часто они состоят больше чем из одной полипептидной цепи. Одни гидрогеназы только связывают атмосферный водород, в то время как другие при соответствующих условиях могут также синтезировать его. Из всего этого следует, что вряд ли для преобразования штамма Hup Rhizobiumв Нир+ будет достаточно простого включения в его геном гена одной из гидрогеназ. Включенный ген(ы) должен кодировать все субъединицы фермента. который должен быть совместим с электронтранспортной системой организма-хозяина.
Наиболее распространенная стратегия выделения генов гидрогеназ — генетическая комплементация. Первый из таких генов, ген мембраносвязанной гидрогеназы Е. colt, был идентифицирован методом комплементации у мутантной Е. coli, неспособной синтезировать активную гидрогеназу, с использованием банка клонов ДНК Е. coliдикого типа, созданного с помощью плазмиды pBR322. Мутант, содержащий дефектную мембраносвязанную гидрогеназу, не рос на минимальной среде в присутствии формиата, при этом активность эндоплазматической гидрогеназы оставалась неизменной. Трансформированные клетки, способные расти на такой среде, проверяли на присутствие в них активной гидрогеназы. Трансформант, у которого активность гидрогеназы восстановилась до такого же уровня, как у штамма дикого типа, содержал плазмиду, кодирующую белок мол. массой примерно 60 000 Да, что соответствует мол. массе одной из субъединиц мембраносвязанной гидрогеназы E. coli. Дальнейшие исследования показали, что в гидрогеназную систему E. coli входит множество генов.
Затем были идентифицированы гидрогеназные гены (hup) B. japonicum;для этого использовался банкклонон ДНК. дикого типа, созданный с помощью космидного вектора pLAFRl с широким кругом хозяев, и мутанты Hup B. japonicum. Присутствие гидрогеназы, связывающей атмосферный водород, в трансформированных мутантных клетках Нир определяли по способности активного фермента восстанавливать ме-тиленовый синий в атмосфере водорода. Более детальное исследование показало, что hup-гены В. japonicum образуют по крайней мере два, а возможно, и три оперона, охватывающих примерно 15 т.п.н., причем hup-гены Rhizobiumleguminosarum аналогичны таковым В. japonicum как в отношении нуклеотидной последовательности, так и в том, что касается организации генов. Таким образом, идентифицированные hup-гены В. japonicum можо использовать в качестве гибридизационных зондов для поиска гомологичных генов из банка клонов R. leguminosarutn.
После идентификации Лир-генов R. ieguminosarum, несмотря на всю сложность гидрогеназной системы, удалось «переместить» ее из Hup+-штамма Л. leguminosarumв штамм Нир (табл. 14.5). Растения бобов, на которых образовывали клубеньки бактерии рекомбинантного Hup+-штамма R. leguminosarum, росли быстрее и содержали больше азота, чем растения, инокулированные Нир-штаммом (табл. 14.5).
Работы по исследованию генов гидрогеназ не вызвали столь большого интереса, как исследования nif-генов, и тем не менее они убедительно продемонстрировали целесообразность применения методов генной инженерии для повышения способности диазотрофных микроорганизмов стимулировать рост растений. Теперь нужно проверить, приведет ли введение hup-генов в геномы других диазотрофных микроорганизмов (как несимбиотических, так и симбиотических) к такому же эффекту.
Гидрогеназная система может применяться не только для повышения эффективности фиксации азота. Так, очищенную гидрогеназу можно использовать для преобразования и запаса-
316 ГЛАВА 14
| Таблица 14.5. Рост растений и ассимиляция азота после введения генов hupв Нuр–-штамм R. leguminosarum1) |
 |
ния солнечной энергии; регенерации кофакторов, принимающих участие в промышленных ферментативных процессах; синтеза специфических химических соединений, требующего участия Н2 в качестве восстановителя; для удаления трития из воды, которая использовалась для охлаждения реакторов атомных электростанций; для синтеза Н2 из органических отходов; получения водородно-кислородных топливных ячеек. Однако, несмотря на то что уже идентифицировано и охарактеризовано более дюжины генов гидрогеназ, пока ни один из них не использовался для крупномасштабного синтеза этих ферментов.
