Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
95%) и некоторого количества углеводородов (-5%). Кристалл — это на самом деле некий белковый агрегат, диссоциирующий на субъединицы в слабой щелочи. Субъединицы можно далее диссоциировать in vitro обработкой ß-меркаптоэтанолом, кото-Микробные инсектициды | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 15.1. Некоторые свойства инсектицидных токсинов, синтезируемых разными штаммами В. thuringiensis1) | ||||
| Штамм В. thuringiensisили подвид | Класс | Мол. масса протоксина, кДа | Насекомое-мишень | Серотип |
| berliner | CryI | 130-140 | Чешуекрылые | 1 |
| kurstaki КТО, HD-1 | CryI | 130-140 | Чешуекрылые | 3 |
| entomocidus 6.01 | CryI | 130-140 | Чешуекрылые | 6 |
| αizawai 7.29 | CryI | 130-140 | Чешуекрылые | 7 |
| aizawai IC 1 | CryI | 135 | Чешуекрылые, двукрылые | 7 |
| kurstaki HD-I | CryII | 71 | Чешуекрылые, двукрылые | 3 |
| tenebrionis (san diego) | CryIII | 66-73 | Жесткокрылые | 8 |
| morrisoni PG 14 | CryIV | 125-145 | Двукрылые | 8 |
| israelensis | CryIV | 68 | Двукрылые | 14 |
| 1) Из работы Lerechus el al., p. 37— 69, in Enlwistle et al., (ed.). Bacillus thuringiensis, an Environmental Biopesticide: Theory und Practice, 1993. | ||||
Микробные инсектициды 333
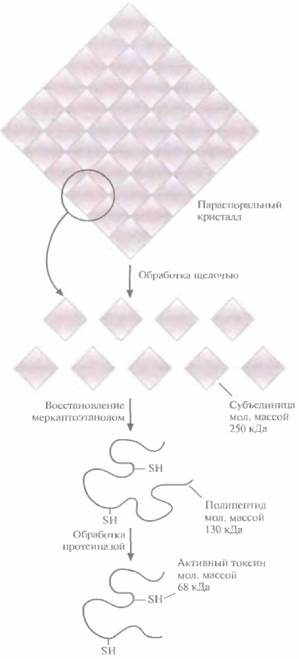 | Рис. 15.1. Схематическое изображение параспорального кристалла В. thuringiensis, состоящего из белкового протоксина Cryl. Каждая белковая субъединица имеет мол. массу 250 кДа и содержит два полипептида мол. массой 130 кДа каждый. Молекулярные массы определяли с помощью электрофореза в полиакриламидном геле; приведены округленные значения. Превращение протоксина (130 кДа) в активный токсин (68 кДа) происходит только в слабощелочных условиях (pH 7,5—8) в присутствии специфической протеиназы (протеиназ). Именно эти условия реализуются в кишечнике насекомого. |
рый восстанавливает дисульфидные связи (рис. 15.1).
Все инсектицидные токсины, выделенные из множества штаммов В. thuringiensis, в соответствии с их токсичностью можно сгруппировать в четыре основных класса: CryI, CryII, CryIII и CryIV, Белки Cryl токсичны для чешуекрылых, CryII - для чешуекрылых и двукрылых, Crylll -для жесткокрылых, CrylV — для двукрылых. Классы можно разделить далее на подклассы (А, В, С, ...) и подгруппы (а, b, с, ...) согласно нуклеотидным последовательностям генов соответствующих токсинов. Например, класс генов cryIвключает шесть подклассов (от crylA до F), а подкласс crylA — три подгруппы [от crylA(a) до (с)]. Кроме того, в соответствии с иммунологическими особенностями выделяют примерно 30 разных серотипов В. thuringiensis ( табл. 15.1). Каждый серотип отличается от другого специфическим набором антигенных детерминант на поверхности клеток определенного штамма В. thuringiensis.
В параспоральном кристалле инсектицид обычно находится в неактивной форме; при солюбилизации кристалла белок высвобождается в форме протоксина, предшественника активного токсина. Протоксин класса токсинов Cryl имеет мол, массу примерно 130 кДа (рис. 15.1). После заглатывания насекомым параспорального кристалла протоксин активируется в кишечнике в условиях щелочного pH (7,5—8,0) и под действием специфических пищеварительных протеиназ превращается в активный токсин с мол. массой примерно 68 кДа (рис. 15.1). В таком виде он встраивается в мембрану эпителиальных клеток кишечника насекомого и образует ионный канал, через который, как полагают, происходит утечка значительной части клеточного АТР (рис. 15.2). Примерно через 15 мин после формирования такого ионного канала клеточный метаболизм блокируется, насекомое перестает питаться, происходит обезвоживание
334 ГЛАВА 15
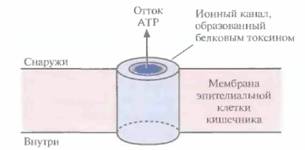 |
| Рис. 15.2. Встраивание токсина В, thuringiensis в мембрану эпителиальной клетки кишечника насекомого и образование ионного канала. |
организма и в конечном счете наступает смерть. Поскольку превращение прстоксина в активный токсин происходит только в условиях щелочного pH и в присутствии определенных протеиназ, вероятность вредного воздействия токсинов на человека и сельскохозяйственных животных мала.
Способ действия токсинов В. thuringiensis налагает некоторые ограничения на область их применения. Чтобы убить насекомое, В. thuringiensis обязательно должен попасть в его кишечник, в противном случае никакого эффекта не будет. В. thuringiensis чаще всего распыляют, причем бактерии обычно смешивают с атрактантами насекомых, чтобы повысить вероятность того, что насекомое-вредитель проглотит токсин. Однако для насекомых, обитаюших в тканях растений или на корнях, токсин В. thuringiensis при такой обработке вряд ли будет представлять какую-либо опасность. С учетом всего этого были предприняты попытки разработать другие стратегии защиты растений от таких вредителей. Один из подходов состоит в создании трансгенных растений, несущих и экспрессирующих ген токсина В. thuringiensis и, следовательно, защищенных от насекомых-вредителей в течение всего периода вегетации.
Второе ограничение, налагаемое на применение токсина В. thuringiensis, связано с тем, что этот токсин действует на насекомое, находящееся только на определенной стадии развития. Именно в этот момент и должна проводиться обработка.
Штамм В. thuringiensis subsp. kurstaki был выделен в 1901 г., но интерес к нему как к ценному коммерческому продукту возник лишь в 1951 г., а за последние десять лет эта бактерия стала основным инструментом контроля численности гусениц листовертки-почкоеда елового в Канаде. В 1979 г. лишь над 1% лесов Канады, обрабатываемых инсектицидами с целью уничтожения этого насекомого (что соответствует примерно 2 млн. га), распыляли В. thuringiensis subsp. kurstaki; остальные площади обрабатывали химическими инсектицидами. К !986 г. масштабы использования B. thuringiensis subsp. kurstaki возросли до 74%. В других странах В. thuringiensis subsp. kurstaki используют для борьбы с коконопрядом, непарным шелкопрядом, мертимидами, совкой капустной и бражником. Основное препятствие на пути еще более широкого применения В. thuringiensis subsp. kurstaki состоит в его дороговизне: стоимость такого препарата в 1,5—3 раза выше, чем химических инсектицидов.
Для биоконтроля численности насекомых-вредителей распыляют 1,5 - 109 — 2,5 109 спор В. thuringiensis subsp. kurstaki на каждый квадратный метр обрабатываемого участка. Обработку проводят в тот период, когда число личинок в популяции насекомого-мишени максимально, поскольку параспоральные кристаллы чувствительны к солнечному свету и быстро разрушаются. В лабораторных условиях на свету за 24 ч разлагается более 60% остатков триптофана в белках па-распорального кристалла, а в окружающей среде в зависимости от освещенности кристаллы могут сохраняться от одних суток до одного месяца. Такая нестабильность инсектицидного протоксина подразумевает, что появление устойчивых к нему насекомых маловероятно.
Однако в том случае, когда В. thuringiensis subsp. kurstaki использовали в качестве инсектицида в условиях малой освещенности (например, в зернохранилищах), через несколько генераций появлялись устойчивые к токсину насекомые. Одна из причин такой передаваемой по наследству устойчивости заключается в изменении мембранного белка клеток кишечника, в норме выполняющего функцию рецептора токсина В. thuringiensis subsp. kurstaki. Возможно, она возникает вследствие того, что в этих условиях протоксин не разрушается и служит фактором отбора. Из всего этого следует, что появления насекомых, устойчивых к В. thuringiensis
Микробные инсектициды 335
subsp. kurstaki, проще всего избежать, если ограничить применение данного микроорганизма полевыми условиями. Впрочем, имея в виду масштабы использования В. thuringiensis, нельзя исключить, что может произойти его накопление в среде в количестве, достаточном для того, чтобы вступил в действие механизм отбора. А поскольку B. thuringiensisиспользуется все более широко в разных регионах, вероятность появления популяций устойчивых насекомых будет увеличиваться.
Идентификация генов токсинов
Для создания штаммов В. thuringiensis, более эффективно синтезирующих инсектициды и имеющих широкий круг хозяев, нужно было идентифицировать и охарактеризовать ген(ы) протоксина, и в первую очередь выяснить, где они локализованы: в плазмиде или в хромосомной ДНК. Чтобы проверить гипотезу плазмидной локализации, штамм В. thuringiensis, продуцирующий токсин, можно конъюгировать со штаммом, не обладающим инсектицидной активностью. Передача хромосомной ДНК во время конъюгации происходит крайне редко, и если «дефектный» штамм приобретает способность синтезировать инсектицид, значит, токсиновые гены локализованы в плазмиде.
Для идентификации гена, кодирующего протоксин , используют обычную методику. В. thuringiensis выращивают в культуре и лизируют клетки. Выделяют суммарную клеточную ДНК и центрифугируют ее в градиенте плотности CsCl, чтобы разделить плазмидную и хромосомную ДНК. Если гены протоксинов входят в состав генома, создают банк клонов хромосомной ДНК. Если же они содержатся в плазмиде, то плазмидную ДНК фракционируют по размерам центрифугированием в градиенте плотности сахарозы. Это обогащает ту плазмидную фракцию, которая послужит в дальнейшем исходным материалом для идентификации генов протоксинов (рис. 15.3).
Ген протоксина B. thuringiensis subsp. kurstaki находится на одной из семи плазмид длиной 2,0; 7,4; 7,8; 8,2; 14,4; 45 и 71 т. п. н. Чтобы определить, в какой именно, проводили центрифугирование плазмидной ДНК в градиенте плотности сахарозы. Были выделены три фракции, в кото-
 |
| Рис. 15.3. Выделение и фракционирование плазмид, одна из которых несет ген протоксина. |
рых концентрировались малые (2,0 т. п. н.), средние (7,4; 7,8; 8,2 и 14,4 т. п. н.) и большие (45 и 71 т. п. н.) плазмиды. Малые плазмиды из рассмотрения были исключены, поскольку они не могли кодировать белок мол. массой 130 кДа. Длина нуклеотидной последовательности, кодирующей белок такого размера, должна превышать 4,0 т. п. н. Средние и большие плазмиды подвергли частичному гидролизу рестрицирующей эндонуклеазой Sau3АI и фрагменты встроили в BamHI-сайт плазмиды pBR322. Полученными рекомбинантными плазмидами трансформировали клетки E. соli, а затем провели иммунологический скрининг по следующей схеме:
336 ГЛАВА 15
1. Колонии клеток перенесли с агара на нитроцеллюлозный фильтр.
2. Перенесенные клетки частично лизировали органическими растворителями.
3. Все сайты неспецифического связывания первых и вторых антител на фильтре блокировали с помощью бычьего сывороточного альбумина (БСА).
4. Обработанные БСА фильтры инкубировали с кроличьими антителами к искомому инсектициду.
5. Отмывали фильтры от несвязавшихся антител и обрабатывали 125I-меченным А-белком Staphylococcus aureus, который взаимодействует с Fc-фрагментом связанных антител.
6. Области на фильтре, которые соответствуют колониям, активно синтезирующим инсектицид, выявляли с помощью радиоавтографии.
Используя идентифицированный ген протоксина в качестве гибридизационного зонда, установили, что соответствующая нуклеотидная последовательность содержится в плазмиде В. thuringiensis subsp. kurstaki длиной 71 т. п. н. Аналогичная схема клонирования и скрининга использовалась для идентификации генов токсинов, локализованных в плазмидах или (реже) в хромосомной ДНКдругих штаммов В. thuringiensis.
Генная инженерия генов токсинов В. thuringiensis
После идентификации токсинового гена В. thuringiensis была определена первичная структура кодируемого им белка. Сравнен ие аминокислотных последовательностей разных белковых токсинов показало, что белки некоторых штаммов имеют одинаковый домен, ответственный за токсичность. Кроме того, был субклонирован сегмент полной кодирующей последовательности, с которого синтезировался укороченный белок, в полной мере сохранивший свою токсичность. Таким образом, при последующих генноинженерных манипуляциях могут использоваться интактный ген токсина, его фрагмент или химически синтезированный олигонуклеотид.
В естественных условиях большинство протоксинов В. thuringiensis синтезируются только во время споруляции, т. е. параспоральный кристалл образуется только на определенной стадии развития микроорганизма. Если бы экспрессия гена токсина происходила во время всего жизненного цикла, можно было бы существенно увеличить количество получаемого токсина и уменьшить время его синтеза. Кроме того, это позволило бы сделать синтез токсина непрерывным процессом и тем самым значительно удешевить продукт, поскольку для непрерывной ферментации используют небольшие, а потому менее дорогие биореакторы и оборудование, чем для периодической (более подробно см. об этом в гл. 16).
Во время споруляции В. thuringiensis специфический фактор инициации транскрипции (сигма-фактор) связывается с промоторами генов, функционирующих только на этой стадии жизненного цикла бактерии, так что синтезируются матричные РНК (мРНК), специфичные для споруляции. Следовательно, чтобы добиться непрерывной экспрессии инсектицидного гена (генов) В. thuringiensis, необходимо поместить его (их) под контроль промотора, функционирующего в течение всего жизненного цикла.
Для этого фрагмент ДНК. содержащий ген токсина без его собственного промотора, встроили в плазмиду так, чтобы он находился под контролем активного конститутивного промотора гена устойчивости к тетрациклину, который ранее был вырезан из плазмиды Bacilluscereusи введен в В. thuringiensis. На всех этапах развития микроорганизма непрерывно синтезировался полноценный токсичный белок (рис. 15.4). Кроме того, когда этой конструкцией трансформировали мутантный штамм В. thuringiensis, не способный к споруляции, токсин все равно синтезировался. При этом процесс был гораздо более эффективным, чем в случае В, thuringiensis дикого типа: количество получаемого продукта было больше, а израсходованное количество субстрата и время синтеза -значительно меньше.
Дальнейшее усовершенствование этой системы могло бы состоять во введении токсинового гена, экспрессирующегося в течение всего жизненного цикла, в хромосомную ДНК штамма В. thuringiensis, не способного к споруляции. Это гарантировало бы сохранность гена при непрерывной ферментации, что не всегда достигается
Микробные инсектициды 337
| Рис. 15.4. Клонирование фрагмента гена токсина В. thuringiensis subsp. kurstaki под контролем промотора гена устойчивости к тетрациклину (pTet). Из выделенного гена В. thuringiensisудаляют его собственный промотор с помощью рестриктаз RE1 и RE2. Полученный фрагмент встраивают в плазмидный вектор рядом с промотором pTet вместо гена устойчивости к тетрациклину, удаленного с помощью рестриктаз RE1 и RE2, и лигируют при участии ДНК-лигазы фага Т4. | 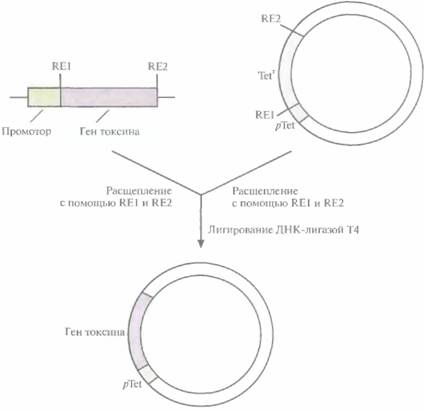 |
