Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
ГЛАВА 16. |
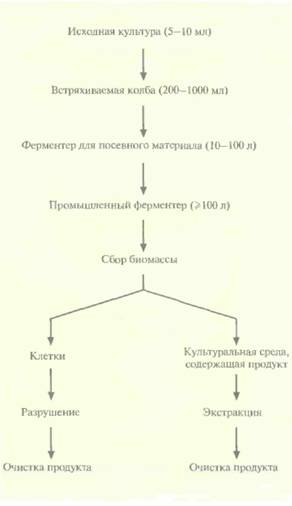 | Рис. 16.1. Обобщенная схема процесса промышленной ферментации. Выделяемый продукт находится либо в клетках, либо в культуральной среде, но не в обеих фракциях одновременно, так что дальнейшие манипуляции проводят с одной из этих фракций. |
или в непрерывной культуре (рис. 16.2). В первом случае микроорганизмы выращивают в стерильных условиях без добавления в ходе ферментации свежей культуральной среды. Во втором случае по ходу ферментации к культуре периодически добавляют увеличивающиеся количества питательных веществ, при этом культуральную среду не удаляют до окончания процесса. При непрерывной ферментации свежая культуральная среда поступает в ферментер непрерывно, и параллельно отводится такой же объем клеточной суспензии. Во всех случаях через среду при необходимости продувают кислород (обычно в виде стерильного воздуха), добавляют пеногаситель и (если это нужно) кислоту или основание.
Промышленный синтез белков при участии рекомбинантных микроорганизмов 351
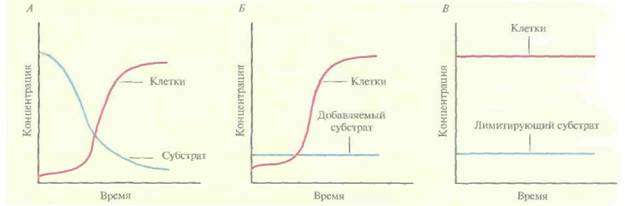 |
| Рис. 16.2. Изменение во времени концентрации клеток и субстрата в периодической культуре (А), периодической культуре с добавлением субстрата (Б) и в непрерывной культуре (В). |
Периодическая культура
В ходе периодической ферментации состав культуральной среды, концентрация микроорганизмов (концентрация биомассы), химический состав клеток и количество белкового продукта или метаболита зависят от фазы роста, клеточного метаболизма и наличия питательных веществ. Различают шесть основных фаз роста: лаг-фазу, фазу ускорения, логарифмическую (log), или экспоненциальную фазу, фазу замедления, стационарную фазу и фазу отмирания (рис. 16.3).
Обычно после инокуляции стерильной культуральной среды мгновенного увеличения числа клеток не наблюдается. В течение какого-то периода времени, называемого лаг-фазой, клетки адаптируются к новым условиям: другим pH или концентрации питательных веществ, В ходе такой адаптации может произойти включение каких-то новых, ранее не проявившихся путей метаболизма. Лаг-фаза наблюдается всякий раз, когда посевной материал получен из культуры, рост которой прекратился n результате исчерпания субстрата или ингибирования продуктом (т. е. культуры в стационарной фазе). Продолжительность лаг-фазы зависит от времени, в течение которого клетки посевного материала находились в стационарной фазе, и от того, как сильно различались среда, в которой росла культура, и новая, свежая культуральная среда. Если же посевным материалом служит культура, находящаяся в экспоненциальной фазе, то выраженная лаг-фаза может отсутствовать и рост начнется немедленно после инокуляции. Между лаг- и экспоненциальной фазами есть короткий период, так называемая фаза ускорения, когда скорость роста клеток увеличивается до достижения постоянной величины.
Во время экспоненциальной фазы клетки претерпевают несколько делений, а удельная скорость роста остается постоянной. При из-
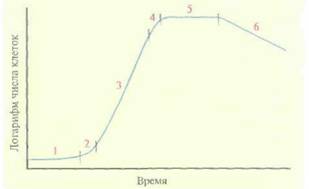 |
| Рис. 16.3. Кривая роста бактериальной культуры при периодической ферментации. 1 - лаг-фаза, 2 - фаза ускорения, 3 - экспоненциальная фаза, 4 - фаза замедления, 5 - стационарная фаза, 6 - фаза отмирания. |
352 ГЛАВА 16
бытке субстрата (питательных веществ) и в отсутствие ингибирования роста каким-либо соединением, присутствующим в культуральной среде, удельная скорость роста не зависит от концентрации субстрата. Кривую роста при таких условиях можно описать математически, что позволяет биотехнологам моделировать процесс, а затем провести его масштабирование. Прирост клеточной массы во времени dX/dtравен произведению удельной скорости роста μ на биомассу X:
dX/dt= μΧ.
Аналогично, прирост числа клеток dN/dtравен произведению удельной скорости μ на число клеток Ν:
dN/dt =μΝ.
Удельная скорость μ зависит от концентрации лимитирующего субстрата (источника углерода или азота) S, максимальной удельной скорости роста μmах и субстратспецифичной константы Ks:
μ = μmахS/(KS+S).
И S, и KS имеют размерность концентрации (г/л или М).
Иногда вместо удельной скорости роста используют время удвоения, или время генерации
Когда субстрат присутствует в избытке (т. е. при
В результате истощения лимитирующего субстрата (например, источника углерода) или накопления продуктов метаболизма, замедляющих рост, увеличение числа клеток постепенно прекращается и культура переходит в стационарную фазу. В это время биомасса остается постоянной, однако метаболизм часто претерпевает кардинальные изменения. Именно в этот период нередко синтезируются соединения (вторичные метаболиты), представляющие коммерческий интерес, например антибиотики. Продолжительность стационарной фазы зависит от конкретного организма и условий роста.
В фазе отмирания энергетические запасы клеток оказываются исчерпанными, и метаболизм прекращается. В большинстве промышленных процессов ферментацию останавливают и клетки собирают еще до наступления фазы отмирания.
Периодическая культура с добавлением субстрата
В этом случае в ферментер периодически добавляют субстрат, а конечный продукт собирают только по завершении процесса. Добавление субстрата приводит к удлинению экспоненциальной и стационарной фаз и к увеличению биомассы и количества метаболитов, синтезируемых во время стационарной фазы (например, антибиотиков). Однако в стационарной фазе микроорганизмы часто синтезируют протеолитические ферменты (протеиназы), разрушающие все производимые ими белки. Поэтому, если целью ферментации является получение белковых продуктов, нужно остановить процесс до его перехода в эту фазу. Прямое измерение концентрации субстрата в ходе ферментации часто бывает затруднено, и чтобы определить, в какой момент нужно добавить следующую порцию субстрата, приходится использовать другие показатели, коррелирующие с его расходованием, например количество синтезированных органических кислот, значение pH или количество образовавшегося СО2. Вообще говоря, ферментеры периодического действия с добавлением субстрата требуют постоянного и более тщатель-
Промышленный синтез белков при участии рекомбинантных микроорганизмов 353
ного контроля, чем простые ферментеры периодического действия, и поэтому используются реже. Но они имеют ряд преимуществ, если говорить о разработке систем получения белков с помощью рекомбинантных микроорганизмов, а потому становятся все более популярными.
Периодическое добавление субстрата к растущей культуре рекомбинантных микроорганизмов продлевает экспоненциальную фазу и отсрочивает наступление стационарной фазы, во время которой инициируются клеточные ответы на стрессовые воздействия, происходит синтез протеиназ и другие изменения метаболизма, уменьшающие выход рекомбинантного белка. Для поддержания метаболизма клетки-хозяина количество добавляемого субстрата необходимо постоянно увеличивать. Чтобы обеспечить непрерывный синтез рекомбинантного белка и его стабильность, нужно тщательно контролировать процесс и добавлять субстрат (источник углерода и азота вместе с микроэлементами) сразу, как только в этом возникнет необхолмость. В завпсимости от генотипа микроорганизма и природы рекомбинантного белка при периодической ферментации с добавлением субстрата выход продукта может возрасти на 25—1000 % по сравнению с простой периодической ферментацией.
Периодическую ферментацию с добавлением субстрата можно использовать для культивирования не только микроорганизмов, но и клеток млекопитающих и насекомых. Это очень важно, поскольку: ]) такие культуры все шире применяются для получения белковых продуктов, имеющих медицинское значение; 2) без периодического добавления субстрата животные клетки не очень эффективно синтезируют чужеродные белки.
Непрерывная культура
При непрерывной ферментации стационарные условия, т, е. условия, при которых dX/dt = 0, обеспечиваются тем, что при постоянном объеме биореактора убыль числа клеток (удаление продукта) в точности уравновешивается их увеличением в результате деления. Говоря более формальным языком, для непрерывного процесса в стационарном состоянии скорость разведения D, определяемая как скорость притока
среды F, деленная на постоянный объем среды Vв биореакторе,
D= F/V,
равна удельной скорости роста μ: D=(dX/dt)(1/X)= μ.
Чтобы получить непрерывную культуру с постоянными гидродинамическими характеристиками, нужно создать условия, при которых удельная скорость роста была бы ниже максимальной величины µmax. Для этого нужно так отрегулировать насос, который контролирует скорость притока F, чтобы объем культуры в биореакторе Vподдерживался постоянным.
Важнейшей задачей промышленной ферментации является получение максимального количества продукта при минимуме затрат. Эту задачу можно решить, если для каждого конкретного процесса разрабатывать свою, наиболее эффективную конструкцию ферментера. Вообще говоря, непрерывная ферментация применяется в промышленных целях не так уж часто, прежде всего потому, что ученые накопили наибольший , опыт в работе с периодическими культурами. При этом стоимость получения данного количества биомассы в ферментере непрерывного действия гораздо ниже, чем в ферментере, работающем в периодическом режиме. Такое удешевление обусловливается следующими факторами.
• Для получения данного количества продукта с помощью непрерывной ферментации нужны меньшие биореакторы, чем с помощью периодической.
• При периодической ферментации для сбора клеток, их разрушения и последующей очистки белкового продукта или метаболита, синтезированного микроорганизмом, необходимо крупногабаритное оборудование. В то же время в ферментере непрерывного действия синтез идет постепенно, так что и оборудование может быть не столь громоздким.
• Ферментер, работающий в непрерывном режиме, не простаивает, как ферментер, периодического действия, который нужно время от времени разгружать и подготавливать к повторному использованию. Простой биоре-
354 ГЛАВА 16
актора в связи с ремонтом, чисткой или стерилизацией — основная причина снижения эффективности процесса. При непрерывной ферментации этот простой гораздо меньше.
• Физиологический статус большинства клеток при непрерывной ферментации одинаков, поэтому синтез происходит более согласованно. При периодической же ферментации небольшие различия во времени сбора клеток, который проводят начиная с середины экспоненциальной фазы и заканчивая ее поздним этапом, могут приводить к значительной рассогласованности.
Непрерывную ферментацию уже использовали для промышленного получения белков одноклеточных микроорганизмов, антибиотиков и органических растворителей.
Впрочем, этот способ имеет и свои недостатки.
• Время ферментации в непрерывном режиме иногда составляет 500—1000 ч, при этом некоторые клетки могут потерять рекомбинантные плазмиды. Клетки, не несущие плазмид, обычно расходуют меньше энергии и делятся быстрее, чем те, которые содержат плазмиду, поэтому со временем выход продукта может снижаться из-за уменьшения числа клеток, способных его синтезировать. Эту проблему можно было бы решить, интегрировав клонированный ген в геном организма хозяина.
• Очень трудно поддерживать стерильные условия в промышленных установках в течение долгого времени. Кроме того, для непрерывных процессов необходимо стерильное резервное оборудование, что значительно увеличивает основные затраты.
• К качеству компонентов культуральной среды, используемой при крупномасштабной ферментации, не предъявляются столь высокие требования, как к компонентам среды при ферментации в лабораторных условиях; они могут изменяться от одного процесса к другому, что может приводить к изменению физиологии клеток и снижению производительности.
Репутация периодической ферментации как весьма надежной системы сдерживает переход к любому другому типу ферментации, даже при том что непрерывный режим работы более эффективен. И все-таки недавно было создано сразу несколько установок, лабораторных (до 10 л) и пилотных (до 1000 л), для непрерывной и периодической ферментации с добавлением субстрата — с целью получения белков с помощью рекомбинантных микроорганизмов. Это говорит о том, что более широкое применение непрерывных ферментеров и периодических ферментеров с добавлением субстрата в промышленности -это только вопрос времени.
