Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
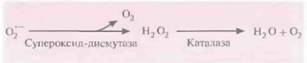
Получение растений, противостоящих неблагоприятным воздействиям и старениюВ отличие от большинства животных, растения физически не могут защитить себя от неблагоприятных воздействий со стороны окружающей среды; высокой освещенности, ультрафиолетового облучения, высоких температур и концентрации солей и т. д., поэтому в процессе эволюции у них выработались физиологические механизмы противодействия экстремальным условиям. Одним из нежелательных последствий физиологического стресса является образование радикалов кислорода. Разумно было предположить, что если удастся создать растения, толерантные к большим концентрациям радикалов кислорода, то такие растения смогут противостоять различным неблагоприятным воздействиям. Окислительный стрессНаиболее распространенным радикалом кислорода, представляющим опасность для растений, является супероксид-анион. Фермент супероксиддисмутаза нейтрализует это соединение, превращая его в пероксид водорода, который в свою очередь превращается в воду любой из множества клеточных пероксидаз или каталаз (рис. 18.12). В одном из экспериментов были получены трансформированные растения табака, несущие ген супероксиддисмутазы под контролем 358-промотора вируса мозаики цветной капусты. Они синтезировали супероксиддисмутазу и были устойчивы к повреждающему действию радикалов кислорода. У растений имеются несколько изоформ супероксиддисмутазы. Cu/Zn-супероксиддис- 404 ГЛАВА 18
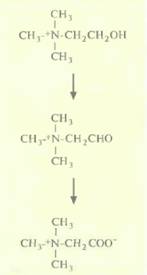
мутазы содержатся главным образом в хлоропластах и в небольшом количестве в цитозоле. Mn-супероксид-дисмутазы локализуются в митохондриях, а некоторые растения синтезируют Fe-супероксид-дисмутазу. Трансгенные растения табака, несущие «ДНК хлоропластом Cu/Zn-супероксид-дисмутазы под контролем 358-промотора вируса мозаики цветной капусты, были гораздо более устойчивы к яркому свету, чем нетрансформированные растения. Обнаружилось, что фотосинтетическая активность у трансгенных растений сохранялась на 94% в условиях, при которых нетрансформированные растения полностью ее утрачивали. Трансгенные растения, синтезирующие Мn-супероксиддисмутазу, аккумулирующуюся в хлоропластах, были в три-четыре раза менее чувствительны к повреждающему действию озона, чем контрольные нетрансформированные. Повышение уровня супероксиддисмутазы дает еще одно преимущество: растения становятся более устойчивыми к гербициду метилвиологену и к световому воздействию. Супероксид-дисмутаза способствует также сохранению срезанных цветов при транспортировке. Их увядание тоже происходит в результате образования радикалов кислорода. Если бы удалось создать трансгенные растения, содержащие ген супероксид-дисмутазы, который находится под контролем промотора, специфичного для цветков, это могло бы отсрочить их увядание. Солевой стрессМногие растения произрастают в регионах, где часто бывают засухи или где сильно засолена почва. Чтобы приспособиться к этим условиям, они синтезируют низкомолекулярные нетоксичные вещества — осмопротекторы. Эти вещества способствуют поглощению и удержанию воды, а также предотвращают разрушение мак- ромолекул, присутствующих в клетках растений, под действием высоких концентраций солей. Осмопротекторами являются такие хорошо известные соединения, как сахара, спирты, пролин и четвертичные соединения аммиака. Одним из высокоактивных осмолитиков является бетаин, который накапливается в некоторых растениях во время засухи или при высокой засоленности. Некоторые важные сельскохозяйственные культуры, в том числе картофель, рис, томаты, не способны накапливать бетаин. Защитить такие растения можно было бы введением в них генов, кодирующих ферменты биосинтеза бетаина. Как у растений, так и у бактерий бетаин синтезируется из холина в две стадии (рис. 18.13). У таких растений, как шпинат, превращение холина в бетаинальдегид катализируется холинмонооксигеназой, а последующее превращение в бетаин — бетаинальдегид-дегидрогеназой. У бактерий типа Е. соli обе стадии катализируются одним ферментом — холиндегидрогеназой. Поэтому при создании солеустойчивых сортов табака была использована A. tumefaciensдля трансформации растительных клеток вектором на основе Ti-плазмид, несущим ген betA Ε. соli, который кодирует холиндегидрогеназу; ген находился под контролем 35S-промотора вируса мозаики
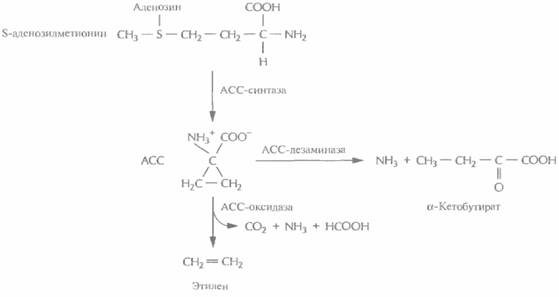
Генная инженерия растений: применение 405 цветной капусты. Растения, в которых экспрессировался ген betA E. coli, были на 80% более устойчивы к высоким концентрациям солей (примерно 300 мМ), чем нетрансформированные контрольные. По-видимому, осмозащиту можно еще более повысить, если использовать для контроля экспрессии гена betA тканеспецифический промотор. Созревание плодовСерьезной проблемой при транспортировке фруктов и овощей является их преждевременное созревание и размягчение. Установлено, что при созревании плодов в растениях активируются специфические гены, кодирующие ферменты целлюлазу и полигалактуроназу, и если подавить экспрессию одного или нескольких из них, то созревание может начаться позже. Для инактивации указанных генов были созданы трансгенные растения, в которых синтезировались антисмысловые РНК-версии этих генов. При введении гена, кодирующего антисмысловую полигалактуроназную РНК, в растения томата — культуры, ежегодно приносящей в США 1,3 млрд. долл. прибыли, — и количество соответствующей мРНК, и активность фермента уменьшились на 90%. Такие генетически трансформированные томаты известны как FLAVR SAVR. 18 мая 1994 г. Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств США пришел к выводу, что томаты FLAVR SAVR столь же безопасны, как и полученные обычным скрещиванием, а потому при их продаже нет необходимости указывать их происхождение. Регулятор роста растений этилен иницирует экспрессию множества генов, ответственных за созревание и старение плодов. Он синтезируется из S-аденозилметионина с образованием промежуточного продукта, 1-аминоциклопропан-1-карбоновой кислоты (АСС) (рис. 18.14). Обработка растений химическими препаратами, блокирующими синтез этилена, задерживает и созревание плода, и старение. Таким образом, преждевременное созревание плода можно пре-
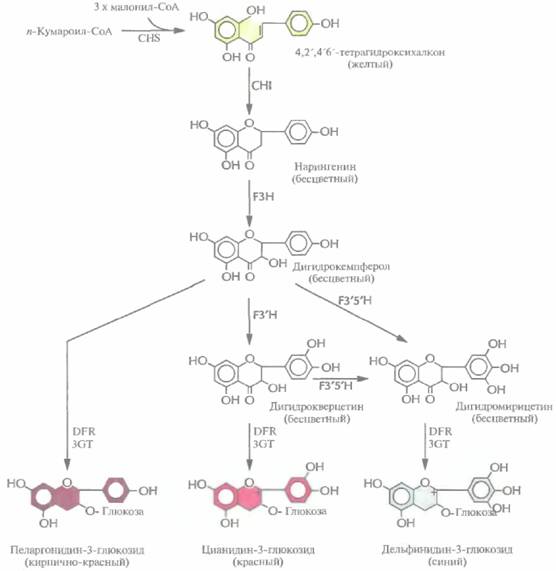
406 ГЛАВА 18 дотвратить подавлением способности растения синтезировать этилен. Для этого можно использовать разные подходы (рис. 18.14). Так, были созданы трансгенные растения, синтезирующие антисмысловые версии мРНКлибо АСС-синта-зы, либо АСС-оксидазы, ферментов, необходимых для синтеза растением этилена. У таких растений уровень этилена был гораздо ниже нормы, а потому плоды имели длительный срок хранения. Кроме того, при помощи скрининга было идентифицировано большое количество штаммов почвенных бактерий, разрушающих АСС. Ген фермента АСС-дезаминазы, выделенный из одного такого штамма, был помещен под контроль 35S-промотора вируса мозаики цветной капусты и встроен в геном томата. Полученные растения синтезировали меньше этилена, чем нормальные, а их плоды тоже имели гораздо более длительный срок хранения. Большинство работ по выведению трансгенных растений с пониженным содержанием этилена касаются томатов, но имеется одно сообщение о создании трансгенной мускусной дыни с такими же свойствами. Все эти данные говорят о том, что данный подход может быть весьма результативным применительно к различным плодовым культурам. Изменение окраски цветковЦветоводы все время стараются создавать растения, цветки которых имеют более привлекательный внешний вид и лучше сохраняются после того, как их срежут. С помощью традиционных методов скрещивания за многие годы были выведены тысячи новых сортов, отличающихся друг от друга цветом и формой цветков. Однако скрещивание растений — это кропотливая процедура, требующая много времени и имеющая свои ограничения, связанные с генным пулом конкретного вида; поэтому, например, никому не удалось вывести синюю розу. В качестве альтернативы для выведения цветов с необычной окраской можно использовать методы, основанные на манипуляциях с генами ферментов биосинтеза антоцианинов. Антоцианины, соединения класса флавоноидов, являются наиболее распространенными пигментами цветков. Они синтезируются из аминокислоты фенилаланина в ходе нескольких ферментативных реакций. Окраска цветка определяется химическими свойствами их боковой цепи, при этом производные цианидина ответственны за красный цвет, а производные дельфинидина зa синий (рис. 18.15). Дигидрофлавонол-4-редуктаза петуньи катализирует превращение бесцветного дигидро-кверцетина в цианидин-3-глюкозид, соединение красного цвета, а бесцветного дигидромирицетина — в синий дельфинидин-3-глюкозид, но не может использовать в качестве субстрата бесцветный дигидрокемпферол (рис, 18.15). Однако после трансформации петуньи геном дигидрофлавонол-4-редуктазы кукурузы ее цветки приобретают кирпично-красную окраску. Этот необычный цвет, никогда ранее у петуний не наблюдавшийся, обусловлен синтезом в трансгенном растении пеларгонидин-3-глюкозида из дигидрокемпферола. Примерно 70% объема индустрии цветоводства приходится на долю четырех растений: роз, гвоздик, тюльпанов и хризантем, поэтому все усилия по получению генетически трансформированных растений с цветками измененной окраски были направлены на работы именно с этими растениями. Например, были выведены трансгенные хризантемы, несущие смысловые и антисмысловые конструкции кДНК халконсинтазы. Этот фермент катализирует первую стадию биосинтеза антоцианина (рис. 18.15), Ученые исходили из того, что и смысловые, и антисмысловые кДНК будут подавлять экспрессию гена халконсинтазы в трансгенных растениях. «Смысловая супрессия», называемая также «косупрессией», состоит в том, что в присутствии дополнительной копии эндогенного гена подавляется накопление соответствующей мРНК. Молекулярные основы этого явления до настоящего времени не установлены. Антисмысловая же РНК халконсинтазы блокирует трансляцию эндогенной халконсинтазной мРНК. Смысловые и антисмысловые конструкции, находящиеся под контролем 35S-промотора вируса мозаики цветной капусты, были встроены в бинарный вектор на основе Ti-плазмид и введены в клетки растений. У трех из 133 «смысловых» трансформантов и трех из 83 «антисмысловых» цветки были белыми, что указывало на подавление экспрессии эндогенного гена халконсинтазы, Генная инженерия растений: применение 407
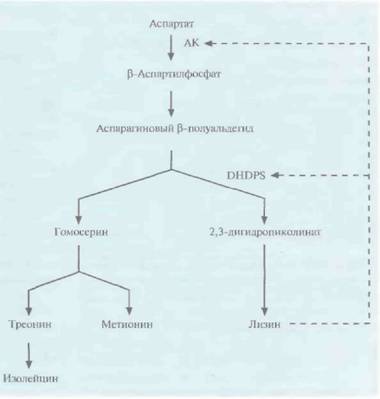
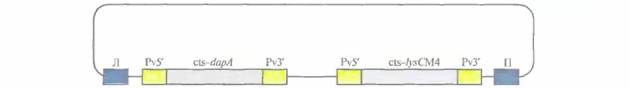
т. е. подавление синтеза антоцианина. Растения с белыми цветками вегетативно размножались черенками в полевых условиях и примерно у 90—98% из них продолжали образовываться белые, а не розовые цветки. Эта paботa является важной вехой в выведении новых сортов цветов с необычной окраской, представляющих коммерческий интерес. Изменение пищевой ценности растенийЗа многие годы агрономы и селекционеры достигли больших успехов в улучшении качества и повышении урожайности самых разных сельскохозяйственных культур. Однако традиционные методы выведения новых сортов растений, 408 ГЛАВА 18 основанные на их скрещивании, весьма трудоемки и требуют много времени, а их возможности ограничены вследствие ограниченности набора генов у скрещиваемых линий. Генноинженерные методы не только позволяют ускорить процесс получения растений с улучшенными свойствами, но и создавать сорта с новыми признаками, которые невозможно было бы передать растениям с помощью традиционных методов скрещивания. Например, в лабораторных условиях уже получены такие культуры с улучшенными пищевыми качествами, как кукуруза и горох. При этом был изменен аминокислотный состав некоторых запасных белков их семян. Кроме того, созданы сорта масличных культур (как пищевых, так и непищевых) с измененным жирнокислотным составом плодов, а также предпринята попытка улучшить вкус фруктов путем введения в растения гена мо-неллина, белка, имеющего сладкий вкус. АминокислотыЗапасные белки, которые служат источниками углерода и азота прорастающих семян, состоят из ограниченного повторяющегося набора аминокислот. Пищевая ценность этих белков невелика, поскольку в них отсутствуют одна или несколько незаменимых аминокислот (обычно лизин или метионин). Аминокислотный состав запасных белков семян можно немного изменить обычным скрещиванием, а недавно для этих целей были использованы генноинженерные методы. В одном из предварительных экспериментов в растения табака был введен ген фазеолина из фасоли, кодирующий запасной белок, который состоит из самых разных аминокислот. Ген эффективно экспрессировался, а белковый продукт доставлялся в нужный компартмент. Кроме того, специфически изменив in vitro нуклеотидную последовательность генов запасных белков семян, можно было синтезировать белок с нужным аминокислотным составом. Если аминокислотные замены происходят вблизи гипервариабельной области С-концевого участка молекулы, то ее структура не нарушается. Правильная укладка цепи остается и при прорастании семян. Чтобы увеличить содержание лизина в семенах, была предпринята попытка нарушить регуляцию его биосинтеза. Аминокислоты лизин, треонин, метионин и изолейцин синтезируются из аспартата (рис. 18.16) в несколько этапов. Первый этап состоит в фосфорилировании аспартата аспартаткиназой (АК) с образованием ß-аспартилфосфата. Далее, при биосинтезе лизина, происходит конденсация аспарагинового ß-полуальдегида с пировиноградной кислотой, катализируемая синтазой дигидродипиколиновой кислоты (DNDPS). Регуляция обеих ферментативных активностей (АК и DNDPS) осуществляется с помощью лизина по принципу обратной связи, которую нужно разорвать, чтобы синтез лизина ничем не ограничивался. Для этого использовали гены DNDPS и АК, не чувствительные к ингибированию лизином, из Corynebacteriumи Е. coliсоответственно. К каждому из этих генов «пришивали» нуклеотидную последовательность, кодирующую лидерный пептид, транспортирующий белки в хлоропласты, снабжали каждый из генов семяспецифичным промотором и вводили их в растения канолы и сои в составе бинарного вектора на основе Ti-плазмид (рис. 18.17). В семенах трансгенных растений содержалось в 100 раз больше свободного лизина, чем в семенах обычных растений; при этом содержание лизина во всех белках семян канолы было в два раза больше, а в белках сои — в пять раз. Когда кукуруза используется в качестве корма для скота, к ней добавляют соевую муку и очищенный лизин. Однако вместо того чтобы использовать дорогостоящий лизин, можно добавлять к кукурузе дешевую соевую муку, полученную из трансгенных растений сои, которые синтезируют в больших количествах лизин. Возможно, используя этот подход, успешно примененный на сое, удастся вывести сорт кукурузы, в семенах которой повышено содержание лизина. Такая кукуруза имела бы большую пищевую ценность. ЛипидыПо оценкам, в 1995 г, во всем мире было выработано растительного масла на сумму примерно 45 млрд. долл., а к 2010 г. эта величина составит Генная инженерия растений: применение 409
С помощью генной инженерии можно изменять степень ненасыщенности (т. е. число двойных связей С=С) и длину цепи этих кислот. Было создано и проверено в полевых условиях множество трансгенных сортов канолы, которые синтезировали масла с измененным жирно-кислотным составом (табл. 18,6). Каждый трансгенный сорт содержал один Дополнительный ген. Например, растения, синтезирующие в 70 млрд. долл. Более 90% масла расходуется на производство маргарина, жиров, масла для са-лата и для жарки. Примерно 75% всех масличных культур приходится на долю сои, пальмы, рапса (канолы) и подсолнечника, а получаемые из них масла состоят главным образом из следующих жирных кислот: пальмитиновой, стеариновой, олеиновой, линолевой и линоленовой (табл. 18.5). 410 ГЛАВА 18
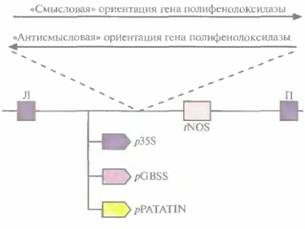
большом количестве стеариновую кислоту, несли антисмысловую копию гена стеаратдесатуразы Brassica;при этом подавлялась экспрессия нормального гена канолы, что приводило к накоплению стеариновой кислоты, которая обычно превращалась в олеиновую. Успехи, достигнутые в получении трансгенных сортов канолы, позволяют надеяться, что в будущем этот подход найдет широкое применение и позволит создать новые, представляющие коммерческую ценность сорта. Изменение вкуса и внешнего вида плодовИзменение внешнего видаИзменение цвета собранных овощей и фруктов создает серьезные проблемы при их реализации. Один из способов борьбы с изменением внешнего вида пищевых продуктов состоит в использовании различных пищевых добавок, что, впрочем, создает другие проблемы. Так, недавно возникли сомнения относительно безопасности одного из видов добавок — сульфитов. Изменение цвета овощей и фруктов начинается с окисления монофенолов и о-дифенолов до о-хинонов. Катализатором процесса служат ферменты полифенолоксидазы. Они кодируются ядерной ДНК, имеют мол. массу примерно 59 000 и локализуются в мембранах хлоропластов и митохондрий. Предположение о том, что ингибирование полифенолоксидазы поможет решить проблему изменения цвета плодов, было проверено на трансгенном картофеле, несущем различные кДНК-конструкции полифенолоксидазы. Были созданы векторы, содержащие фрагмент или полноразмерную кДНК полифенолоксидазы картофеля в «смысловой» или «антисмысловой» ориентации, которые находились под контролем одного из трех промоторов: 355-промстора вируса мозаики цветной капусты, промотора гена синтазы гранулосвязанного крахмала или промотора гена пататина (рис. 18.18). Последние два промотора специфичны для клубней картофеля. Два коммерческих сорта картофеля,
Генная инженерия растений; применение 411
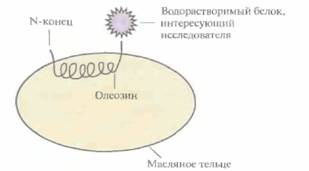
трансформированные этими конструкциями, были высокоустойчивы к черной пятнистости (ферментативное изменение цвета), причем уровень устойчивости был гораздо выше, чем тот, которого удавалось достичь при обычном скрещивании. Трансгенные растения, несущие кДНК полифенолоксидазы, преднамеренно повреждали, а затем оценивали их устойчивость к черной пятнистости. Большинство трансгенных растений, в геноме которых присутствовал ан-тисмысловой вариант гена полифенолоксидазы, находящегося под контролем либо 35S-промотора вируса мозаики цветной капусты, либо промотора гена синтазы гранулосвязанного крахмала, были значительно более устойчивы, чем нетрансформированные. Активность промотора гена пататина в клубнях картофеля, по-видимому, проявлялась лишь частично, и накопление полифенолоксидазы не блокировалось. Все растения, содержащие смысловые конструкции, синтезировали полифенолоксидазу в большем количестве и были подвержены поражениям в большей степени, чем контрольные. Хотя все эти результаты носят сугубо предварительный характер, описанный подход может оказаться полезным для борьбы с ферментативным изменением цвета плодов различных коммерчески ценных растений. Изменение вкусаНевкусные фрукты и овощи вряд ли будут пользоваться покупательским спросом, даже если они имеют высокую пищевую ценность. Конечно, вкус пищевых продуктов можно улучшить в процессе приготовления добавлением соли, сахара, ароматизаторов или других добавок, однако с экономической точки зрения было бы лучше, если бы пищевые продукты исходно обладали необходимыми вкусовыми качествами и выглядели более аппетитно. В плоде африканского растения Dioscorephyllum cumminsii Diels содержится белок монеллин, примерно в 100 000 раз более сладкий, чем сахароза в эквимолярных количествах. Этот белок вполне может служить заменителем сахара, обладающим еще и тем преимуществом, что, не являясь углеводом, он не должен оказывать вредного воздействия на метаболизм. Монеллин — это двухцепочечный димер; А-цепь состоит из 45 аминокислотных остатков, B-цепь — из 50. Цепи связаны между собой слабыми нековалентными связями, и это ограничивает его применение в качестве подсластителя, поскольку при нагревании в процессе приготовления пищи или под действием кислот (например, лимонной или уксусной) он легко диссоциирует и теряет свои вкусовые качества, Задача создания трансгенных растений или микроорганизмов, способных синтезировать монеллин, усложняется тем, что необходимо клонировать и координированно экспрессировать два отдельных гена. Чтобы решить эту проблему, был химически синтезирован ген монеллина, кодирующий А- и B-цепи как один полипептид. Были созданы трансгенные растения томата и салата, синтезирующие химерный белок. Для этого использовали два разных промотора. В случае томатов это был Е8-промотор, специфичный для плодов и активизирующийся в самом начале их созревания. В растениях салата ген находился под контролем 35S-промотора вируса мозаики цветной капусты. В обоих случаях использовались сайты терминации 412 ГЛАВА 18 транскрипции/полиаденилирования гена нопалинсинтазы в составе Ti-плазмиды. Синтетический ген монеллина вводили в растительные клетки инфицированием их A. tumefaciens, используя коинтегративную векторную систему на основе Ti-плазмид. Монеллин был обнаружен в зрелых и частично зрелых плодах и в листьях салата, но не в зеленых помидорах, при этом его содержание в томатах повышалось при резком повышении концентрации растительного гормона этилена. Сообщения о всесторонних испытаниях вкусовых качеств генетически подслащенных пищевых продуктов пока отсутствуют, но если результаты окажутся положительными, то описанный способ подслащения плодов можно будет использовать для многих культур. Растения как биореакторыРастения дают большое количество биомассы, а выращивание их не составляет труда, поэтому разумно было попытаться создать трансгенные растения, способные синтезировать коммерчески ценные белки и химикаты. В отличие от ре-комбинантных бактерий, которых культивируют вбольш их биореакторах (при этом необходимы высококвалифицированный персонал и дорогостоящее оборудование), для выращивания сельскохозяйственных культур не нужно больших средств и квалифицированных рабочих. Основная проблема, которая может возникнуть при использовании растений в качестве биореакторов, будет связана с выделением продукта введенного гена из массы растительной ткани и сравнительной стоимостью производства нужного белка с помощью трансгенных растений и микроорганизмов. Уже созданы экспериментальные установки по получению с помощью растений моноклональных антител, функциональных фрагментов антител и полимера поли-р-гидроксибутирата, из которого можно изготавливать материал, подверженный биодеградации, АнтителаПроизводство антител и их фрагментов с помощью трансгенных растений имеет ряд преимуществ перед их синтезом в клетках рекомбинантных микроорганизмов. Трансформация растений носит стабильный характер, чужеродная ДНК практически необратимо встраивается в растительный геном, в то время как большинство микроорганизмов трансформируются плазмидами. которые могут утрачиваться в ходе длительной или крупномасштабной ферментации. Кроме того, процессинг и укладка чужеродных белков в растениях аналогичны таковым в животных клетках, в то время как в бактериях процессинг, укладка и посттрансляционные модификации эукариотических белков затруднены. Кроме того, крупномасштабное выращивание растений не требует больших затрат и не лимитируется возможностями процессов ферментации. И наконец, можно создать условия, при которых чужеродные белки будут синтезироваться в семенах, где их целостность не нарушится длительное время. ПолимерыКрупномасштабный бактериальный синтез поли-β-гидроксибутирата, полимера, из которого получают пластик, подверженный биодеградации, обходится довольно дорого. Поэтому интересно было выяснить, можно ли получать этот полимер с помощью трансгенных растений, В бактериях типа Alcaligeneseutrophusполи-β-гидроксибутират синтезируется из ацетил-СоА в три стадии, катализируемые тремя ферментами (см. рис. 12.22), гены которых входят в один оперон. Растения неспособны процессировать транскрипт оперо-на с более чем одним геном, поэтому каждый из генов был клонирован по отдельности и встроен в хлоропластную ДНК растения Arabidopsisthaliana. Хлоропласты были выбраны потому, что, как показали выполненные ранее эксперименты, в цитоплазме полимер синтезировался в небольшом количестве, при этом большинство растений были чахлыми. Кроме того, в хлоропластах может накапливаться другой биополимер — крахмал. К каждому из трех генов поли- β -гидроксибутирата были присоединены фрагменты ДНК, кодирующие хлоропластную сигнальную последовательность малой субъединицы рибулозобисфосфат-карбоксилазы гороха, и каждый ген был помещен под транскрипционный контроль 35S-промотора вируса мозаики цветной капус- Генная инженерия растений: применение 413 ты. Гены были введены в растения A. thalianaв составе бинарных векторов на основе Ti-плазмид. Два трансгенных растения, каждое со своим чужеродным геном, скрещивали, чтобы получить растения с двумя чужеродными генами, включенными в хлоропластную ДНК. Затем трансгенное растение с двумя чужеродными генами скрещивали с растением, несущим третий чужеродный ген, и отбирали растения, несущие все три бактериальных гена поли-β-гидроксибутирата. В зрелых листьях некоторых трансгенных растений, экс-прессирующих все три бактериальных гена, синтезировалось более 1 мг поли-β-гидроксибутирата на I г сырой ткани листа. Эту работу можно считать первым важным шагом в создании сельскохозяйственных культур, которые можно использовать для получения в больших количествах поли-β-гидроксибутирата Чужеродные белки, аккумулирующиеся в семенахОлеозины, или белки масляных телец, содержатся в семенах различных растений. Они весьма гидрофобны и стабилизируют масляные тельца как дискретные структуры. При этом их N- и С-концевые участки более гидрофильны, чем внутренняя область молекулы, и экспонированы в водное окружение. Используя генную инженерию, можно попытаться создать реком-
бинантные белки из олеозинов и водорастворимых белков (рис. 18.19): рекомбинантные белки будут аккумулироваться в масляных тельцах, что позволит относительно легко их очистить. При этом водорастворимый белок будет экспонирован в водное окружение, и при необходимости его можно будет отщепить. Это позволяет значительно удешевить процедуру очистки белков, синтезируемых растениями. ЗАКЛЮЧЕНИЕВводя в геном растений чужеродные гены и обеспечивая их экспрессию, можно относительно быстро создавать новые сорта растений. Уже получены трансгенные растения, устойчивые к неблагоприятным условиям окружающей среды, к насекомым-вредителям, вирусам, гербицидам, окислительному и солевому стрессам. Выведены культуры с необычной окраской цветков, растения, имеющие более высокую пищевую ценность, растения с измененным вкусом плодов и т. д. Некоторые растения удалось модифицировать так, что они стали своеобразными фабриками по крупномасштабному синтезу ценных белков, например антител. Многочисленные трансгенные растения с измененными свойствами и повышенной пищевой ценностью прошли успешную проверку в лабораторных, а некоторые из них — в полевых условиях, К настоящему времени на рынок поступило лишь небольшое число генетически модифицированных растений, однако можно с уверенностью сказать, что в будущем они займут на нем достойное место. ЛИТЕРАТУРАAnanda Kumar Р., R. P. Sharma, V. S. Malik. 19%, The insecticidal proteins of Bacillus thuringïensis. Adv. Appl. Microbiol. 42: 1—43. Anderson E. J., D. M, Stark, R. S. Nelson, N. E. Turner, R. N. Beaehy. 1989. Transgenic plants that express the coat protein gene of TMV or A1MV interfere with disease development of non-related viruses. Phytopathology 12: 1284-1290. 414 ГЛАВА 18 Ayub R., M. Guis, M. Ben Amor, L. Gillot, J.-P. Roustan, A. Latehé, M. Bouzayen, J.-C. Pech. 1996. Expression of ACC oxidase antisense gène inhibits ripening of cantaloupe melon fruits. Nat. Biotechnol. 14: 862-866. Bachern С. W. В., G.-J. Speckmann, P. С. G. van der Linde, F. T. M. Verheggen, M, D. Hunt, J. C. StefTens, M. Zabeau. 1994. Antisense expression of polyphenol oxidase genes inhibits enzymatic browning in potato tubers. Bio/Technology 12: 1101-1105. Beachy R. N., S. Loesch-Fries, N. E. Turner. 1990. Coat protein-mediated resistance against virus infection. Annu. Rev. PhytopathoL 28: 451-474. Bird C. R., D. Grierson, J. A. Ray, W. W. Schuch. October 1993. Tomato plants and cells containing рТОМЗб antisense constructs. U.S. patent 5,254,800. Boulter D., A. M. R. Gatehouse, V, Hilder. 1989. Use of cowpea trypsin inhibitor (CpTI) to protect plants against insect prédation, Biotechnol. Adv. 7: 489-498. Bowler C., L· Stooten, S, Vandenbranden, R. De Rycke, J. Botterman, C. Sybesma, M. Van Montagu, D. Inze, 1991. Manganese Superoxide dismutase can reduce cellular damage mediated by oxygen radicals in transgenic plants. EMBQ J. 10: 1723-1732. Brünfte K. J., R. L. Meeusen. 1991. Insect control with genetically engineered crops. Trends Biotechnol. 9: 197-200. Cheng J., M. G. Boh/anl, R. C. Saxena, M. B. Sticklen. 1992, Production of insect resistant potato by genetic transformation with a δ-endotoxin from Bacillus thuringiens'ts var. kurstaki. Plant Set. 81: 83-91. Comai L., D, Facciotti, W. R. Hiatt, G. Thompson, R. E. Rose, D. M. Stalker 1985. Expression in plants of a mutant aroA gene from Salmonella typhimurium confers tolerance to glyphosate. Nature 317: 741-744. Corbin D. R., J. T. Greenplate, E. Y. Wong, J. Purcell. 1994. Cloning of an insecticidal cholesterol oxidase gene and its expression in bacteria and in plant protoplasts. Appl. Environ. Microbiol. 60: 4239-4244. Courtney-Gutterson N., C, Napoli, C. Lemieux, A. Morgan, E. Firoozabady, K. E. P. Robinson. 1994. Modification of flower color in florist's Chrysanthemum: production of a white-flowering variety through molecular genetics. Bio/Technology 12: 268-271. Cuozzo M., K. M. O'Connell, W. Kaniewski, R.-X. Fang, N.-H. Chua, N. E. Turner. 1988. Viral protection in transgenic tobacco plants expressing the cucumber mosaic virus coat protein or its antisense RNA. Bio/Technology 6: 549-557. Day A. G., E. R. Bejarano, K. W. Buck, M. Burrell, C. P. Lichtenstein. 1991. Expression of an anti-sense viral gene in transgenic tobacco confers resistance to the DNA virus tomato golden mosaic virus. Proc. Natl. Acad. Sa. USA 88: 6721-6725. Dekker J., S. O. Duke. 1995. Herbicide-resistant field crops. Adv. Agron. 54: 69—116. Detennay X., B. J. LaVaUee, R. K. Proksch, R. L, Fuchs, S. R. Sims, J. T. Greenplate, P. G. Marrone, R. B. Dodson, J. J. Augustin^, J. G. Layton, D. A. Fischhoff. 1989. Field performance of transgenic tomato plants expressing the Bacillus thuringiensis var. kurstakî insect control protein. Bio/Technology 7': 1265-1269. Duan X., X. Li, Q. Xue, M. Abo-FJ-Saad, D. Xu, R. Wu. 1996. Transgenic rice plants harboring an introduced potato proteinase inhibitor II gene are insect resistant. Nat. Biotechnol. 14:494—498. During K., P. Porseh, M. Fladung, H. Lorz. 1993. Transgenic potato plants resistant to the phy-topathogenic bacterium Erwinia carotovora. Plant. J. 3: 587-598. Ely S. 1993. The engineering of plants to express Bacillus thuringiensis δ-endotoxins, p. 105-124. in P. F. Entwistle, J. S, Cory, M. J. Bailey, S. Higgs (ed.), Bacillus thuringiensis, an Environmental Biopesticide: Theory and Practice. John Wiley & Sons, Chichester, United Kingdom. Falco S. C., T. Guida, M. Locke, J. Mauvais, C. Sanders, R. T. Ward, P, Webber. 1995, Transgenic canola and soybean seeds with increased lysine. Bio/Technology 13: 577-582. Fiedler U., U. Conrad. 1995. High-level production and long-term storage of engineered antibodies in transgenic tobacco seeds. Bio/Technology 13: 1090-1093. Fischhoff D. A., K. S. Bowdish, F. J. Perlak, P. G. Marrone, S. M. McConnick, J. G. Nfedermeyer, D. A. Dean, K. Kunsano-Kretzner, E. J. Mayer, Генная инженерия растений: применение 415 D. E. Rochester, S. G. Rogers, R. T. Fraley. 1987. Insect tolerant tomato plants. Bio/Technology 5: 807-813. Fitchen J. H., R. N. Beachj. 1993. Genetically engineering protection against viruses in transgenic plants. Annu. Rev. Microb'tol. 47: 739—763. Fuchs M., D. Gonsalves. 1995. Resistance of transgenic hybrid squash Z\V-20 expressing the coat protein genes of zucchini yellow mosaic virus and watermelon mosaic virus 2 to mixed infections by both potyviruses. Bio/Technology 13:1466-1473. Gray J. E., S. Picton, J, J. Giovannoni, D. Grierson. 1994. The use of transgenic and naturally occurring mutants to understand and manipulate tomato fruit ripening. Plant Cell Environ. 17: 557-571. Grison R., B. Grezes-Besset, M. Schneider, N. Lucante, L. Olsen, J.-J. Lcguay, A. Toppan. 1996. Field tolerance to fxmgal pathogens of Brassica napus constitutively expressing a chimeric chitinase gene. Nat. Biotechnol. 14: 643-646. Hilder V. A., A. M. R. Gatehouse, S. E. Sheerman, R. F. Barker, D. Boulter. 1987. A novel mechanism of insect resistance engineered into tobacco. Nature 330: 160-163. Hill K. K., N. Jarvis-Eagan, E. L. Halk, K. J. Krahn, L. W. Liao, R. S. Mathewson, D. J. Merlo, S. E. Nelson, K. E. Rashka, L. S. Loesch-Fries. 1991. The development of virus-resistant alfalfa, Medtcago saliva L. Bio/Technology 9: 373—377. Holton Τ. Α., F. Bniguera, D. R. Lester, Y. Tanaka, C. D. Hyland, J. G. T. Menting, C.-Y. Liu, E. Farcy, T. W. Stevenson, E. C. Cornish. 1993. Cloning and expression of cytochrome P450 genes controlling flower color. Nature 366: 276—279. Johnson R., J. Narvaez, G. An, C. Ryan. 1989. Expression of protease inhibitors 1 and II in transgenic tobacco plants: effects on natural defense against Manduca sexta larvae. Proc. Natl. Acad. Sei. USA 86: 9871-9875. Jongedijk E., A. A. J. M. de Schutter, T. Stolte, P. J. M. van den Elzen, B. J. C. Cornelissen, 1992. Increased resistance to potato virus X and preservation of cultivar properties in transgenic potato under field conditions. Bio/Technology 10: 422-429. Klee H. J., M. B. Hayford, K. A. Kretzmer, G. F. Barry, G. M. Kishore. 1991. Control of ethylene synthesis by expression of a bacterial enzyme in transgenic tomato plants. Plant CW/3: 1187- 1193. Knutzon D. S., G. A. Thompson, S. E. Radke, W. B. Johnson, V. С Knauf, J. С. Kridl. 1992. Modification of Brassica seed oil by antisense expression of a stearoylacyl carrier protein desaturase gene. Proc. Natl. Acad. Sei. USA 89:2624-2628. Lee W. S., J. T. C. Tzen( J. C. Kridl, S. E. Radke, A. H. C. Huang. 1991. Maize oleosin is correctly targeted to seed oil bodies in Brassica napus transformed with the maize oleosin gene. Proc. Natl. Acad. Sei. USA 88: 6181-6185. Lilius G., N. Holmberg, L. Bülow. 1996. Enhanced NaCl stress tolerance in transgenic tobacco expressing bacterial choline dehydrogenase. Bio/Technology 14: 177-180. Lin W., C. S. Anuratha, K. Datta, I. Potrykus, S. Muthukrishnan, S. K. Datta. 1995. Genetic engineering office for resistance to sheath blight. Bio/Technology 13: 686-691. Ling K., S. Namba, C. Gonsalves, J. L· Slightom, D. Gonsalves. 1991. Protection against detrimental effects of potyvirus infection in transgenic tobacco plants expressing the papaya ringspot virus coat protein gene. Bio/Technology 9:752-758. Lodge J. K., W. K. Kaniewski, N. E. Turner. 1993. Broad-spectrum virus resistance in transgenic plants expressing pokeweed antiviral protein. Proc. Nail. Acad. Sei. USA 90: 7089-7093. Ma J. K.-C., M. B. Hein. 1995. Immunotherapeutic potential of antibodies produced in plants. Trends Biotechnol. 13: 522-527. Macintosh S. C., G. M. Kishore, F. J. Perlak, P. G. Marrone, T. B, Stone, S, R. Sims, R. L. Fuchs. 1990. Potentiation of Bacillus thuringien-sis insecticidal activity by serine protease inhibitors. J. Agric. FoodChem.SS: 1145-1152. Meyer P., I. Heidmann, G. Forkmann, H. Saedler. 1987. A new petunia flower colour generated by transformation of a mutant with a maize gene. Nature 330: 677-678. Mol J. N. M., T. A. Holton, R. E. Koes. 1995. Floriculture: genetic engineering of commercial traits. Trends Biotechnol. 13: 350-355. Mol J. N. M., A. R. van der Krol, A. J. van Tunen, R. van Blokland, P. de Lange, A. R. Stuitje. 1990. Regulation of plant gene expression by antisense RNA. FEBSLett. 268:427-430. 416 ГЛАВА 18 Murphy D. J. 1996. Engineering oil production in rapeseed and other oil crops. Trends Biotechnol. 14:206-213. Nawrath C., Y. Poirier, С. Somerville. 1994. Targeting of polyhydroxybutyrate biosynthetic pathway to the plastids of Arabtdopsts thaliana results in high levels of polymer accumulation. Proc. Nail. Acad. Sei. USA 91: L2760-12764. Panarrubia L., R. Ют, J. Giovannoni, S.-H. Kim, R. L· Fischer. 1992. Production of the sweet protein monellin in transgenic plants. Bio/Technology 10: 561-564. Perlak F. J., R. W. Deaton, T. A. Armstrong, R. L. Fuchs, S, R. Sims, J. T. Greenplate, D. A- Fischhoff. 1990. Insect resistant cotton plants. Bio/Technolog}'8: 939-943. IVrlak l·. J., R. L Fuchs, D. A. Dean, S. L. McPherson, D. A. Fischhoff. 1991. Modification of the coding sequence enhances plant expression of insect control protein genes. Proc. NatL Acad, Sei. USA 88: 3324-3328. Powell P. A., D. M. Stark, P. R. Sanders, R. N. Beachy. 1989. Protection against tobacco mosaic virus in transgenic plants that express tobacco mosaic virus antisense RNA. Proc. Natl. Acad. Sei. USA 86: 6949-6952. Quinn J. P. 1990. Evolving strategies For the genetic engineering of herbicide resistance in plants. Biotechnol. Adv. 8: 321-333. Rooijen G. J. H., M. M. Moloney. 1995. Plant seed oil-bodies as carriers for foreign proteins. Bio/Technology 13: 72-77. Ryan C, A. 1990. Protease inhibitors in plants: genes for improving defenses against insect and pathogens. Annu. Rev.Phytopathol 28: 425-449. Sen Gupta A., R. P. Webb, A. S. Holaday, R. D. Allen. 1993. Overproduction of Superoxide dismutase protects plants from oxidative stress. Plant Physiol. 103: 1067-1073. Shade R. E., H. E. Schroeder, J. J. Pueyo, L. M. Tabe, L. L. Murdock, T. J. V. Higgins, M. J. Chrispeels. 1994. Transgenic pea seeds expressing the tx-amylase inhibitor of the common bean are resistant to bruchid beetles. Bio/Technology 12: 793-796. Shah D. M., C. M. T. Rommens, R. N. Beachy. 1995. Resistance to diseases and insects in transgenic plants: progress and applications to agriculture. Trends Bioiechnol. 13: 362-368. Töpfer R., N. Martini, J. ScheU. 1995. Modification of plant lipid synthesis. Science 268:681—686. Tricoli D. M., K. J. Carney, P. F. Russell, J. R. MeMaster, D. W. Groff, K. C. Hadden, P. T. Himmel, J. P. Hubbard, M. L. Boeshore, H. D. Quemada. 1995. Field evaluation of transgenic squash containing single or multiple virus coat protein gene constructs for resistance to cocumbcr mosaic virus, watermelon mosaic virus 2, and zucchini yellow mosaic virus. Bio/Technology 13: 1458-1465. Vaeck M., A. Reynaerts, H. HOfte, S. Jansens, M. de Beuckeleer, C. Dean, M. Zabeau, M. Van Montagu, J. Leemans, 1987. Transgenic plants protected from insect attack. Nature 328: 33-37. Van Camp W., H. WDtekens, C. Bmrter, M. Van Montagu, D. Inzé, P. Reupold-Popp, H. Sandermann, Jr., C. Langebartels. 1994. Elevated levels of Superoxide dismutase protect transgenic plants against ozone damage, Bio/Technology 12: 165-168. Van Rie J. 1991. Insect control with transgenic plants: resistance proof? Trends Bioiechnol. 9: 177-179. Vierheilig H., M. Alt, J.-M. Neuhaus, T. Boiler, A. Wiemken. 1993. Colonization of transgenic Nicotiana syivestris plants, expressing different forms of Nicotiana tabacum chitinase, by the root pathogen Khizoctonia solant and by the myeor-rhizal symbiont Glomus mosseae. Mol. Plant-Microbe Interact. 6: 261-264. Williams S., L. Friedrich, S. Dincher, N. Carozzi, H. Kessmann, E. Ward, J. Ryals. 1992. Chemical regulation of Bacillus thuringiensis 6-endotoxin expression in transgenic plants. Bio/Technology 10: 540-543. Zhu Q., E. A. Mäher, S. Masoud, R. A. Dixon, С J. Lamb. 1994. Enhanced protection against fungal attack by constitutive co-expression of chitinase and glucanase genes in transgenic tobacco. Bio/Technology12: 807-812. КОНТРОЛЬНЫЕ ВОПРОСЫ1. Предположим, что растения инфицированы вирусом без оболочки с одноцепочечным РНК-геномом (8000 нуклеотидов). Вирус и его РНК. можно легко выделить. Кроме того, Генная инженерия растений: применение 417 у вас есть антитела ко всем четырем вирусным белкам. Какую стратегию вы выбрали бы для защиты растений от вирусной инфекции? 2. Предложите несколько стратегий создания растений, устойчивых к насекомым-вредителям. 3. Как с помощью антисмысловой РНК можно обеспечить устойчивость растений к специфическим вирусам? 4. Каким образом ингибиторы протеиназ, ингибитор амилазы и холестеролоксидаза защищают растения от насекомых-вредителей? 5. Предложите стратегию защиты растений от повреждения несколькими разными вирусами. 6. Опишите основные способы создания растений, устойчивых к гербицидам. 7. Как следует изменить растение, чтобы обеспечить его защиту от патогенных почвеных грибов? 8. Как с помощью генной инженерии получить растения, устойчивые к патогенным бактериям? 9. Какой подход вы применили бы для создания растения, толерантного к высоким концентрациям солей? 10. Предположим, что вам нужно замедлить созревание плодов авокадо при их транспортировке. Какой способ вы выберете? 11. Как с помощью методов генной инженерии получить растения с необычной окраской цветков? 12. Как с помощью генной инженерии повысить содержание лизина в сое? 13. Что такое косупрессия? Антисмысловая супрессия? Сравните их. 14. Как упростить процедуру очистки растворимых белков, например фрагментов антител, синтезируемых растениями? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||