Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
ГЛАВА 18. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 18. L Экспрессия некоторых генов, кодирующих инсектициды ßacillus thuringiensis в трансгенных растениях 1) 2) | |||
| Растение | Ген | Экспрессия % | Устойчивость к насекомым |
| Табак | | | Нет |
| Табак | | | Да |
| Табак | | | Нет |
| Табак | | | Да |
| Табак | | | Да |
| Томат | | | Да |
| Хлопок | | | Нет |
| Хлопок | | | Да |
| Томат, табак | | | Да |
| Томат, табак | | | Да |
| Томат, табак | | | Да |
| 1) По данным работы Ely, p. 105- 124, in Entwistle et al. (ed)., Bacillus thuri ngteniii, an Environmental Biopesticide: Theory and Practice, 1493. | |||
| 2) Обозначения: полн. — полноразмерный ген протоксина; укороч. — укороченная версия гена протоксина; WT — кодоны дикого типа; РМ — частично измененные кодоны; FM — полностью измененные кодоны. | |||
теля. Гены cryIA(a), cryIA(b) и сryIА(с), ответственные за синтез инсектицидных белков В. thuringiensisssp, kurstaki, практически не экспрессируются в растениях (табл. 18.1), а для выведения представляющих коммерческий интерес жизнеспособных растений, устойчивых к насекомым-вредителям, необходимо, чтобы эти белки синтезировались в большом количестве. Пытаясь решить эту проблему, уменьшили размер встроенного гена так, чтобы синтезировалась только N-концевая часть молекулы токсина, и снабдили его сильным растительным промотором, чтобы повысить уровень экспрессии. Количество синтезируемого токсина при этом значительно увеличилось, и трансгенные растения получили некоторую защиту от насекомых-вредителей.
Далее была поставлена задача найти минимальную длину нуклеотидиной последовательности, обеспечивающей активность токсина. Чтобы определить, есть ли у разных токсинов одинаковый домен, сравнили аминокислотные последовательности протоксинов, продуцируемых различными штаммами B. thuringîensis. Оказалось, что N-концевой участок молекул протоксинов разных штаммов В. thuringiensis ssp. kurstaki высококонсервативен (гомология 98%), а С-концевой более вариабелен (гомология 45%). Дальнейшие исследования показали, что вся инсектицидная активность токсина обеспечивается первыми 646 N-концевыми аминокис-
лотными остатками молекулы протоксина, общая длина которой составляет 1156 аминокислот. Участок гена протоксина, кодирующий высококонсервативную аминокислотную последователь, клонировали, экспрессировали в бактериях и обнаружили, что в отношении защиты растений от насекомых отряда чешуекрылых в лабораторных условиях укороченный белок столь же эффективен, как и его нативная форма.
Для всестороннего изучения способности укороченного гена протоксина обеспечивать защиту растений от различных насекомых-вредителей были выведены трансгенные растения томата. Укороченный ген, снабженный сильным конститутивным 35S-промотором вируса мозаики цветной капусты и сайтом терминации транскрипции/полиаденилирования гена нопа-линсинтазы, клонировали в Т-ДНК коинтегративного Ti-плазмидного вектора (рис. 18.1). Вектор содержал также: 1) ген устойчивости к спектиномицину (Spcr), позволяющий проводить отбор либо в Е. coli, либо в A. tumefaciens; 2) сайт инициации репликации Е. соli; 3) ген неомицинфосфотрансферазы под контролем промотора и сайта терминации транскрипции/полиаденилирования гена нопалинсинтазы, позволяющий проводить отбор трансформированных растительных клеток в присутствии канамицина. Кроме того, коинтегративный вектор содержал правую фланкирующую последовательность Т-ДНК нопалиновой Ti-плазмиды и
Генная инженерия растений: применение 391
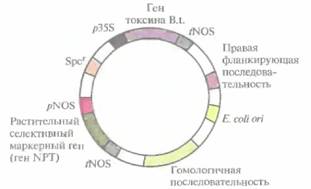 | Рис. 18.1. Коинтегративный клонирующий вектор, несущий ген инсектицидного токсина В. thuringiensis(B.t.). Ген находится под контролем сильного конститутивного 35S-промотора (p35S) вируса мозаики цветной капусты и сайта терминации транскрипции/полиаденилирования гена нопалинсинтазы (tNOS). Вектор содержит также: сайт инициации репликации Е. coli (ori) и ген устойчивости к спектиномицину (Spcr), что обеспечивает его амплификацию в E. coli и позволяет проводить отбор соответствующих клеток; правую фланкирующую последовательность Т-ДНК; растительный селективный маркерный ген; последовательность, гомологичную неонкогенной Τi-плазмиде и обеспечивающую интеграцию двух плазмид. Ген неомицинфосфотрансферазы (NPT) находится под контролем элементов регуляции транскрипции гена нопалинсинтазы (pNOS и tNOS) и используется для отбора канамицинустойчивых трансформированных растительных клеток. |
сегмент октопиновой Ti-плазмиды, обеспечивающий образование коинтеграта с «разоруженной» Ti-плазмидой с помощью гомологичной рекомбинации. Сконструированной плазмидой трансформировали Е. соli, а затем с помощью конъюгации перенесли ее в штамм A. tumefaciens, содержащий «разоруженную» Ti-плазмиду. После рекомбинации в A. tumefaciens укороченный ген протоксина включался в хромосомную ДНК томата.
И в оранжерее, и при полевых испытаниях трансгенные растения томата, которые синтезировали укороченную форму протоксина, проявляли некоторую защищенность от таких насекомых, как бражник (Manducasexta), совка, повреждающая плоды томата (Heliothis zea), выемчатокрылая моль (Keiferialycopersicella) (табл. 18,2), Эффект был неодинаков для разных насекомых и не абсолютен: наиболее выражен он был в первых двух случаях. Иногда хороший результат давала обработка растений, синтезирующих про-токсин, химическим инсектицидом в низких дозах. Однако для того чтобы определить, как еще больше уменьшить ущерб, причиняемый указанными выше и другими насекомыми-вредителями, необходимы дальнейшие исследования,
Для кардинального повышения уровня экспрессии использовались два других подхода (табл. 18.1). В первом случае методом сайт-специфического мутагенеза изменяли те участки выделенного гена токсина, которые могли бы быть ответственны за снижение эффективности транскрипции или трансляции в растении-хозяине (в этих экспериментах использовали и табак, и томаты). При этом нуклеотидная последовательность измененного гена на 96,5% совпадала с таковой у гена дикого типа. Трансгенные растения, в которых экспрессировался такой "слабо» модифицированный ген, синтезировали в 10 раз больше токсина, чем растения, трансформированные геном дикого типа.
Во втором случае была разработана и синтезирована химическими методами «полностью»
| Таблица 18.2. Чувствительность трансгенных растений томата и растений дикого типа к насекомым-вредителям '' | ||||
| Насекомое | Доля поврежденных растений или плодов, % | |||
| растения дикого типа | трансгенные растения | |||
| без инсектицида | с инсектицидом | без инсектицида | с инсектицидом | |
| Бражник | 47,5 | 3,75 | 1,25 | 0,00 |
| Совка | 20,1 | Не определяется | 6.4 | Не определяется |
| Выемчатокрылая моль | 99.7 | 95,1 | 94.2 | 80,4 |
| 1) По данным работы Delannay et al., Bio/Technology 7: 1265-1269, 1989. | ||||
392 ГЛАВА 18
измененная форма гена токсина. Такой ген содержал кодоны, чаще используемые растениями по сравнению с теми, которые «предпочитают» грамположительные бактерии. Были внесены также изменения, предотвращающие образование вторичной структуры у мРНК или исключающие появление сайтов полиаденилирования, характерных для растений, что могло бы снизить уровень экспрессии. GС-содержание «полностью» измененного гена было равно 49% (для гена дикого типа эта величина составляла 37%), а нуклеотидная последовательность была только на 78,9% гомологична таковой гена дикого типа.
Трансгенные растения, трансформированные сильно измененным геном протоксина, синтезировали в 100 раз больше токсина, чем растения, трансформированные геном дикого типа, при этом наблюдалась прямая корреляция с увеличением инсектицидной активности. Полученные данные позволяют надеяться, что аналогичным образом удастся повысить уровень экспрессии в растениях множества других чужеродных генов.
Количество синтезируемого в растениях протоксина попытались увеличить, осуществив экспрессию «полностью» измененного гена протоксина под контролем промотора гена малой субъединицы рибулозобисфосфат-карбоксилазы, помещенного после хлоропластной сигнальной последовательности этого фермента, таким образом, чтобы сверхпродуцируемый протоксин был локализован в хлоропластах. Эта стратегия привела к радикальному повышению уровня экспрессии гена протоксина, так что на долю протоксина стало приходиться до 1 % всех белков листа. В другом эксперименте ген протоксина вводили непосредственно в хлоропластную ДНК растения-хозяина. Это дает следующие преимущества. Во-первых, вводимый ген не нужно модифицировать, поскольку транскрипционный и трансляционный аппараты хлоропластов относятся к прокариотическому типу. Во-вторых, на одну клетку приходится много хлоропластов, а на один хлоропласт — много копий хлоропластной ДНК, поэтому ген протоксина присутствует в большом числе копий, и эффективность его экспрессии повышается. В-третьих, хлоропласты передаются только через яйцеклетку, а не через пыльцу, так что растения наследуют хлоропластную ДНК по материнской линии и нет никакого риска нежелательного переноса гена лротоксина с пыльцой на другие растения.
Одна из форм гена протоксина уже введена и экспрессируется в таких растениях, как томаты, табак, картофель, рис, кукуруза, яблоня, баклажан, канола, люцерна, орех, тополь, ель, клюква и хлопок. Перспективы применения этого метода защиты растений кажутся весьма обнадеживающими. Так, в трансгенных растениях картофеля осуществлена эффективная экспрессия синтетического гена на основе гена инсектицидного токсина В. thuringiensis ssp. tenebrionis с кодовым словарем, используемым растениями. Полученные растения оказались высокоустойчивыми к колорадскому жуку, основному вредителю картофеля. Уже проведены успешные полевые испытания культуры в течение нескольких лет и получено разрешение на коммерческое ее использование в США. Следует помнить, однако, о необходимости постоянного контроля популяции насекомых-вредителей, с тем чтобы вовремя обнаружить устойчивые организмы. Возможно, в будущем для защиты трансгенного картофеля придется использовать более мощный протоксин В. thuringiensis или, что более вероятно, идентифицировать и клонировать в растениях другие инсектицидные гены в дополнение к генам протоксинов В. thuringiensis.
В настоящее время разрабатываются способы сниженияь селективного давления со стороны трансгенных растений, экспрессирующих ген протоксина В. thuringiensis, на устойчивых насекомых-вредителей. В одном случае экспрессию гена В. thuringiensis в трансгенном растении ограничивали по времени. Для этого его помешали под контроль промотора гена табака PR-la (от англ, pathogenesis-related), экспрессия которого представляет собой часть естественного механизма защиты табака от болезнетворных организмов. Ген PR-la индуцируется любым патогенным организмом или химическим агентом типа салициловой или полиакриловой кислоты. Обработав трансгенные растения, несущие ген протоксина В. thuringiensis под контролем PR-la-промотора, химическим индуктором, обнаружили, что они синтезируют инсектицид в
Генная инженерия растений: применение 393
заметном количестве в течение 1 сут после обработки, и этого достаточно для последующей защиты растений от насекомых-вредителей. Таким образом, можно индуцировать синтез протоксина, обработав трансгенное растение недорогим и безопасным химическим веществом в определенный момент вегетационного периода. Такая периодичность синтеза протоксина приводит к снижению селективного давления на устойчивых насекомых. Аналогичные системы могут оказаться полезными для регуляции синтеза самых разных чужеродных белков в трансгенных растениях.
Ни один из конкретных типов протоксина В. thuringiensisне может быть эффективным в отношении всех видов насекомых, В ходе эволюции растения выработали общие механизмы защиты от насекомых, обеспечивающие их выживание, однако степень этой защиты не всегда достаточна. Некоторые растения синтезируют ингибиторы протеиназ, которые, попадая в кишечник насекомого, блокируют гидролиз растительных белков. Разумно было предположить, что если выделить растительный ген ингибитора протеиназ и снабдить его сильным промотором, то можно будет создать трансгенные сельскохозяйственные культуры, способные синтезировать ингибитор протеиназ в количестве, достаточном для защиты от насекомых-вредителей. В одном из таких экспериментов с помощью химически синтезированного ДНК-зонда из банка клонов комплементарной ДНК (кДНК) был выделен клон, кодирующий ингибитор трипсина вигны китайской. (При синтезе ДНК-зонда руководствовались аминокислотной последовательностью этого белка.) Полноразмерную кДНК субклонировали в бинарном векторе на основе Ti-плазмиды (рис. 18.2) и ввели в штамм A. tumefaciens, содержащий неонкогенную Ti-плазмиду с активными vir-генами. После инфицирования листовых дисков табака A. tumefaciensэтим вектором клетки, содержащие комплементарную ДНК, отбирали по способности к росту в присутствии канамицина и регенерировали из них трансгенные растения. Ущерб, наносимый личинками Heliothisvirescens(совки) трансгенным растениям, синтезирующим более 2 мкг ингибитора трипсина на 1 мг растительного белка, был значительно меньше, чем в случае обычных растений.
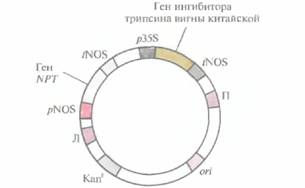 |
| Рис. 18.2. Бинарный клонирующий вектор, несуший ген ингибитора трипсина вигны китайской. Вектор содержит сайт инициации репликации ДНК для широкого круга хозяев (ori) и ген устойчивости к канамицину (Kanr), который функционирует как в Е. coli, так и в A. tumefaciens. Между правой (П) и левой (Л) фланкирующими последовательностями Т-ДНК находятся: 1) ген неомицинфосфогрансферазы (NPT) под контролем элементов регуляции транскрипции гена нопалинсинтазы (pNOS и tNOS), что позволяет проводить отбор канамицинустойчивых трансформированных растительных клеток; 2) ген ингибитора трипсина вигны китайской, находящийся под контролем 35S-промотора (p35S) вируса мозаики цветной капусты и сигнала терминации транскрипции/полиаденилирования гена нопалинсинтазы (tNOS). |
Семена вигны китайской, содержащие указанное выше количество ингибитора, нетоксичны для животных и человека. Впрочем, если бы такая опасность и существовала, можно было бы ограничить экспрессию гена ингибитора теми тканями растения, которыми предпочитают питаться основные насекомые-вредители, но которые не используют в пищу человек и животные. Так, клонированный ген ингибитора протеиназ мог бы «работать» в листьях и корнях растения, но не в его плодах.
Введение гена ингибитора 11 протеиназы картофеля в растения риса защищает их от розового стеблевого точильщика (Sesamia inferens), основного насекомого-вредителя для этой культуры; заражение приводит к образованию полых стеблей и мертвых метелок без семян. Была сконструирована плазмида, содержащая ген ингибитора II протеиназы картофеля под контролем его собственного промотора и сигнала терминации транскрипции. Между промотором и кодирующей областью гена ингибитора был
394 ГЛАВА 18
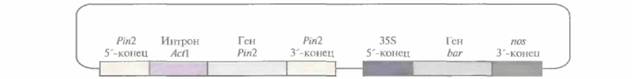 |
| Рис. 18.3. Плазмидный вектор, несущий ген ингибитора II протеиназы картофеля. Обозначения: Pin2— ген ингибитора II протеиназы картофеля; 5'-конец - сегмент ДНК, предшествующий данному гену; 3'-конец - сегмент ДНК, следующий за геном; интрон Act1 — первый интрон гена актина 1 риса; 35S 5'-конец — 35S-промотор вируса мозаики цветной капусты; bar- бактериальный ген фосфинотрицин-ацетилтрансферазы; nos 3'-конец - сегмент ДНК, следующий за геном нопалинсинтазы. Ген barслужит селективным маркером для трансгенных растений, обусловливая устойчивость к гербициду Basta (глюфозинату аммония). |
встроен первый интрон гена актина риса. Эту конструкцию ввели в суспендированные клетки риса методом бомбардировки микрочастицами (рис, 18,3) и регенерировали из них трансгенные растения. Когда личинок розового стеблевого точильщика наносили на полученные таким образом растения, только от 15 до 20% последних оказывались поврежденными, в то время как для растений дикого типа эта величина составляла 70—100%. Поскольку растительные ингибиторы протеиназ являются обычными компонентами рациона человека и животных и в процессе приготовления пищи быстро инактивируются, их введение в новые зерновые культуры можно считать безопасным.
Другой подход к увеличению эффективности защиты растений с помощью токсина В. thuringiensisоснован на параллельном использовании этого токсина и ингибитора сериновой протеиназы. Показано, что смесь очищенного токсина В, thuringiensisвколичестве, обеспечивающем минимальную смертность насекомых, и ингибитора протеиназ в низких концентрациях обладает в 20 раз большей инсектицидной активностью, чем один протоксин В. thuкingiensis. Чтобы проверить, будет ли эта система функционировать в трансгенных растениях, был сконструирован фрагмент ДНК, кодирующий гибридный белок «ингибитор протеиназ/укороченный токсин». Трансгенные растения табака, которые синтезировали небольшие количества такого рекомбинантного белка, были в значительной мере защищены от насекомых-вредителей.
Еще один способ защиты растений предполагает введение в них гена, кодирующего ингибитор α-амилазы. Большой ущерб зерновым приносят такие насекомые, как зерновка (Callosobruchusmaculatus) и долгоносик лучистой фасоли (С. chinensis), шггающиеся семенами. Если в рацион личинок этих насекомых включить обычную фасоль (Phaseolusvulgaris), то рост насекомых замедляется. Это связано с присутствием в семенах обычной фасоли ингибитора α-амилазы. Ген ингибитора α-амилазы, выделенный из обычной фасоли, был помещен под транскрипционный контроль сильного семяспецифичного промотора гена фитогемагглютинина бобов и использован для трансформации гороха (Pisumsativum), обычно весьма чувствительного к упомянутым выше насекомым. Трансгенные растения гороха, которые синтезировали ингибитор α-амилазы, были устойчивы к обоим насекомым, при этом в случае зерновки эффект оказался пропорциональным количеству ингибитора, синтезированному растением (рис. 18.4).
Альтернативный подход к выведению трансгенных растений, устойчивых к насекомым, основан на использовании бактериального гена холестеролоксидазы. Этот фермент, синтезируемый различными бактериями, катализирует окисление 3-гидроксистероидов с образованием кетостероидов и пероксида водорода. Его часто используют при определении уровня холестерола в сыворотке крови у человека, а в небольших количествах он проявляет высокую инсектицидную активность против личинок хлопкового долгоносика (Anthonomus grandis grandis) (рис. 18.5). Это широко распространенное насекомое отряда жесткокрылых наносит ощутимый ущерб хлопковым плантациям. В отношении насекомых-вредителей отряда чешуекрылых холестеролоксидаза менее эффективна. Действие фермента, по-видимому, заключается в разрушении мембраны эпителиальных клеток средней кишки насекомого, что приводит к его гибели. Ген
Генная инженерия растений: применение 395
| Рис. 18.4. Зависимость смертности личинок зерновки, развивающихся на трансгенных растениях гороха, от количества ингибитора α-амилазы, синтезируемого растениями. | 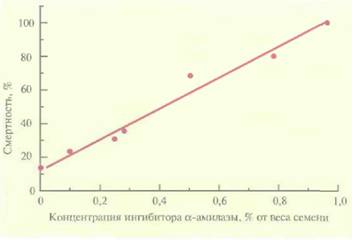 |
| Рис. 18.5. Зависимость смертности личинок хлопкового долгоносика от концентрации холестеролоксилазы. (Corbin et al., Appl. Environ. Microbiol. 60: 4239-4244, 1994.) | 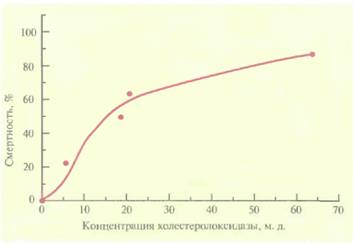 |
холестеролоксидазы, кодирующий белок мол. массой 55 000 Да (504 аминокислотных остатка) и лидерный пептид мол. массой 5000 Да (43 аминокислотных остатка), был выделен из штамма Streptomyces и встроен в вектор вместе с промотором вируса мозаики норичника шишковатого и сигналом терминации из 3'-области гена нопалинсинтазы A. tumefaciens. Когда такую конструкцию ввели в протопласты клеток табака, трансформированные клетки стали активно экспрессировать холестеролоксидазу. В будущем, вероятно, этот ген будет введен в растения хлопка, и тогда — либо самостоятельно, либо в комбинации с генами других биологических инсектицидов -он станет эффективным инструментом защиты растений от насекомых-вредителей.
