Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
ГЛАВА 17. |
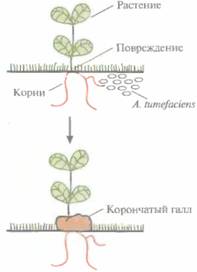 | 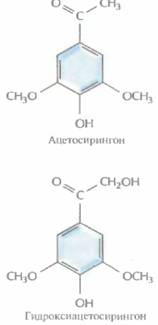 |
| Рис. 17.1. Инфицирование растений A. tumefaciensи образование корончатого галла. | Рис. 17.2. Структурные формулы ацетосирингона и гидроксиацетосирингона. Эти соединения выделяются растением в ответ на повреждение и активируют vir-гены Ti-плазмиды. |
называемой Т-ДНК (от англ, transferredDNA). Т-ДНК — это часть плазмиды, индуцирующей развитие опухоли (tumor-inducing plasmid, Ti-плазмиды); ее несут большинство штаммов A. tumefaciens.
Длина Т-ДНК варьирует от 12 до 24 т. п. н. в зависимости от штамма. Штаммы A. tumefaciens, не содержащие Ti-плазмиды, не способны индуцировать развитие корончатого галла.
Инфекционный процесс начинается с прикрепления A. tumefaciensк клеткам растения в месте повреждения, часто у основания стебля (у корневой шейки). Ранее предполагалось, что A. tumefaciensзаражает именно поврежденные растения вследствие разрушения клеточной стенки и устранения физического барьера, затрудняющего проникновение бактерий в клетку. Однако сейчас считается, что все дело в специфических фенольных соединениях, ацетосирингоне и гидроксиацетосирингоне (рис. 17.2), которые выделяет поврежденное растение. Эти соединения сходны с некоторыми продуктами основного пути синтеза у растений вторичных метаболитов, таких как лигнииы и флавоноиды. Ацетосирингон и гидроксиацетосирингон активируют гены вирулентности (νir), которые локализованы в участке Ti-плазмиды длиной 35 т. п. н., находящемся за пределами Т-ДНК. Продукты vir-генов необходимы для транспорта и интеграции Т-ДНК (рис. 17,3) в геном растительной клетки. Существуют по меньшей мере семь разных νir-генов.
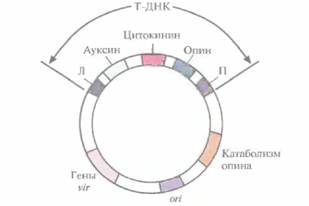 |
| Рис. 17.3. Генетическая карта Ti-плазмиды (масштаб не соблюден). Т-ДНК содержит гены ауксина, цитокинина и опина. которые транскрибируются и транслируются только в растительных клетках. За пределами Т-ДНК находится кластер vir-генов, ген(ы), кодирующий(е) фермент(ы) катаболизма опина, и сайт инициации репликации (ori), который обеспечивает стабильное поддержание плазмиды в A. tumefaciens, Л и Π — левая и правая фланкирующие последовательности соответственно. |
Генная инженерия растений: методология 375
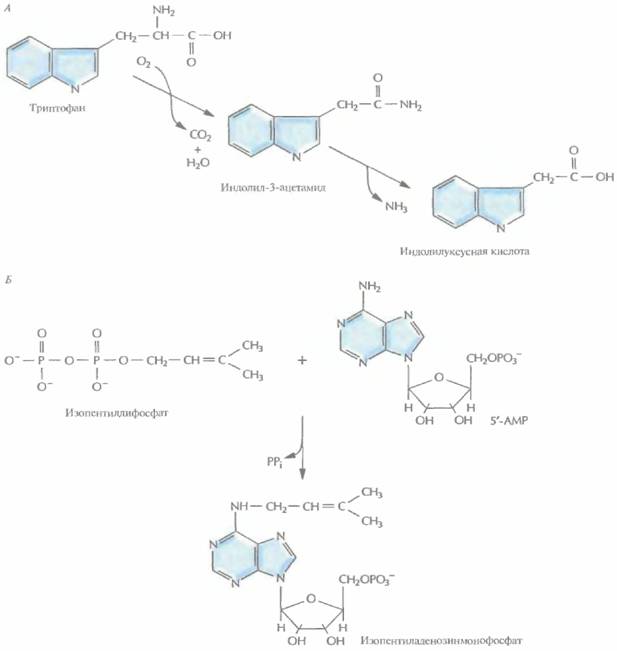 |
| Рис. 17.4. Биосинтез ауксина и цитокинина при участии ферментов, кодируемых генами Т-ДНК Ti-плазмиды A. tumefaciens, А. Синтез ауксина начинается спревращения триптофана в индолил-3-ацетамид, катализируемого триптофан монооксигеназой. Затем происходит превращение индолил-3-ацетамида в индолилуксусную кислоту ферментом индолил-3-ацетамидгидролазой. Б. Синтез цитокинина включает присоединение изопентенильной группы изопентенилдифосфата к 5'-АМР при участии фермента изопентенилтрансферазы с образованием изопентениладенозинмонофосфата. |
376 ГЛАВА 17
После присоединения A. tumefaciens, несущей Ti-плазмиду, к растительной клетке и активации νir-генов Т-ДНК транспортируется в клетку, по-видимому, с помощью механизма, аналогичного механизму переноса плазмидной ДНК из донорной клетки в реципиентную в процессе конъюгации. При этом Т-ДНК находится в одноцепочечной форме, и именно в такой форме она встраивается в хромосомную ДНК растения.
Переход Т-ДНК в одноцепочечную форму начинается с внесения в нее разрывов по обеим фланкирующим ее последовательностям. При этом правая фланкирующая последовательность оказывается на 5'-конце одноиепочечной Т-ДНК, а левая — на 3'-конце. Предполагается, что интеграция Т-ДНК в геном растения зависит от специфических последовательностей, локализованных в правой фланкирующей последовательности, которая содержит повтор длиной 25 п. н. Аналогичный повтор присутствует и в левой последовательности, однако, как показывает делеционный мутагенез, она не принимает участия в интеграции.
Большинство генов Т-ДНК активируются только после ее встраивания в геном растения. Их продукты и вызывают образование корончатого галла. Гены iaaM иiaaH, известные также как tms1 и tms2 соответственно, кодируют ферменты, принимающие участие в синтезе растительного гормона ауксина (индолилуксусной кислоты). Ген iααΜкодирует фермент триптофан-2-монооксигеназу, которая катализирует превращение триптофана в индолил-3-ацетамид, а ген iaaH — фермент индолил-3-ацетамидгидролазу, катализирующую образование индолилуксусной кислоты из индолил3-ацетамида (рис. 17.4, А). Кроме того, Т-ДНК несет ген tmr (известный также как ген itp), кодирующий изопентилтрансферазу — фермент, который катализирует присоединение к 5'-АМР изопреноидной боковой цепи с образованием цитокининов изопентениладенина и изопентениладенозинмонофосфата (рис. 17.4, Б), При гидроксилировании этих соединений растительными ферментами образуются цитокинины трансзеатин и трансрибозилзеатин соответственно. И ауксин, и цитокинины регулируют рост и развитие растительной клетки, но, присутствуя в избытке, могут вызывать у растений образование опухолей, таких как корончатый галл.
Кроме генов ауксина и цитокинина, Т-ДНК каждой специфической Ti-плазмиды содержит ген, детерминирующий синтез соединения из класса опинов. Опины — это уникальные продукты конденсации амино- и кетокислот или аминокислот и сахаров. Например, при конденсации аргинина и пировиноградной кислоты образуется октопин, аргинина и α-кетоглутаральдегида — нопалин, а бициклического производного глутаминовой кислоты и сахара — агропин (рис. 17.5). Опины синтезируются в корончатом галле, а затем секретируются. Они могут использоваться как источник углерода (а иногда и как источник азота) любой A. tumefaciens, которая несет в Ti-плазмиде ген(ы) катаболизма соответствующего опина (рис. 17.3), локализованные вне Т-ДНК. Большинство других исследованных почвенных микроорганиз-
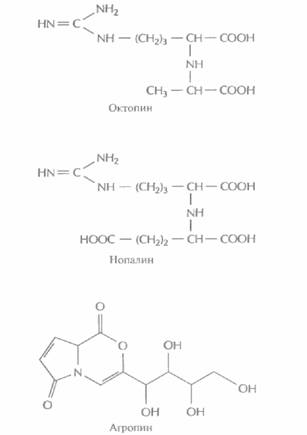 |
| Рис. 17.5. Структурные формулы трех опинов: октопина, нопалина и агропина. |
Генная инженерия растений; методология 377
мов не способны использовать опины как источник углерода. Таким образом, в процессе эволюции выработался уникальный набор механизмов, посредством которых каждый штамм A. tumefaciens генетически трансформирует растительные клетки в «биологические фабрики» по производству соединений углерода, использовать которые могут только сами эти бактерии.
