Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
|
при его плазмидной локализации вследствие нестабильности плазмиды. В отличие от большинства других токсиновых генов (cry) В. thuringiensis, экспрессия гена cryIIIA в норме контролируется «негативным» промотором, а не промотором, специфичным для споруляции. Ген cryIIIA кодирует токсин, эффективный в отношении личинок жесткокрылых. В результате трансформации мутантного штамма В. thuringiensis, не способного образовывать споры, плазмидой, несущей клонированный ген crуIIIА, токсин синтезировался более эффективно и был более стабильным, чем при его синтезе в штамме дикого типа. Получив этот результат, ученые предположили, что суперэкспрессии других cry-генов, обычно экспрессирующихся только во время споруляции, можно достичь, если поместить их под контроль промотора cryIIIA и трансформировать получившейся конструкцией мутантный штамм В. thuringiensis) не способный к споруляции. Урожаю многих сельскохозяйственных культур наносят ущерб сразу несколько видов насекомых, поэтому чрезвычайно полезным было бы создание микробиологических инсектицидов, направленных против широкого спектра насекомых-вредителей. Токсин широкого спектра действия можно получить двумя путями: 1) переносом гена данного токсина (например, токсина, эффективного в отношении двукрылых) в штамм В. (thuringiensis, синтезирующий другой видоспецифичный токсин (например, эффективный в отношении жесткокрылых); 2) соединением частей двух генов разных видоспецифичных токсинов с образованием последовательности, кодирующей уникальный токсин двойного действия (гибридный токсин). Чтобы проверить возможность получения токсина с широким спектром действия, встроили гены токсинов В. thuringiensis subsp. aizawai и tenebrionisв челночные векторы, способные реп- 338 ГЛАВА 15
лицироваться и в A. thuringiensis, и в Esclierichiacoli. Затем такие генетические конструкции ввели с помощью электропорации в В. thuringiensis subsp. aizawai, kurstaki, israelensis и tenebrionis. Токсичность полученных трансформированных штаммов проверяли на личинках трех отрядов насекомых. Во всех случаях токсичность, обусловливаемая собственным хозяйским токсиновым геном (генами), сохранялась, а в большинстве случаев введенный ген обусловливал специфичность токсического действия, характерную для штамма, откуда он был выделен (табл. 15.2). Кроме того, один из экспериментов дал совсем уж удивительный результат: при введении гена токсина В. thuringiensissubsp. tenebrionisв В. thuringiensissubsp. israelensisполучились трансформанты, в какой-то степени токсичные для Pierisbrassicae(капустницы белой), на которую не действовал ни один из продуктов исходных генов. Плазмидные векторы, несущие клонированные cry-гены, часто оказываются нестабильными в В. thuringiensis: даже в отсутствие селективного давления все они или их часть утрачиваются. Интересно, что при этом в природе большинство cry-reнов локализуются именно в плазмидах. Нестабильность плазмид еще раз убеждает в целесообразности интеграции клонированного сrу-гена(генов) с хромосомной ДНК. Рассмотрим один успешный пример такой интеграции.
Микробные инсектициды 339 Штамм В. thuringiensissubsp. kurstaki обычно содержит пять разных генов токсинов: cryIA (a), cryIA (b), cryIA (с), cryIIΑи cryIIB. Их продукты токсичны для различных чешуекрылых, но не эффективны против Spodopteraspp. В хромосомную ДНК штамма В. thuringiensissubsp. kurstakiвстроили ген cryIC, обычно присутствующий только у В. thuringiensissubsp. aizawaiи subsp. entomocidus. Трансформированный штамм В. thuringiensissubsp. kurstakiбыл в шесть раз более эффективен в отношении личинок Spodopteraexigua, чем штамм дикого типа. Как мы уже говорили, другой способ получения токсина широкого спектра действия состоит в слиянии кодирующих участков генов двух разных токсинов. Эта возможность была проверена в лаборатории. Было создано несколько гибридных токсинов, действующих только на чешуекрылых; некоторые из этих токсинов были более эффективны, чем продукты каждого из исходных генов, а в одном случае гибридный белок обладал абсолютно новой биологической активностью. За токсическое действие белка Cry ответственны три домена. Домен I, локализованный в N-концевой области белковой молекулы, обеспечивает специфическое связывание токсина с рецептором на поверхности эпителиальных клеток кишечника насекомого. Домен III, расположенный в С-концевой области молекулы, предположительно и отвечает за токсичность. Устойчивость к токсинам В. thuringiensisобычно обусловливается мутационным изменением (изменениями) рецепторного белка (белков) на поверхности клеток кишечника насекомого, приводящим к тому, что рецептор перестает узнавать Cry-белок. Однако, если модифицировать ген токсина так, чтобы токсин мог связываться с другими поверхностными белками, то вероятность возникновения устойчивости уменьшится. Белки CrylC и CrylE токсичны для чешуекрылых, но обладают разной видоспецифичностью: CrylC действует на S. exigua, Mamestrabrassicaeи Manducosexta, в то время как CrylE — только на M. sexto. В одной из лабораторий был создан гибридный белок CrylC-CrylE, токсичность которого проверялась на разных насекомых. Была исследована также его способность связываться с различными рецепторами (рис. 15.5). Гибридный токсин G27, содержащий домен III белка CrylC, был токсичен для личинок S. exigua, хотя связывался только с Сгу1Е-рецептором, но не с рецептором CrylC, И наоборот, гибридный токсин F26 не оказывал действия на личинок S. exigua, хотя и связывался с CrylC-рецептором. Поскольку токсичные для S. exiguaбелки CrylC и G 27 связываются с разными рецепторами на поверхности клеток кишечника насекомого, одновременная или поочередная обработка S. exigua двумя этими токсинами может уменьшить вероятность появления устойчивого к ним штамма, поскольку для этого необходимо, чтобы мутационные изменения произошли одновременно в двух разных белках.
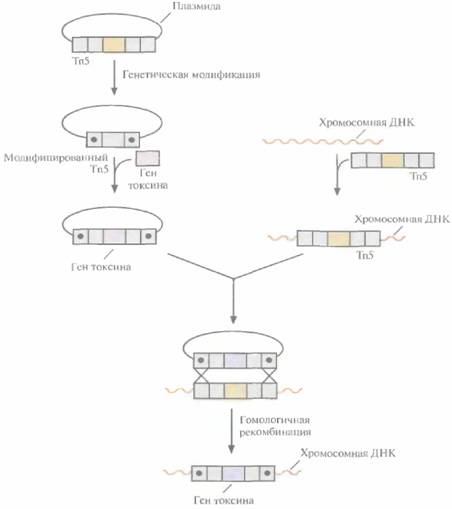
340 ГЛАВА 15 Инсектицид, продуцируемый B. thuringiensis subsp. israelensis, проявляет свои токсические свойства, когда он попадает в кишечник личинок комара. Если же этот токсин, находящийся в виде параспоральных кристаллов, распылить над водой, то кристаллы быстро утонут, и токсин будет исключен из пищевой цепи личинок комара. Чтобы решить эту проблему, можно ввести ген токсина в организм, который служит пищей для личинок комаров. Это могут быть, например, фотосинтезирующие цианобактерии Synechocystisи Synechococcusspp., которые размножаются в поверхностном слое воды, где достаточно солнечного света и где обычно обитают личинки. Еще один организм, который можно использовать для экспрессии генов токсинов В. thuringiensis, — бактерия Caulobactercrescentus, широко распространенная в водной среде, где живут личинки комаров. Инсектицид, синтезированный трансформированными цианобактериями или С. crescentus, в лабораторных условиях был токсичен для личинок комара. Однако в полевых условиях трансформированные цианобактерии и С. crescentus быстро погибали, а уровень экспрессии клонированных генов был очень низок. В качестве организма-хозяина для чужеродных cry-генов, кодирующих токсичные для комаров белки, можно использовать также грамотрицательную аэробную бактерию Asticcacaulis excentricus, обитающую у поверхности водоемов, Были проведены эксперименты, в которых A. excentricus трансформировали плазмидным вектором с широким кругом хозяев, который нес гены белковых токсинов Bacillussphaericus(бактерии, аналогичной В. thuringiensis). Гены находились под контролем промотора tac1, одного из вариантов tac-промотора. Полученный трансформант синтезировал белковые токсины мол, массой 51 и 42 кДа и был практически столь же токсичен для личинок комаров Anophelesи Culex, как природные высокотоксичные штаммы В. sphaericus. Однако в отличие от Я sphaericusв случае с A. excentricusне возникало проблем, связанных с распылением над водоемами. Кроме того, культивирование A. excentricusобходится гораздо дешевле, поскольку этот микроорганизм растет на более простой среде, чем В. sphaericus и В. thuringiensis. Для него характерна низкая протеиназная активность, так что токсин не подвергается немедленной деградации, A. excentricusхорошо адаптирована к таким условиям, как относительно высокая интенсивность УФ-света, Однако, прежде чем применять рекомбинантные бактерии A. excentricusдля контроля популяций комаров в природных условиях, необходимо убедиться, что встроенные гены токсинов не содержат последовательностей, детерминирующих устойчивость к антибиотикам. Инсектициды, продуцируемые В. thuringiensis, при их нанесении на листья и стебли не действуют на насекомых, повреждающих корни растений. Чтобы обойти эту трудность, можно ввести ген токсина В. thuringiensisв штамм одного из видов бактерий, которые обитают в слое почвы, непосредственно прилегающем к корням (в ризосфере). Такие рекомбинантные бактерии, внесенные в почву, будут секретировать инсектицидный токсин прямо в ризосферу и защищать корни от насекомых все то время, в течение которого они остаются в почве. Это устраняет необходимость многократной обработки растений биологическими или химическими инсектицидами, Ген токсина В. thuringiensis subsp. kurstaki был встроен в хромосомную ДНК штамма Pseudomonasfluorescens, который образует колонии на корнях кукурузы, следующим образом (рис. 15.6). 1. Транспозон Тn5 встроили в плазмиду и генетически модифицировали его левую и правую фланкирующие последовательности и удалили ген транспозазы. Такой модифицированный транспозон не может вырезаться из плазмиды даже с помощью экзогенной транспозазы. 2. Ген токсина В. thuringiensis subsp. kurstaki встроили в середину модифицированного транспозона Тn5 так, чтобы он находился под контролем конститутивного промотора. 3. Транспозон Тn5 дикого типа встроили в хромосомную ДНК штамма P.fluorescens, обитающего на корнях. 4. Плазмиду, несущую модифицированный транспозон Тn5 со встроенным геном токсина, ввели в бактерию, в хромосомную ДНК которой был встроен транспозон Тn5 дикого типа. Микробные инсектициды 341
5. Осуществили гомологичную рекомбинацию с помощью двойного кроссинговера между не способным к транспозиции Тn5-элементом, несущим ген токсина, и «плазмидным» транспозоном Тn5 дикого типа, интегрированным в хромосому, В результате интеграции измененный транспозон Тn5 с геном токсина оказался встроенным в хромосомную ДНК, а транспозон Тn5 дикого типа был элиминирован. В таком виде ген токсина вряд ли утратится при крупномасштабном выращивании рекомбинантных микроорганизмов в лабораторных условиях или после их переноса в окружающую среду. Кроме того, вероятность передачи такого гена другим микроорганизмам в окружающей среде очень мала. Как показали предварительные исследования, рекомбинантный штамм P. fluorescensтоксичен для личинок бражника, Теперь планируется проверить способность этого рекомбинантного микроорганизма минимизировать повреждения корней насекомыми-вредителями в оранжереях и в полевых условиях. Гены токсинов В. thuringiensis вводили в хромосомную ДНК самых разных микроорганизмов. Так, гены cryIA (с) были введены в ДНК P. fluorescens, которые защищают растения са- 342 ГЛАВА 15 харного тростника от Eldana saccharîna. Трансформация этим геном бактерии Clavibacter xyli subsp. cynodontis, обычно обитающей в ксилеме бермудской травы, приводит к тому, что реком-бинантные бактерии приобретают способность защищать растения кукурузы от мотылька кукурузного (Ostrinianubilalis). Бакуловирусы как инструмент биоконтроляМеханизм действияБакуловирусы -- палочкообразные вирусы с двухцепочечным ДНК-геномом, инфицирующие разнообразных беспозвоночных. Различные подгруппы этого семейства патогенны для таких отрядов насекомых, как чешуекрылые, перепончатокрылые, двукрылые, сетчатокрылые, ручейники, жесткокрылые и равнокрылые. Некоторые из них играют важную роль в контроле численности определенных насекомых-вредителей в природных условиях. Бакуловирусы использовали в Северной Америке, начиная с 1930-х гг., до появления химических пестицидов в 1960-х гг., для борьбы с вредителями лесов, в том числе с пилильщиком еловым (Neodiprion sertifer), и продолжают применять, хотя и в меньшем масштабе, для контроля популяций непарного шелкопряда (Lymantria dispar) {табл. 15.3). Вирион бакуловируса имеет цилиндрический нуклеокапсид, в котором заключена его ДНК. Попав в ядро инфицированной клетки, бакуло- Таблица 15.3. Некоторые насекомые-вредители, для контроля численности которых применяют бакуловирусы
вирусные частицы объединяются, образуя компактную структуру, заключенную в кристаллический белковый матрикс. Он состоит в основном из белка полиэдрина. После гибели инфицированных насекомых в среду выходят миллионы полиэдриновых частиц. Попадая в кишечник других насекомых, они подвергаются действию щелочной среды, матрикс растворяется и высвобождаются инфекционные вирусные частицы. Они проникают в клетки кишечника насекомых, через цитоплазму попадают в ядро, где после удаления нуклеокапсида происходит репликация вируса и образование новых вирусных частиц. Некоторые из них попадают в кровоток насекомого, отшнуровываясь от плазматической мембраны инфицированных клеток, а затем и в другие органы. Обычно насекомое погибает по прошествии 10 раундов репликации вируса, т. е. примерно через 5-6 сут после инфекции, при этом до 25% сухой массы насекомого приходится на долю полиэдрина. Одно из преимуществ бакуловирусов как инструмента биоконтроля численности насекомых состоит в избирательности их действия. С одной стороны, это означает, что данный бакуловирус может использоваться для контроля численности только определенных насекомых-вредителей. Но с другой, благодаря тому что бакуловирусы эволюционировали в течение многих тысяч лет совместно со своими насекомыми-хозяевами, они научились преодолевать их защитные механизмы, а потому устойчивость к этим вирусам развивается крайне редко - гораздо реже, чем к В, thuringiensis. Более того, устойчивые к бакуловирусам насекомые быстро утрачивают эту способность после того, как прекращают взаимодействовать с вирусами. Фермеры и садоводы предпочитают использовать один инсектицидный агент, действующий на различных насекомых-вредителей, а не множество инсектицидов. Это означает, что для более широкого применения бакулирусов необходимо расширить круг их хозяев. Было показано, что при одновременном инфицировании клетки насекомого двумя штаммами бакуловирусов после их репликации иногда появляются новые штаммы, немного отличающиеся по своим действиям от исходных вирусов. Причиной этому является гомологич- Микробные инсектициды 343 ная рекомбинация между ДНК разных вирусов. Детальное изучение этого явления показало, что рекомбинация осуществляется в пределах участка ДНК длиной всего 79 нуклеотидов, расположенного в гене геликазы р143. Возможно, этот участок и определяет круг хозяев различных бакуловирусов. Учитывая все это, можно предположить, что замена в нем некоторых нуклеотидов позволит создавать бакуловирусы с более широкой специфичностью. Усиление биоконтроля с помощью генной инженерииБакуловирусы не оказывают свое действие мгновенно. В зависимости от условий инфицированное насекомое может погибнуть за период от нескольких дней до нескольких недель. Чтобы ускорить этот процесс, попытались увеличить вирулентность бакуловирусов введением в них чужеродных генов, в результате экспрессии которых произойдет ослабление инфицированного насекомого или его гибель (табл. 15.4). В одном из экспериментов предполагалось использовать ген, экспрессия которого в клетках насекомого-хозяина нарушает его нормальный жизненный цикл. Известно, что понижение уровня ювенильного гормона у личинок инициирует окукливание и приводит к прекращению их активного питания. Это снижение происходит в результате повышения содержания специфической эстеразы, катализирующей превращение биологически активной формы сложного метилового эфира ювенильного гормона в неактивную кислую
форму. Ингибирование активности эстеразы приводит к накоплению in vivo активного ювенильного гормона, личинки дольше остаются на стадии активного питания и в результате достигают гигантских размеров. Разумно было предположить, что при искусственном повышении уровня экстеразы ювенильного гормона произойдет понижение уровня эндогенного активного ювенильного гормона и преждевременное прекращение питания. К тому же было известно. что при уменьшении времени активного питания личинок урожаю наносится меньший ущерб. Чтобы проверить это предположение, пришлось сначала провести эксперименты по клонированию и экспрессии гена эстеразы ювенильного гормона. Фермент выделили из насекомого Heliothisvirescens(совки) и очистили. Определили его аминокислотную последовательность, синтезировали олигонуклеотид, соответствующий одному из сегментов белковой молекулы, и использовали его в качестве зонда для гибридизации. Из библиотеки кДНК H. virescensвыцедили кодирующую последовательность для эстеразы ювенильного гормона и встроили ее в геном бакуловируса так, чтобы она находилась под транскрипционным контролем вируса. После обработки таким рекомбинантным бакуловирусом Trichoplusia ni (совки ни), находящейся на первой личиночной стадии развития, содержание ювенильного гормона у насекомого снизилось, а рост личинок резко замедлился по сравнению с таковыми контрольных личинок, обработанных бакуловирусом дикого типа. К сожалению, применимость этого подхода для повышения эффективности инсектицидного действия бакуловирусов ограничивается тем, что ухудшение питания личинок при повышении уровня эстеразы ювенильного гормона происходит только на первой стадии развития личинок. Личинки, находящиеся на других стадиях развития, гораздо менее чувствительны к обработке бакуловирусами. Таким образом, бакуловирусы, специально сконструированные для экспрессии гена эстеразы ювенильного гормона, эффективны лишь тогда, когда личинки большей части популяции насекомого-вредителя находятся на первой стадии развития, что в естественных условиях почти недостижимо. 344 ГЛАВА 15 Другой подход к повышению эффективности инсектицидного действия бакуловирусов основан на включении в вирусный геном гена мощного насекомое пецифичного токсина, который экспрессировался бы во время цикла вирусной инфекции. В один из штаммов бакуловируса был введен ген насекомое пецифичного нейротоксина, синтезируемого североафриканским скорпионом, AndroctonusaustralisHector. Этот нейротоксин, не оказывающий никакого действия на мышей, блокирует транспорт ионов натрия в нейронах насекомых-мишеней, что приводит к параличу и смерти. Насекомые, которые были инфицированы бакуловирусом, несушим ген нейротоксина скорпиона, повреждали листья контрольных растений на 50% меньше, чем насекомые, инфицированные бакуловирусом дикого типа. Клонирование и экспрессия кДНК токсина израильского желтого скорпиона, Leiurusquinquestriatushebraeus, в бакуловирусе Autographacalifornicaпривело к уменьшению времени, которое необходимо для уничтожения 50% личинок контрольного насекомого, со 120 до 78 ч. Кроме того, через 120 ч после инфекции личинки насекомого, обработанные рекомбинантным вирусом, набрали втрое меньший вес по сравнению с личинками, обработанными вирусом ликого типа. Таким обра:юм, рекомби-нантный бакуловирус не только ускорял гибель инфицированных личинок, но и существенно уменьшал способность насекомых повреждать растения. Не так давно рекомбинантный бакуловирус A. californica, продуцирующий насекомоспе-цифичный нейротоксин Androctonusaustralis, был протестирован в полевых условиях, В проведенных ранее лабораторных экспериментах наблюдалось уменьшение времени, необходимого для уничтожения насекомого Т. ni, на 25—50%, но еще больший эффект оказывал рекомбинантный бакуловирус в контрольных полевых испытаниях (рис. 15.7): он быстрее приводил к гибели насекомых, снижал ущерб, причиняемый растениям капусты, сокращал число вредителей в следующем цикле репродукции. Какую бы эффективность ни обнаруживал конкретный рекомбинантный бакуловирус в
лабораторных экспериментах, основным препятствием на пути его широкомасштабного применения является высокая стоимость его препаратов и трудность распространения. Ба-куловирусы — это облигатные паразиты, они могут размножаться только в живом организме или в культуре клеток насекомого. Стоимость препаратов бакуловирусов, независимо от того, является вирус рекомбинантным или нет, гораздо выше, чем химических инсектицидов. И тем не менее не исключено, что биологические инсектициды найдут более широкое применение, если учесть, какое неблагоприятное воздействие на окружающую среду оказывают химические инсектициды, т. е. если сопоставить их стоимость и выгоду, которую они дают. ЗАКЛЮЧЕНИЕВ настоящее время микробиологические инсектициды получают все более широкое распространение благодаря тому, что они не оказывают вредного воздействия на окружающую среду. Некоторые подвиды бактерии Bacillis thuringien- Микробные инсектициды 345 sis образуют протоксин, который, попадая в кишечник насекомого, в условиях щелочной среды и под действием пищеварительных протеаз превращается в активный токсин и вызывает гибель насекомого. Летальное действие токсина обусловливается образованием в мембранах клеток кишечника ионных каналов, через которые АТР выходит из клеток. Это приводит к нарушению метаболизма, прекращению питания, дегидратации и т. д. Токсины В, thuringiensis высокоспецифичны в отношении ограниченного числа видов насекомых и нетоксичны для всех остальных; они разрушаются в окружающей среде и поэтому редко оказывают ощутимое влияние на нее, что не способствует отбору устойчивых к ним насекомых. Благодаря всем этим свойствам биологические инсектициды являются перспективными кандидатами на роль агентов, с помощью которых можно контролировать численность насекомых, причиняющих ущерб сельскохозяйственным культурам, и насекомых — переносчиков болезней человека. Клонированы и охарактеризованы гены различных токсинов В. thuringiensis. Один из таких генов был введен в неспорулирующий штамм Bacillus. При этом ген экспрессировался на всех стадиях развития микроорганизма, а не только на стадии образования спор, когда формируется параспоральный кристалл. Чтобы расширить специфичность токсина В, thuringiensis, гены различных токсинов встраивали в плазмиды и вводили в хозяйский штамм — либо в составе плазмид с широким кругом хозяев, либо путем интеграции в хромосомную ДНК клетки-хозяина. Бактерии, несущие два разных токсиновых гена, иногда оказывались токсичными для какого-то третьего вида насекомого-вредителя, а не только для тех двух видов насекомых, на которых действовали продукты исходных генов, С помощью генетических манипуляций был создан рекомбинантный белок, состоящий из двух доменов, кодируемых разными генами В. thuringiensis. Он оказывал двоякое токсическое действие. В ходе другого эксперимента рецепторсвязывающий домен одного токсина был объединен с обладающим токсичностью доменом другого. Есть надежда, что применение таких гибридов уменьшит вероятность появления устойчивых насекомых. Гены токсинов В. thuringiensisвводили также в различные обитающие в поверхностном слое воды микроорганизмы, которые служат пищей для личинок комаров. Этот подход оказался весьма эффективным для прямой доставки токсинов В. thuringiensisв организм насекомого-мишени. Генноинженерными методами были созданы также бактерии, обитающие в ризосфере и экспрессирующие гены токсинов В. thuringiensis, Это позволяет бороться с насекомыми, повреждающими корни растений. Бакуловирусы патогенны для многих видов насекомых, но каждый их штамм специфичен в отношении небольшого числа видов. Обычно гибель инфицированного насекомого происходит лишь спустя довольно длительное время, поэтому бакуловирусы не очень эффективны как средство контроля численности насекомых. Однако в различные штаммы бакуловирусов можно ввести специфические гены, и тогда вирус может действовать как система доставки гена, обеспечивающего синтез инсектицида в течение всего жизненного цикла вируса. Проведены предварительные испытания в лабораторных условиях, которые дали положительные результаты. Кроме того, в бакуловирус был введен ген нейротоксина, смертельного для насекомых, и были проведены полевые испытания. ЛИТЕРАТУРАAnanda Kumar Р., R. P. Shamia, V. S. Malik. 1996. The insecticidal proteins of Bacillus thuringiemis. Adv. Appl. Microbiol. 42: 1-43. Baum J. A., T. Mahar. 1995. Regulation of insecticidal crystal protein production in Bacillus thuringiensis. Mol. Microbiol. 18: 1—12. Bonning В. С., B. D. Hammock. 1992. Development and potential of genetically engineered viral insecticides. Biotechnol. Genet. Eng. Rev. 10:455—489. Bosch D., B. Schipper, H. van der Kleij, R. A. de Maagd, W. J. Mtiekema. 1494. Renirnbirmnl Bacillus thuringiensis crystal proteins with new properlies: possibilities for resistance management. Bio/Technology 12: 915-918. 346 ГЛАВА 15 Calogero S., A. M. Albertini, C. Fogher, R. Marzari, A. Galizâ. 1989. Expressiion of a cloned Bacillus thuringiensis delta-endotoxin gene in Bacillus subtiiis. Appl. Environ. Microbioi, 55: 446—453. Caramon T., A. M. Albertini, A. Galizzi. 1991. In vivo generation of hybrids between two Bacillus thuringiensis insect-toxin-encoding genes. Gene 98: 37-44. Chejanovsky N., N. Zilberberg, H. Rivkin, L. Zfotkin, M. Guervit/. 1995. Functional cxpressk>n of an alpha anti-insect scorpion neu-rotoxin in insect cells and lepidopterous larvae. FEBS Lett. 376: 181-184. Chungjatupornchai W. 1990. Expression of the mos-quitocidal-protein genes of Bacillus thuringiensis subsp. ismelensis and the herbicide-resistance gene bar in Synechocystis PCC6803. Curr. Microbioi. 21: 283-288. Cory J. S., M. L. Hirst, T. Williams, R. S. Hails, D. Goulson, B. M. Green, T. M. Carty, R. D. Possee, P. J. Cay ley, D. H. L, Bishop. 1994. Field trial of a genetically improved bac-ulovirusinsecticide. Nature yjfc 138—140. Crickmore N., C. Nicholls, Ü. J. Еагр, Т. С. Hodgman, D. J. Ellar. 1990. The construction of Bacillus ·; '·. ΐ'ί·ί,·:ί.jfr-nns expressing novel сШол.осиЫ δ-endotoxin combinations. Biochem. J. 270: 133-136. Croizier G., L. Croizier, O. Argaud, D. Poudevigne. 1994. Extension i>f Autographa californica nuclear polyhcdrosis virus hnst range by interspecific replacement of a short DNA sequence in the pl43 helicase gene. Proc. Nail. Acad. Sei. USA 91: 48-52. Ferré J-, M. D. Real, J. Van Rie, S. Jansens, M. Peferoen. 1991. Resistance to the Bacillus thuringiensis bioinsecticide in a field population of Ptutella xylostella is due to a change in a midgut membrane receptor. Proc. Natl. Acad. Sei. USA 88:5119-5123, Fuxa J. R. 199). Insect control with baculoviruses. Biotechnol. Adv. 9: 425-442. Ge A. Z., N. I. Shivarova, D. H. Dean. 1989. Location of the Bombyx mon specificity domain on a Bacillus thuringiensis 6-endotoxin protein, Proc. Natl. Acad. Sei. USA 86: 4037-4041. Gelernter W., G. E. Schwab. 1993. Transgenic bacteria, viruses, algae and other microorganisms as Bacillus thuringiensis toxin delivery systems, p. 89-104. In P. F. Entwistle, J. S. Cory, M, J. Bailey, S. Higgs (ed.), Bacillus thuringiensis, an Environmental Biopesticide: Theory and Practice. Johm Wiley & Sons, Chichester, United Kingdom. Hammock B. D., B. C. Banning, R. D. Possee, T. N. Hanzfik, S. Maeda. 1990. Expressioin and effects of the juvenile hormone esterase in a bac-ulovirus vector. Nature 344: 458—461. Held G. A., L. A. Bulla, E. Ferrari, J. Hoch, A. L Aronson, S, A. Minnich. 1982. Cloning and localization of the lepidopteran protoxin gene of Bacillus fhttringiensis subsp. kurstaki. froc. Natl. Acad. Sei. USA 79: 6065-6069. Herrera G., S. J. Snyman, J. A. Thomson. 1994. Construction of a bioinsecticidal strain of Pseudomonasfluorescens active against the sugarcane borer, Eldana saccharine. Appl, Environ. Microbioi. 60: 682-690. Kaiman S., K. L. Kiehne, N. Cooper, M. S. Reynoso, T. Yamamoto. 1995. Enhanced production of insccticidal pmlcms in ВасШик Ihuringiensis strains carrying an additional crystal protein gene in their chromosomes. Appl. Environ. Microbioi. 61: 3063-3068. Lampel J. S., G. L. Canter, M. B. Dimock, J, L, Kelly, J. J. Anderson, B. B. Uratani, J. S. Foulke, Jr., J. T. Turner. 1994. Intcgrative cloning, expression, and stability of the crylA(c) gene from Bacillus thuringiensis subsp. kurstaki in a recombinant strain of Clavibacter xyli subsp. cynodontis. Appl. Environ. Microbioi. 60: 501-508. Lereclus D., H. Agaisse, M. Gominet, J. Chaufaux. 1995. Overproduction of encapsulated insectici-dal crystal proteins in a Bacillus thuringiensis spoOA mutant. Bio/Technology 13: 67-71. Lereclus D., A. Delécluse, M. M. Lecadet. 1993. Diversity of Bacillus thuringiensis toxins and genes, p. 37-69, In P. F. Entwistle, J. S. Cory, M. J. Bailey, S. Higgs (ed.), Bacillus thuringiensis, an Environmental Biopesticide: Theory and Practice. John Wiley & Sons, Chichester, United Kingdom. Liu J. T., M. J. Sui, D. D. Ji, I. H. Wu. C. C. Chou, С, С. Chen. 1993. Protection from ultraviolet radiation by melanin of mosquitocidal activity oi iiacillux ihurmgiensis var. tsraelensis. J. Invertebr. Pathol.62: 131-136. Микробные инсектициды 347 Uu J. W., W. H. Yap, T. Thanabalu, A. G. Porter. 1996. Efficient synthesis of mosquitocidal toxins in Asticcacaulis excentricus demonstrates potential of gramnegative bacteria in mosquito control, Nat. Biotechnoi 14: 343-347. Maeda S. 1995. Further development of recnmbi-nant baculoviniK insecticides. Curr. Opln. Biotechnoi. 6:313-319. McCutchen B, F., P. V. Choudarj, IÎ. Crenshaw, D. Maddox, S. G. Kamita, N. Palekar, S. Vclrath, E. Fowler, B, D. Hammock, S. Maeda. 1991. Development of a recombinant baculovirus expressing an insect-selective neurotoxin: potential for pest control. Bio/Technology 9: 848-852. Mettus A. M., A. Macafuso. 1990 Expression of Bacillus thuringiensis й-endntoxin genes during vegetative growth. Appl. Environ. Microbiol. 56: 1128-1134. Murphy R. C., E. S. Stevens. 1991. Cloning and expression of the crylVD gene of Bacillus thuringiensi!, suhsp. Kraelenxis m the cyanobac-• .im Л, -ut 'uin νιΐί>··ΙηψΙΐ(·, tut ΆΊ;-mu i:.'. resulting larvicidal activity, Appl. Environ. Microbiol. 58: 1650 1655. Otxikowic/ M. ti., F. J. Perlak, K. Kusaiio-Kretymer, E. J. Mayer, S. L· Bolten, L· S. Watrud. 1986. Tn5-mediated integration of the delta-endotoxin gene from Bacillus thuringiensis into the chromosome of root-colonizing pseudomonads. J. Bacterial. 168: 982-989. Obukowicz M. G., F. J. Perlak, K. Kusano-Kretzmer, E. J. Mayer, L. S. Watrud. 1986. Integration of the delta-endotoxin gene of Bacillus ihuringiensis into the chromosome of root-colonizing strains of pseudomonads using Tn5. Gene 45: 327-33). Priest F. G. 1992. Biological control of mosquitoes and other biting flies by Bacillus .sphaericus and Bacillus thuringiensls. J. Appl. Bacterial. 72: 357-369. Schnepf H. E.f H. R. Whiteley. 1981. Cloning and expression of the Bacillus thuringiensis crystal protein gene in Escherichia coli. Proc. Natt. Acad. Sei. USA 78: 2893-2897. Stewart L. M. D., M. Hisrt, M. L. Ferber, A. T. Merryweather, P. J. Cayley, R, D. Possee. 1991. Construction of an improved baculovirus insecticide containing an insect-specific toxin gene. Nature 352: 85-88. Thanabalu T., J. Hindley, S. Brenner, C. Oei, C. Berry. 1992. Expression of the mosquitocidal toxins of Bacillus sphaericus and Bacillus Ihuringiensis subsp. israelensis by recombinant Caulobacter crescentus, & vehicle for biological control of aquatic insect larvae. Appl. Environ. Microbiol. 58:905-910. Thiery I., L. Nicholas, R. Kippka, N. Tandeau de Marsac. 1991. Selection of cyanobacteria isolated from mosquito breeding sites as a potential food source for mosquito larvae. Appl. Environ. Microbiol. 57: 1354-1359. Tomalski M. D., L. K. M U 1er. 1991. Insect paralysis by baculovirus-mediated expression of a mite neurotoxin gene. Nature 352: 82 -84. Van Rie J., W. H. McGaughey, D. E. Johnson, B. I). Harriett, H. Van Mdlaert. 1990. Mechanism of inscel resistiinee of the microbial inscelieide Bacillus thuringiensis. Science 247: 72—74. Wood Η. Α., R. R. Granados. 1991. Genetically engineered baculoviruses as agents fbr pest control. Annu. Rev. Microbiol. 45: 69-87. Yap W. H., T. Thanabalu, A. G. Porter. 1994. Expression of mosquitocidal toxin genes in a gas vacuolatcd strain i>t Ancylobactcr aquaticus. Appl. Environ. Microbiol. 60; 4199-4202. КОНТРОЛЬНЫЕ ВОПРОСЫ1. Каковы преимущества биологических инсектицидов перед химическими? 2. Почему токсин Bacillusthuringiensisне токсичендля человека? 3. Какой подход вы использовали бы для идентификации гена протоксина Bacillusthuringiensissubsp. israilensis? Какое практическое применение может найти этот ген? 4. Как выяснить, где локализован ген определенного протоксина: в плазмиде или в хромосомной ДНК B. thuringiensis? 5. Как с помощью генной инженерии можно улучшить полезные свойства того или иного протоксина В. thuringiensis? 6. Как, используя методы генной инженерии, повысить эффективность бакуловирусов как инсектицидных агентов? 7. Каким образом можно расширить видоспецифичность токсинов? 348 ГЛАВА 15 8. Какую информацию вы можете получить, зная, к какому классу относится тот или иной белок Cry? 9. Как бы вы модифицировали белок Cry, чтобы уменьшить вероятность появления насекомых, утойчивых к токсину? 10. Почему бактерия Asticcacaulisexcentricusявляется весьма привлекательным микроорганизмом для осуществления в ней экспрессии генов токсинов В. thuringiemis? 11. Как расширить круг насекомых, инфицируемых данным бакуловирусом? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||