Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
Генетическая трансформация эмбрионов мыши микроинъекцией очищенной ДНК |
| J. W. Gordon, G. A. Scangos, D. J, Plotkin, J. A. Barbosa. F. H. Ruddle Proc. Nuit, Acad, Sei. USA 77: 7380-7384, 1980 |
Экспрессия гена тимидинкиназы вируса простою герпеса в соматических клетках мыши после инъекции рекимбинантною гена в яйцеклетки |
| R. L. Brinster, H. Y. Chen, M. Trumbauer, A, W. Senear, R. Warren, R. D. Palmiter Cell 27: 223-231, 1981 |
| Впервые возможность переноса ДНК при помощи микроинъекций в пронуклеус оплодотворенной яйцеклетки мыши была проиллюстрирована Дж. Гордоном и др. В этом эксперименте в несколько сотен оплодотворенных яйцеклеток инъецировали плазмидный вектор pBR322, содержащий ген тимидинкиназы вируса простого герпеса (HSV) и часть генома обезьяньего вируса 40 (SV40). Из 78 потомков, рожденных приемными матерями, два содержали плазмидную ДНК. Авторы сделали вывод, что «эти данные свидетельствуют о возможности использования рекомбинантных плазмид в качестве вектора для введения чужеродных генов непосредственно в эмбрионы мышей, которые сохраняют эти гены в ходе развития». К сожалению, плаз- | мидная ДНК не была интактна, и ген тимидинкиназы HSV не стал трансгеном. Бринстер и др. инъецировали ген тимидинкиназы HSV под контролем промотора гена металлотионеина-I и обнаружили, что у одной из полученных трансгенных мышей синтезировалось больше тимидинкиназы HSV в клетках печени и почек, чем у трех других, синтезировавших этот фермент лишь в небольшом количестве. Кроме того, восемь других трансгенных животных несли ген тимидинкиназы HSV, но не синтезировали активного фермента. По данным Саузерн-блоттинга, у всех трансгенных мышей введенная ДНК присутствовала в большом числе копий. Эти два исследования послужили основой экспериментов по | трансгенозу мышей. Несмотря на техническую сложность и относительную неэффективность метода с использованием микроинъекций, эти эксперименты оказались вполне успешными. В настоящее время различные линии мышей, которые несут чужеродные гены {трансгенные мыши) или собственные гены, выведенные из строя интеграцией фрагмента чужеродной ДНК («нокаутированные" гены), используются в самых разных целях: для изучения процессов регуляции генов и развития млекопитающих, возникновения вирусных заболеваний и рака, мутагенных эффектов различных агентов и многого другого. Кроме того, трансгенные мыши и мыши с «нокаутированным» геном представляют интерес как модельные системы для исследования болезней человека. | |||
| | | | | ||
клетки на ранних стадиях эмбриогенеза и инициации транскрипции в этот период пока не ясно, удастся ли осуществить перенос ядра в случае каких-либо других домашних животных, кроме овец, если донорское ядро будет находится на той же стадии, что и яйцеклетка.
Перенос генов с помощью искусственных дрожжевых хромосом
Большинство трансгенов представляют собой кДНК, небольшие гены (<20 т, п. н.) или фрагменты генов. Зачастую кДНК плохо экспрессируются в клетках млекопитающих, а когда трансгеном служит геномная ДНК, важные геноспецифичные регуляторные последовательности, расположенные до и после гена-мишени, обычно не входят в состав вставки. Кроме того, полноразмерные гены и мультигенные комплексы (>100 т. п. н.) слишком велики для встраивания в обычные векторы. Учитывая все это, для трансгеноза стали использовать искусственные дрожжевые хромосомы (YAC), вмещающие фрагменты геномной ДНК длиной от 100 до > 1000 т. п. н.
Трансгенных мышей получали микроинъекцией в пронуклеус оплодотворенной яйцеклетки или трансфекцией ES-клеток с помощью YAC, несущих несколько родственных генов или один большой ген. Трансгенные мыши, несущие кластер из пяти функциональных генов ß-глобина человека суммарной длиной примерно 250 т. п. н., экспрессировали все эти гены тканеспецифично и в нужное время — точно так же, как это происходит у человека. Такое соответст-
Трансгенные животные 429
вне обеспечивалось фланкирующими их последовательностями, которые содержат промотор и другие важные регуляторные элементы.
Создание мышей, которые синтезировали бы только человеческие антитела, — это примечательный пример трансгеноза с помощью YAC. Как отмечалось в гл. 10, моноклональные антитела можно использовать для лечения некоторых заболеваний человека. Однако получить человеческие моноклональные антитела практически невозможно. К сожалению, и моноклональные антитела грызунов иммуногенны для человека. Чтобы «очеловечить» существующие моноклональные антитела грызунов, были разработаны сложные стратегии с использованием рекомбинантных ДНК. В результате этих трудоемких процедур удалось получить Fv- и Fab-фрагменты, зачастую обладающие каким-то сродством к специфическому антигену. Возможно, технологического прорыва удастся достичь, если использовать для получения полноразмерных человеческих антител более доступный метод с использованием гибридом.
Синтез природных антител — это настоящее чудо. Антитело — очень сложная тетрамерная конструкция, состоящая из двух пар разных цепей. Одна из них называется тяжелой (H), a другая — легкой (λ или к). Эти термины отражают различия в молекулярных массах субъединиц антитела. Генетические особенности каждой тяжелой цепи определяются комбинацией вариабельного (VH), дивергентного (DH), шарнирного (JH) и константного (Сн) участков (доменов) соматической ДНК в B-клетке. Известны два типа легких цепей, λ и к, которые образуются в результате перестройки их собственных вариабельных (νλ, Vk), шарнирных (Jλ, Jk) и константных (Cλ, Ск) доменов. Данная В-клетка синтезирует один вид антител, с уникальной комбинацией участков, составляющих Η-цепь, и либо перестроенной λ-, либо к-цепью.
Набор генетических элементов, обеспечивающих образование множества разных Н-цепей антител человека, включает около 95 VH-доменов, 30 Dн-доменов, 6 Jн-доменов и 5 основных константных (С, Сγ, Сδ, Сε, Cμ) доменов. Ло-кус к-генов содержит примерно 76 Vк-доменов, 5 Jк-доменов и один константный (Ск) участок (рис. 19.9). Размер Н-локусов и к-генов — от 1 до 1,5 т. п. н. Для создания трансгенных мышей, способных синтезировать множество различных человеческих антител, необходимо инактивироватъ мышиные гены Н- и L-цепей, а затем встроить в хромосомную ДНК мыши YAC, содержащую гены Н- и L-цепей каждого человеческого гена иммуноглобулина,
Чтобы решить эту задачу, мышиные гены Н-и к-цепей были заменены («нокаутированы») небольшим участком кластера генов Η-цепи человека (который включал 4 Vн-домена, 16 DH-доменов, 6 Дн-доменов, Сγ и Cμ) и кластера генов к-цепи человека (содержащего 4 Vк-домена, 5 Jк-доменов и Ск). Трансгенные мыши с таким набором генов антител человека синтезировали человеческие антитела к некоторым антигенам; кроме того, были созданы гибридомы, продуцирующие человеческие моноклональные антитела. Однако разнообразие человеческих антител, продуцируемых такими трансгенными мышами, было невелико вследствие ограниченности набора вариабельных сегментов Н- и к-цепей. Чтобы решить эту проблему, создали YAC с большим числом генов вариабельных участков Н- и к-цепей гемоглобина человека.
Объединив четыре разные YAC с генами Н-цепей гемоглобина человека, создали YAC длиной 1000 т. п. н., несущую 66 Vн-доменов, около 30 Dн-сегментов, 6 Jн-доменов, C, Сδ, и Сγ. Аналогично, из трех YAC, несущих различные домены vk, создали YAC длиной 800 т. п. н. с 32 vk-доменами, 5 JK-доменами и Ск. ES-клетки трансфицировали по отдельности YAC с генами Н- и к-цепей методом слияния клеток, отобрали клетки, в которых произошла интеграция YAC, с помощью селективного маркера и проверили целостность каждой вставки методом ПЦР. Инъецировали клетки, несущие встроенные гены Н- либо к-цепи, в бластоцисты и идентифицировали особь-основателя с помощью ПЦР. Трансгенных мышей со вставками генов Н- и к-цепей скрещивали по отдельности с мышами с инактивированными локусами этих цепей. Затем потомство скрещивали между собой, чтобы получить мышей, лишенных функциональных мышиных генов Н- и к-цепей, но несущих обе вставки генов Н- и к-цепей гемоглобина человека,
Трансгенные мыши с увеличенным числом человеческих VH- и Vк-доменов синтезировали
430 ГЛАВА 19
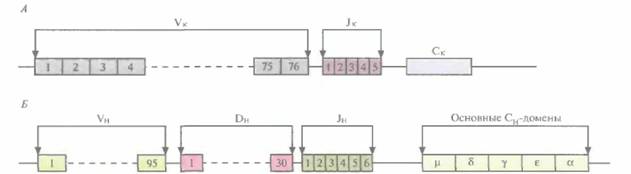 |
| Рис. 19.9. Схематичное изображение генов к- и Η-цепей иммуноглобулинов человека. А. Строение гена к-цепи иммуноглобулина в клетках зародышевой линии. Штриховая линия — промежуточные домены, здесь не показанные. Ген функциональной к-цепи, например Vк8-Jк4-Ск, образуется в B-клетках в результате нескольких перестроек соответствующих ДНК- доменов. Представленная здесь комбинация — лишь одна из 500 возможных. Б. Строение гена Η-цепи иммуноглобулина в клетках зародышевой линии. Штриховая линия — промежуточные домены, здесь не показанные. Ген функциональной Η-цепи, например VH33-DH26-JH4-C образуется в B-клетках в результате ряда перестроек соответствующих доменов. Представленная здесь комбинация — лишь одна из 140 000 возможных. На рисунке показан только один Сγ-домен, хотя на самом деле их четыре (Cγl, Сγ2а, Сγ2b и Сγ3). |
человеческие антитела. Их иммунизировали тремя разными антигенами, и в каждом случае гибридомы секретировали человеческие моноклональные антитела, обладаюшие высоким сродством к антигену, которым животные были иммунизированы. Весьма вероятно, что с помощью такой трансгенной системы удастся получать человеческие моноклональные антитела для использования их в медицине.
Трансгенные мыши: применение
Трансгенные мыши могут служить модельными системами для изучения болезней человека и тест-системами для исследования возможности синтеза продуктов, представляющих интерес для медицины. Используя целых животных, можно моделировать и возникновение патологии, и ее развитие. Однако мышь — не человек, хотя она тоже относится к классу млекопитающих, поэтому данные, полученные на трансгенных моделях, не всегда можно экстраполировать на человека в том, что касается медицинских аспектов. Тем не менее в некоторых случаях они позволяют выявить ключевые моменты этиологии сложной болезни. Принимая во внимание все это, ученые разработали «мышиные» модели таких генетических болезней человека, как болезнь Альцгеймера, артрит, мышечная дистрофия, образование опухолей, гипертония, нейродегенеративные нарушения, дисфункция эндокринной системы, сердечно-сосудистые заболевания и многие другие.
Болезнь Альцгеймера — это дегенеративный процесс, приводящий к утрате клеток различных отделов головного мозга. Наиболее ранним проявлением служит ухудшение памяти. Этот процесс прогрессирует, к нему присоединяются утрата способности к абстрактному мышлению, изменение личности, нарушения речи, снижение физического статуса. Патология наблюдается у 1% людей возрастной группы от 60 до 65 лет и у 30% людей старше 80 лет. При патоморфологическом исследовании в теле нейронов обнаруживаются нейрофибриллярные клубочки, а у синаптических окончаний — плотные агрегаты, называемые сенильными бляшками (рис. 19.10). Кроме того, в кровеносных сосудах мозга обнаруживаются конгломераты — амилоидные бляшки,
Основным компонентом сенильных и амилоидных бляшек является белок Aß (амилоид β, ß-белок, ß-амилоидный белок, β/Α4) мол. массой 4 кДа. Существуют Aß-белки с разным числом аминокислотных остатков, например Αβ40 и Αβ42. Все они образуются в результате протео-
Трансгенные животные 431
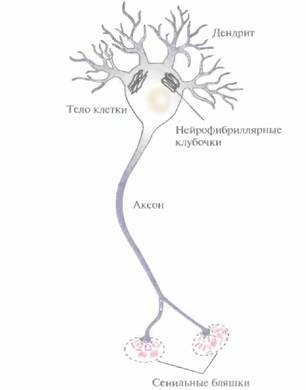 |
| Рис, 19.10, Схематическое изображение нейрона коры головного мозга человека с указанием некоторых гистологических особенностей, характерных для болезни Альцгеймера. У синапсов образуются сенильные бляшки, содержащие амилоидные скопления и обломки клеток, В геле нейрона накапливаются нейрофибриллы, включающие агрегаты из белков цитоскелета и других белков. Происходят и другие изменения, здесь не показанные. |
литического расщепления белка-предшественника (АРР). Причины аккумуляции Aß-белка не установлены. Члены некоторых семей, в которых с высокой частотой встречается болезнь Альцгеймера, несут мутации в гене АРР, что наводит на мысль об участии этого гена в возникновении данной патологии. К сожалению, проследить в деталях за возникновением и развитием болезни Альцгеймера на человеке не удается. Неоценимую помощь в этом могла бы оказать какая-нибудь «животная» модель,
Было получено множество трансгенных мышей, несущих полноразмерный ген АРР или его часть под контролем нейроспецифичного промотора. При этом у большинства животных образование амилоидных бляшек, нейрофибриллярных клубочков, гибель нейронов или нарушение поведения не отмечались. Однако у животных, несущих трансген, кодирующий участок из 100 последних аминокислот АРР, который включал и Aß-белок, обнаруживалась дегенерация нервных тканей, аналогичная таковой при болезни Альцгеймера.
Более адекватные «животные» модели, позволяющие изучать болезнь Альцгеймера, были созданы с использованием трансгенов, содержащих мутации в гене АРР, характерные для некоторых семей с высокой частотой встречаемости болезни Альцгеймера в раннем возрасте (<50 лет), У одной группы таких семей в положении 717 АРР (АРР-717) вместо валина присутствовал фенилаланин, в другой группе в положениях 670 и 671 АРР (АРР-670/671) лизин и метионин были заменены на аспарагин и лейцин соответственно.
Трансген с мутацией АРР-717 был создан на основе кДНК АРР встраиванием между экзонами 6 и 7, 7 и 8, 8 и 9 модифицированных интронов. Интроны вводились потому, что, согласно данным эксперимента, содержащие их трансгены транскрибируются более эффективно, чем трансгены без интронов. Конструкция «кДНК АРР—интроны» находилась под контролем промотора гена ß-фактора роста из тромбоцитов, экспрессирующегося в тканях мозга (рис. 19.11). Вся она была названа мини-геном PDAPP. У стареющих трансгенных мышей (старше 6 месяцев), несущих около 40 копий PDAPP, образовывались амилоидные бляшки, отмечались гибель нейронов и дефекты памяти. Конструкция АРР-670/671 под контролем нейроспецифичного промотора вызывала у трансгенных мышей симптомы, подобные симптомам болезни Альцгеймера, в том числе образование избыточных количеств Aß42. Интересно, что ни у стареющих мышей, несущих PDAPP-мини-ген, ни у трансгенных мышей АРР-670/671 нейрофибриллярные клубочки не обнаруживались. Возможно, эти структуры возникают у человека как следствие сверхпродукции Aß42,
В развитии болезни Альцгеймера у человека участвуют еще три гена — АроЕ4, гены пресенилина l (PS1) и пресенилина 2 (PS2). Наличие аллеля АроЕ4 локуса АроЕ, который ответствен за
432 ГЛАВА 19
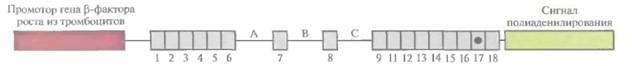 |
| Рис. 19.11. Генетическая конструкция, называемая мини-геном PDAPP, с помощью которой можно моделировать развитие болезни Альцгеймера утрансгенных мышей. 1—10 — экзоны кДНК белка-предшественника амилоида, А— С — введенные интроны. Регуляторными элементами являются промотор гена ß-фактора роста из тромбоцитов и сигнал полиаденилирования вируса SV40. |
транспорт липидов, коррелирует с увеличением вероятности возникновения болезни Альцгеймера у людей старше 60 лет, В семьях, где отмечается развитие этой болезни в молодом возрасте, обнаруживаются мутации в генах пресенилинов, однако роль каждого из них в развитии данной патологии не выяснена. По данным разных авторов, мутации в генах пресенилинов приводят к увеличению аккумуляции Aß42. Например, у дважды трансгенных мышей, полученных скрещиванием трансгенных мышей, которые несли полноразмерный человеческий ген АРР, с мышами, несущими мутантный ген пресенилина 1, отмечалась сверхпродукция Aß42. Пока о патогенезе болезни Альцгеймера мало что известно, но есть надежда, что животные модели помогут ответить на некоторые важные вопросы о ее молекулярных основах. В США эта болезнь поражает ежегодно около 4 млн. человек, и наносимый ею ущерб составляет порядка 100 млрд. долларов.
Трансгенных мышей использовали также в качестве модельных систем для изучения экспрессии генов, кодирующих трансгенные продукты, которые секретируются в молоко. Так, для изучения функций белка, нарушения в котором приводят к муковисцидозу (CFTR), и для разработки подходов к лечению муковисцидоза (CF) необходимы большие количества аутентичного CFTR-белка.
Муковисцидоз — распространенная генетическая болезнь, поражающая в странах Европы одного из 2500 новорожденных. Первичный эффект дефектного CF-гена - это изменение функции CFTR, который в норме служит каналом для ионов хлора. В результате блокирования потока этих ионов в клетку и из клетки в протоках некоторых органов, особенно в легких и поджелудочной железе, скапливается слизь. Она становится источником бактериальной инфекции, которая с трудом поддается лечению антибиотиками. ДНК, высвобождающаяся из лизи-ровавших бактерий, делает слизь очень густой. Загустевшая слизь забивает протоки, нарушается нормальная работа органа и симптомы муковисцидоза еще более усиливаются. Продолжительность жизни больных муковисцидозом составляет в настоящее время 25-30 лет.
Для того чтобы лучше изучить механизм действия CFTR, необходимо иметь этот белок в достаточном количестве. Все известные клеточные системы экспрессии in vitro не обеспечивали его эффективного синтеза. Возможно, это связано с аккумуляцией CFTR в мембранах трансфицированных клеток. Решить эту проблему можно было бы постоянным удалением плазматических мембран из хозяйских клеток. В такой системе гетерологичный трансмембранный белок связывался бы с отдельными фрагментами плазматической мембраны, что значительно облегчало бы его концентрирование и очистку. Аналогичный механизм используется клетками молочной железы для образования глобул жира в период вскармливания. Жировые капельки инкапсулируются в плазматической мембране и в таком виде секретируются в молоко.
Чтобы проверить действенность этой системы, полноразмерную кДНК CFTR встроили в середину дефектного гена ß-казеина козы, из которого был удален участок от конца экзона 2 до начала экзона 7 (рис, 19.12). Получившаяся конструкция содержала промотор и сигнал терминации транскрипции гена ß-казеина козы. При этом кДНК CFTR была встроена в структурный ген с интронами, благодаря которым повышалась эффективность транскрипции трансгена. Ген ß-казеина активно экспрессируется в клетках молочных желез в период вскармливания, и этот белок является основным белком молока.
Трансгенные животные 433
 |
| Рис. 19.12, Генетическая конструкция «кДНК СFТG -ген ß-казеина козы». Πолноразмерная кДНК CFTR встроена между экзонами 2 (ЕХ2) и 7 (ЕХ7) гена ß-казеина козы. Сохранены промотор, терминатор и экзоны 1,8 и 9(ЕХ1, ЕХ8 и ЕХ9) гена казеина. |
Были получены линии трансгенных мышей, несущих кДНК CFTR под контролем регуляторных последовательностей гена ß-казеина. Как и ожидалось, в молоке трансгенных самок содержался CFTR-белок, связанный с мембранами глобул жира. Никаких отрицательных побочных эффектов у кормящих CFTR-трансгенных самок или у мышат, вскормленных их молоком, не наблюдалось. CFTR был гликолизирован и легко экстрагировался из жировой фракции молока. Остается только выяснить, является ли он аутентичным белком. Исследовалась также возможность получения других мембраносвязан-ных белков с молоком. В клетках молочных желез трансгенных мышей в период лактации синтезируется множество белков, представляющих интерес для медицины. Но чтобы иметь возможность получать CFTR, другие трансмембранные белки и различные белки человека в больших количествах, соответствующие трансгенные конструкции необходимо встраивать в геном более крупных млекопитающих — коровы, овцы или козы.
Трансгенный крупный рогатый скот
Если предполагается использовать молочную железу в качестве «биореактора», то наиболее предпочтительным животным для трансгеноза является крупный рогатый скот, который ежегодно дает до 10 000 л молока, содержащего примерно 35 г белка на 1 л. Если в молоке будет содержаться такое количество рекомбинантно-го белка и эффективность его очистки составит 50%, то от 20 трансгенных коров можно будет получать примерно 100 кг такого белка в год. По случайному совпадению, именно столько белка С, использующегося для предотвращения тромбообразования, требуется ежегодно. С другой стороны, одной трансгенной коровы будет более чем достаточно для получения требуемого ежегодно количества фактора IX (фактора Кристмаса) каскадного механизма свертывания крови, который вводят больным гемофилией для повышения свертываемости крови.
Для создания трансгенных коров использовали модифицированную схему трансгеноза мышей методом микроинъекций ДНК (рис. 19.13). Процедура включала следующие основные этапы.
1. Сбор ооцитов коров, забитых на скотобойне.
2. Созревание ооцитов in vitro.
3. Оплодотворение бычьей спермой in vitro.
4. Центрифугирование оплодотворенных яйцеклеток для концентрирования желтка, который в нормальных яйцеклетках мешает визуализации мужского пронуклеуса с помощью секционного микроскопа.
5. Микроинъекция ДНК в мужской пронуклеус.
6. Развитие эмбрионов in vitro.
7. Нехирургическая имплантация одного эмбриона реципиентной самке во время течки.
8. Скрининг ДНК потомков на наличие трансгена.
В тестовых экспериментах из пула в 2470 ооцитов были получены два трансгенных теленка. Этот результат указывает на результативность описанного подхода, но также и на его низкую эффективность. Исследования в этой области продолжаются, и есть надежда на усовершенствование методики трансгеноза. Например, скоро появится возможность отбирать небольшое число клеток у развивающегося эмбриона in vitro и тестировать их на наличие трансгена; такая потеря клеток эмбрионом не помешает его нормальному развитию. Этот тест позволит имплантировать только эмбрионы, несущие трансген.
Одна из целей трансгеноза крупного рогатого скота — изменение содержания в молоке различных компонентов. Так, количество сыра, получаемого из молока, прямо пропорционально содержанию в нем к-казеина, поэтому весьма
434 ГЛАВА 19
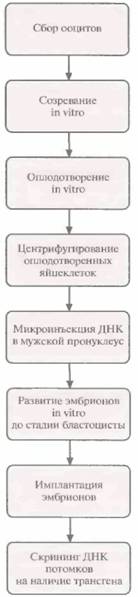 |
| Рис. 19.13. Получение трансгенных коров. |
перспективным представляется увеличение количества синтезируемого к-казеина с помощью гиперэкспрессии трансгена этого белка. Далее, если обеспечить экспрессию гена лактазы в клетках молочной железы, то можно будет получать молоко, не содержащее лактозы. Такое молоко незаменимо для многих людей, не переносящих лактозу; после приема молока или молочных продуктов у них возникает серьезное желудочное расстройство. Трансгеноз крупного рогатого скота — это весьма перспективный подход, но создание большого числа трансгенных животных потребует времени, ведь для того чтобы вырастить половозрелое животное из оплодотворенной яйцеклетки, нужно примерно 2 года.
Весьма актуально создание домашних животных с наследственной устойчивостью к бактериальным и вирусным инфекциям и паразитарным инвазиям. Известно о существовании пород с наследственной устойчивостью к бактериальным инфекционным заболеваниям — маститу (коровы), дизентерии (новорожденные поросята), холере (домашняя птица). Если в основе устойчивости к каждой из этих болезней лежит один ген, можно попытаться создать несущих его трансгенных животных. В настоящее время для борьбы с инфекционными заболеваниями домашних животных используют прививки и лекарственные препараты. Заболевших животных изолируют, за здоровыми ведут тщательное наблюдение. Стоимость всех этих мероприятий может достигать 20% обшей стоимости конечной продукции.
Для выведения линий животных, устойчивых к возбудителям инфекций, можно использовать другой подход, заключающийся в создании путем трансгеноза наследуемых иммунологических механизмов. С этой точки зрения рассматривают самые разные гены, ответственные за работу иммунной системы: гены основного комплекса гистосовместимости, Т-клеточных рецепторов, лимфокинов. Наиболее обнадеживающими на настоящее время являются предварительные результаты, полученные при введении мышам, кроликам и свиньям генов, кодирующих Н- и L-цепи какого-либо моно-клонального антитела. Идея этого подхода заключается в том, чтобы снабдить трансгенное животное наследуемым механизмом защиты, позволяющим обойтись без иммунизации с помощью прививок.
Введение в организм реципиента генов антител, которые связываются со специфическими антигенами, было названо иммунизацией in vivo. Для этого гены Н- и L-цепей иммуноглобулинов моноклонального мыши-
Трансгенные животные 435
ного антитела к антителу, связывающемуся с 4-гидрокси-3-нитрофенилацетатом, вводили с помощью микроинъекций в оплодотворенные яйцеклетки мыши, кролика и свиньи. Во всех случаях в сыворотке трансгенных животных обнаруживалась соответствующая активность моноклонального антитела. Однако количество моноклональных антител, содержащих цепи H и L, было невелико. Чтобы установить, можно ли решить эту проблему, необходимо протестировать различные трансгенные конструкции.
Трансгенные овцы, козы и свиньи
Опыты по трансгенозу в случае овец и коз в основном были направлены на превращение молочных желез этих животных в своеобразные биореакторы для получения белковых продуктов, использующихся в медицине. Несмотря на то что надои у овец и коз меньше, чем у коров, за год они дают сотни литров молока. С помощью метода, аналогичного используемому для создания трансгенных мышеи и трансгенных конструкций, содержащих гены человека под контролем промоторов, специфичных для молочных желез (табл. 19.2), были созданы трансгенные овца и коза, в молоко которых секретировались белки человека. Они были гликозилированы и обладали активностью, близкой к таковой соответствующих белков, получаемых от человека. Однако, для того чтобы убедиться в полной эквивалентности этих белков, нужны дополнительные исследования. Экспрессия трансгенов в клетках молочных желез овец и коз не оказывала никаких побочных действий ни на самок в период лактации, ни на вскармливаемое потомство. В отличие от этого при введении свиньям трансгена бычьего гормона роста под контролем промотора металлотионеина неблагоприятные эффекты наблюдались. Количество гормона у разных особей в группе трансгенных свиней различалось, однако в целом вся эта группа быстрее прибавляла в весе. К сожалению, этот положительный результат частично обесценивался различными патологиями: у животных отмечались язва желудка, почечная недостаточность, хромота, воспаление перикарда, уменьшение подвижности суставов, предрасположенность к пневмонии. Причины этих симптомов неизвестны. Возможно, они связаны с долговременным присутствием в организме избытка гормона роста. В этих экспериментах трансген синтезировался более или менее непрерывно. Были созданы также трансгенные овцы с повышенной скоростью роста шерсти. Для этого кДНК овечьего инсулиноподобного фактора роста 1 была помещена под контроль мышиного промотора гена кератина с высоким содержанием серы, что обеспечивало гиперэкспрессию кДНК, При этом у трансгенных овец в отличие от свиней никаких нежелательных побочных эффектов не наблюдалось.
Положительные результаты были получены и в ходе экспериментов с трансгенными свиньями. Например, были созданы здоровые трансгенные свиньи, в геноме которых присутствовала следующая генетическая конструкция: регуляторная область гена ß-глобина человека, два гена 1-глобина человека и один ген ßА-глобина человека. В результате ее экспрессии в клетках крови свиней синтезировался человече-
| Таблица 19.2. Трансгенные конструкции, содержащие гены человека под контролем промоторов, специфичных для молочных желез, и реципиентные организмы | ||
| Трансген | Промотор | Реципиент |
| Ген активатора плазм и ногена длительного действия | Ген белка сыворотки | Коза |
| Ген α1 -антитрипсина | Ген ß-лактоглобулина | Овца |
| Ген фактора IX системы свертываемости крови | Ген ß-лактоглобулина | Овца |
| Ген растворимого белка CD4 | Ген белка сыворотки | Мышь |
| Ген лактоферрина | Ген αS1-казеина | Корова |
| Ген урокиназы | Ген αS1- казеина | Мышь |
| Ген CFTR | Ген ß-казеина | Мышь |
| Ген интерлейкина-2 | Ген β- казеина | Кролик |
436 ГЛАВА 19
скин гемоглобин, при этом в результате замены человеческого промотора гена ß-глобина свиным человеческий гемоглобин синтезировался в значительно большем количестве. Человеческий гемоглобин, продуцируемый трансгенными свиньями, обладал такими же химическими свойствами, что и природный человеческий. Его можно было очистить от гемоглобина свиней обычной хроматографией.
Эти результаты указывают на принципиальную возможность замены цельной крови, используемой при трансфузии, человеческим гемоглобином, полученным методом трансгеноза. Однако изолированный гемоглобин переносит кислород не так эффективно, как гемоглобин в составе эритроцитов. Более того, он быстро разрушается в организме животного, которому был введен, а продукты его распада токсичны для почек. Таким образом, получение заменителя человеческой крови с помощью трансгеноза -это дело далекого будущего.
В последнее время большое внимание уделяется вопросу об использовании органов животных для трансплантации человеку. Основная проблема межвидовой трансплантации — это гиперострое отторжение. Гиперострое отторжение влечет за собой связывание антител организма-хозяина с углеводной антигенной детерминантой на поверхности клеток пересаженного органа. Связавшиеся антитела вызывают острую воспалительную реакцию (активацию каскада комплемента), происходит массовая гибель несущих антитела клеток и быстрая потеря пересаженного органа.
В естественных условиях воспалительная реакция блокируется особыми белками на поверхности клеток, выстилающих стенки кровеносных сосудов. Эти белки ингибиторы комплемента видоспецифичны. Было высказано предположение, что если бы животное-донор несло один или несколько генов человеческого белка, ингибирующего комплемент, то пересаженный орган был бы защищен от первичной воспалительной реакции. С этой целью были получены трансгенные свиньи, несущие различные человеческие гены ингибитора комплемента. Клетки одного из этих животных оказались совершенно нечувствительными к компонентам системы каскада комплемента. Предварительные эксперименты по пересадке органов трансгенных свиней приматам показали, что ткани пересаженного органа повреждаются слабее, а сам орган не отторгается немного дольше. Возможно, трансгенные свиньи, несущие человеческий ген ингибитора комплемента и лишенные основного поверхностного белка клеток свиней, который вызывает острейшее отторжение, будут служить источником органов для трансплантации человеку.
Трансгенные птицы
Микроинъекция ДНК в оплодотворенные яйцеклетки птиц с целью получения трансгенных линий — непростая процедура. Это связано с некоторыми особенностями воспроизводства и развития птиц. Так, при оплодотворении у птиц в яйцеклетку могут проникнуть сразу несколько сперматозоидов, а не один, как это обычно бывает у млекопитающих, и идентифицировать тот мужской пронуклеус, который соединится с женским, становится невозможно. Метод микроинъекции ДНК в цитоплазму тоже не подходит, поскольку в этом случае ДНК не интегрируется в геном оплодотворенной яйцеклетки. Наконец, даже если удастся осуществить микроинъекцию ДНК в ядро, дальнейшие операции будет трудно осуществить, поскольку у птиц яйцеклетка после оплодотворения достаточно быстро обволакивается прочной мембраной, покрывается слоем альбумина и внутренней и наружной известковыми оболочками.
Однако трансген можно вводить в область желтка (зародышевый диск), который содержит и женский, и мужской пронуклеусы и образуется раньше, чем скорлупа. После введения ДНК каждую яйцеклетку культивируют in vitro, и когда образуется зародыш, его помешают в суррогатное яйцо, чтобы имитировать вылупление. При помощи такой стратегии была получена одна линия трансгенных цыплят. Однако в настоящее время этот метод неэффективен и технически трудновыполним в обычных условиях.
К тому времени, когда наружная известковая оболочка яйцеклетки птиц затвердевает, зародыш, находящийся на стадии бластодермы, состоит из двух слоев по 40 000 и 80 000 клеток. Проведены эксперименты по инокуляции тако-
Трансгенные животные 437
| Рис. 19.14. Получение трансгенных цыплят трансфекцией изолированных клеток бластодермы. Выделенные клетки трансфицируют трансгеном с помощью липосом и вводят в подзародышевую область облученной бластодермы реципиента. Часть полученных потомков являются химерами, а некоторые из них, несущие трансген в клетках зародышевой линии, при скрещивании могут дать начало трансгенным линиям. | 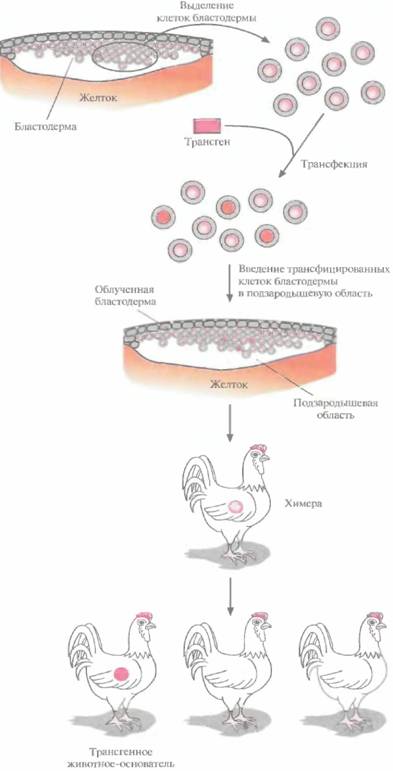 |
438 ГЛАВА 19
го зародыша ретровирусными векторами с нарушенной репликацией, несущими бактериальные маркерные гены. В результате были получены трансгенные цыплята и обыкновенные перепела, несущие чужеродные гены в клетках зародышевой линии. Обычно такие птицы не продуцируют свободных вирусных частиц, и тем не менее применение ретровирусных векторов в качестве «поставщиков» чужеродных генов животным, которые затем могут использоваться в пищу, неизбежно вызывает вопросы относительно безопасности такого подхода. Кроме того, размер трансгена, который может быть введен в организм реципиента в составе ретровирусного вектора, не превышает 8 т, п. н., а в некоторых случаях интеграция в исходный сайт нестабильна. Все это заставило исследователей искать альтернативные способы трансгеноза.
Никаких специфичных для птиц ES-клеток не обнаружено, поэтому подход, основанный на их использовании, для птиц неприменим. Более перспективным представляется метод с использованием рекомбинантных эмбриональных клеток. Он состоит в следующем. Выделяют клетки бластодермы из куриного эмбриона, трансфицируют их с помощью катионных липидов (липосом), связанных с трансгенной ДНК (липосомная трансфекция), и повторно вводят в подзародышевую область свежеотложенных яиц (рис. 19,14). Часть потомков будет нести в каком-то небольшом количестве клетки донора: таких животных называют химерами. У некоторых химер клетки, произошедшие от трансфицированных клеток, могут образовывать линии зародышевых клеток, и после нескольких раундов скрещиваний таких химер можно получить линии трансгенных животных. Чтобы увеличить вероятность создания химер, несущих чужеродные гены в клетках зародышевой линии, число донорских клеток в химерах можно увеличить облучением эмбрионов реципиента перед введением в них трансфицированных клеток (540—660 рад в течение 1 ч). Под действием облучения некоторые (но не все) клетки бластодермы погибнут, и соотношение между трансфицированными клетками и клетками реципиента увеличится в пользу первых. По-видимому, таким образом можно получать трансгенных цыплят, хотя и с малой эффективностью.
Трансгенных цыплят можно использовать для улучшения генотипа уже существующих пород — для придания им (in vivo) устойчивости к вирусным инфекциям и заболеваниям, вызываемым кокцидиями, повышения эффективности усвоения пищи, снижения уровня жира и холе-стерола в яйцах, повышения качества мяса. Было предложено также использовать яйцо с его высоким содержанием белка в качестве источника белковых продуктов, использующихся в фармацевтической промышленности. Экспрессия трансгена в клетках репродуктивного пути курицы, где обычно секретируется большое количество овальбумина, может способствовать накоплению соответствующего белкового продукта в яйце, откуда его можно затем выделить.
Трансгенные рыбы
По мере истощения природных рыбных запасов все большую роль будет приобретать разведение рыбы в искусственных условиях. Основная цель исследований в этой области — создание рекомбинантных рыб путем трансгеноза. До настоящего времени трансгены вводили микроинъекцией ДНК или электропорацией оплодотворенных яйцеклеток различных видов рыб — карпа, зубатки, форели, лосося и т. д. Поскольку у рыб пронуклеус в оплодотворенной яйцеклетке плохо различим в обычный микроскоп, линеаризованную трансгенную ДНК вводят в цитоплазму оплодотворенных яйцеклеток или клеток эмбрионов, достигших стадии четырех бластомеров. Эмбриогенез у рыб протекает в водной среде вне организма, поэтому в имплантации нет необходимости. Все дальнейшие процессы могут протекать в резервуарах с регулируемой температурой. Выживаемость эмбрионов рыб после микроинъекций довольно высока, от 35 до 80%, а доля трансгенных потомков колеблется от 10 до 70%. Трансген можно обнаружить с помощью ПЦР с использованием либо препаратов эритроцитов зародышей, либо суммарной ДНК. Скрещивая трансгенных рыб, можно вывести трансгенные линии.
Большинство первых исследований в этой области было направлено на исследование влияния трансгена гормона роста на скорость роста. В одном из экспериментов в яйцеклетки ат-
Трансгенные животные 439
лантического лосося был введен трансген, состоящий из следующих элементов: промотора гена антифризного белка американской бельдюги, кДНК гормона роста лосося, сигналов терминации/полиаденилирования 3’-конца гена антифризного белка американской бельдюги. Как правило, трансгенные лососи были крупнее и быстрее прибавляли в весе, чем контрольные нетрансформированные особи. В этом случае была выбрана система экспрессии с ускоренной транскрипцией гена гормона роста в холодной воде и пригодная для «всех рыб», что позволяло избежать биологической несовместимости, которая могла бы возникнуть, если бы ген гормона роста происходил не из рыб. Годовалые трансгенные особи, полученные в результате введения в яйцеклетки нерки генетической конструкции гормона роста, подходящей для «всех лососей», весили примерно в 11 раз больше, чем нетрансгенные. Физиологическая активность линий таких трансгенных лососей в естественных условиях вызывает значительный интерес. Предполагается, что в будущем гены устойчивости к болезням и стрессовым воздействием, а также гены, обуславливающие другие биологические особенности, будут введены как рыбам умеренных широт, так и тропическим рыбам.
ЗАКЛЮЧЕНИЕ
Генетическая модификация животных при помощи технологии рекомбинантных ДНК (трансгеноза) основана на введении клонированного гена(ов) в геном клетки, которая могла бы дать начало клеткам зародышевой линии. Скрещивая трансгенных потомков, появившихся в результате такой операции, можно получить гомозиготные линии трансгенных животных. Большинство исследований в этой области проводилось на мышах. Обычно для этого вводили клонированный ген в оплодотворенную яйцеклетку мыши с помощью микроинъекции, имплантировали ее в реципиентную самку и проверяли потомство на наличие введенного гена. Чужеродный ген можно вводить в оплодотворенную яйцеклетку мыши и с помощью ретровирусного вектора. Альтернативный подход заключается в выделении мышиных эмбриональных
стволовых клеток и трансфекции их клонированным геном. При этом вводимая конструкция должна интегрироваться в геном стволовых клеток. Клетки, несущие ген-мишень в определенном хромосомном сайте, отбирают и культивируют, а затем вводят их в мышиные эмбрионы на ранних стадиях развития. Мышиные эмбриональные стволовые клетки плюрипотентны (тотипотентны), т. е. могут дать начало клеткам любого типа, в том числе и клеткам зародышевой линии. Для трансгеноза используют также искусственные дрожжевые хромосомы (YAC), несущие множество генов. Таким образом были получены мыши, синтезирующие только человеческие антитела. Их использовали в качестве модельных систем для изучения генетических болезней человека (например, болезни Альцгеймера).
С помощью аналогичных экспериментальных подходов были получены трансгенные коровы, овцы, свиньи, птицы и рыбы. Есть надежда, что трансгеноз позволит улучшать генотип существующих пород домашнего скота и выводить породы животных с новыми признаками. Кроме того, возможно, таких домашних животных, как коровы, овцы и козы, удастся использовать в качестве своеобразных «биологических фабрик» для получения продуктов клонированных генов, секретируемых в молоко.
ЛИТЕРАТУРА
Brinster R. L., K. M. Allen, R. R. Behringer, R. E. Gelinas, R. D. Palmiter. 1988. Introns increase transcript!onal efficiency in transgenic mice. Proc. Natl. Acad. Sei. USA 85: 836-840.
Citron M., D. Westaway, W. Xia, G. Carlson, T. Diehl, G. Levesque, K. Johnson-Wnod, M. Lee, P. Seubert, A. Davis, D. Kholndenko, R. Motter, R. Sherrington, B. Perry, H. Yao, R. Strome, L Liebcrburg, J. Rommens, S- Kim, D. Schenk, P. Fräser, P. St. George Hyslop, D. J. Selkoe. 1997. Mutant presenilins of Alzheimer's disease increase production of 42-residue amyloid ß-protein in both transfected cells and transgenic mice. Nal. Med. 3: 67—72.
Clark A. J. 1996. Genetic modification of milk proteins. Am. J. Clin. Nittr. 63: 633S-638S.
440 ГЛАВА 19
Damak S., H. Su, N. P. Jay, D. W. Bullock. 1996.
Improved wool production in transgenic sheep
expressing insulin-like growth factor 1.
Bio/Technology 14: 185-1S8. Devlin R. H., T. V. Yesaki, C. A. Blagl,
E. M. Donaldson, P. Swanson, W.-K. Chan.
1994. Extraordinary salmon growth. Nature 371: 209-210.
Diamond L. E., K. R. McCurry, M. J. Martin, S. B. McClellan, E. R. Oldham, J. L. Platt, J. S. Logan. 1996. Characterization of transgenic pigs expressing functionally active human CD59 on cardiac endothelium. Transplantation 61: 1241-1249.
DiTuffio P., S. H. Cheng, J. Marshall, R. J. Gregory, K. Ebert, H. M. Meade, A. E. Smith. 1992. Production of cystic fibrosis transmembrane conductance regulator in the milk of transgenic mice. Bio/Technology 10: 74-77.
Fishwild D. M., S. L. O'Doimcll, T. Bengoechea, D. V. Hudson, F. Harding, S. L·. Bernhard, D. Jones, R. M. Kay, K. M. Higgins, S. R. Schramm, N. Lunbcrg. 1996. Iligh-avidity human IgGK monoclonal antibodies from a novel strain of minilocus transgenic mice. Nat. Biotechnol. 14: 845—851.
Fodor W. L., B. L. Williams, L. A. Malis, Л. A. Madri, S. A. Rollins, J. W. Knight, W. Velander, S. P. Squinto. 1994. Expression of a functional human complement inhibitor in a transgenic pig as a model for the prevention of xenogeneic hyper-acute organ rejection. Proc. Natl Acad. Sei. USA 91:11153-11157.
Games D., D. Adams, R. B. Alessandrini, R. Barbour, P. Berthelette, C. Blackwell, T. Carr, J. Clemens, T. Donaldson, F. Gillespic, T. Guido, S. HaKopian, K. Johnson-Wood, K. Khan, M. Lee, P. Leibowit/, I. Lieberburg, S. Little, £. Masliah, L. McConlogue, M. Montoya-Zavala, L. Muckc, L. Paganini, E. Pcnniinan, M. Power, D. Schenk, P. Seubert, B. Snyder, E. Soriana, H. Tan, J. Vitale, S. Wadsworth, B. Wotarin, J. Zhao.
1995. Alzheimer-type neuropathology in transgenic mice overexpressing V717F ß-amyloid precursor protein. Nature 373: 523—527.
Gong /., C. T,.. Hew. 1995. Transgenic fish in aqua-culture and developmental biology. Curr. Top. Dev. Biol. 30: 177-214.
Hsiao K., P. Chapman, S. Nilsen, C. Eckman, Y. Harigaya, S. Younkin, F. Yang, G. Cole. 1996.
Correlative memory deficits, Aß elevation, and amyloid plaques in transgenic mice. Science 274: 99-102.
Humphries M. M,, D. Rancourt, G. J. Farrar, P. Kenna, M. Hazel, R. A. Bush, P. A. Sieving,
D. M. Shells, N. McNally, P. Creighton, A. Erven, A. bofos, K. Gulya, M. R. Capecchi, P. Humphries. 1997. Retinopathy induced in mice by targeted disruption of the rhodopsin gene. Nat. Genet. 15: 216-219.
Janne J., J.-H. Hyttinen, T. Peura, M. Tolvanen, L. Alhonen, R. Sinervirta, M. Halmekyto. 1994. Transgenic bioreactors. Int. J. Biochem. 26: 859-870.
Johnson-Wood K., M. Lee, R. Motter, K. Hu, G. Gordon, R. Barbour, K. Khan, M. Gordon, H. Tan, D. Games, I. TJebcrburg, D. Schenk, P. Seubert, L. McConlogue. 1997. Amyloid precursor protein processing and Aß42 deposition in άtransgenic mouse model of Alzheimer disease. Proc. Natl. Acad. Sei. USA 94: 1550-1555.
Krimpenfort P., A. Rademakers, W. Eyestone, A. van der Schans, S. van den Brock, P. Kooiman,
E. Kootwijk, G. Platcnburg, F. Pieper, R. Strykcr, H. de Boer. 1991. Generation of transgenic dairy cattle using "in vitro" embryo production. Bio/Technology 9: 844—847.
Masliah E., A. Sisk, M. Mallory, L. Mucke, D. Schenk, D. Games. 1996. Comparison of neu-rodegenerative pathology in transgenic mice overexpressing V7I7F ß-amyloid precursor protein and Alzheimer's discease. J. Neurasci. 16: 5795-5811.
McCurry K. R., D. L. Kooyman, C. G. Atvarado, A. H. Cotterell, M. J. Martin, J. S. Logan, J. L. Platt. 1995. Human complement regulatory proteins protect swineto-primate cardiac xenografts from humoral injury. Nat. Med. 1:423-427.
Mendez M. J., L. L. Green, J. R. F. Corvalan, X.-C. Jia, C. E. Maynard-Currie, X. Yang, M. L. GaUo, D. M. Louie, D. V. Lee, K. L. Erickson, J. Luna, C. M.-N. Roy, H. Abderrabim,
F. Kirschenbaum, M. Noguchi, D. M. Smith, A. Fukushiina, J. F. Hales, M. H. Finer, C. G. Davis, K. M. Zsebo, A. Jakobovits. 1997, Functional transplant of megabase human immunoglobulin loci recapitulates human antibody response in mice. Natl. Genet. 15: 146-156.
Трансгенные животные 441
Oster-Granite M. L., D. L. McPhie, J. Greenan, R. L. Neve. 1996. Age-dependent neuronal and synaptic degeneration of mice transgenic for the С terminus of the amyloid precursor protein. J. Neurosci. 16: 6732-6741.
Petite J. N., M. E. Clark, G. Liu, A. M. Verrinder Gibbins, R. J. Etches. 1990. Production of somatic and germline chimeras in the chicken by transfer of early blastodermal cells. Development 108: 185-189.
Pursel V. G., C. A. Pinkert, K. F. Milter, D. J. Bolt, R. G. Campbell, R. D. Palmiter, R. L. Brinster, R. E. Hammer. 1989. Genetic engineering of livestock. Science 244: 1281-1288.
Sang H. 1994. Transgenic chickens—methods and potential applications. Trends Biotechnol. 12: 415-420.
Sharma A., M. J. Martin, J. F. Okabe, R. A. Truglio, N. K. Dhanjal, J. S. Logan, R. Kumar. 1994. An isologous porcine promoter permits high level expression of human hemoglobin in transgenic swine. Bio/Technology 12: 55—59.
Sims M., N. L. First. 1993. Production of calves by transfer of nuclei from cultured inner cell mass cells. Proc. Natl. Acad. Sei USA 90: 6143-6147.
Swanson M. E., M. J. Martin, K. O'Donn, K. Hoover, W. Lago, V. Huntress, С. Т. Parsons, C. A. Pinkert, S. Pilder, J. S. Logan. 1992. Production of functional human hemoglobin in transgenic swine. Bio/Technology 10: 557—559.
Wcidle U. H., H. Lenz, G. Вгспк 1991. Genes encoding a mouse monoclonal antibody are
expressed in transgenic mice, rabbits, and pigs. GeneW: 185-191.
Wilmut L, A. E. Schnieke, J. McWhir, A. J. Kind, K. H. S. Campbell. 1997. Viable offspring derived from fetal and adult mammalian cells. Nature 385:810-813.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Как получают трансгенных мышей?
2. В чем состоит принцип позитивно-негативной селекции?
3. Что из себя представляют мыши с «нокаутированным» геном? Как и для чего получают таких мышей?
4. Каковы преимущества и недостатки трансгенных мышей как модельных систем для исследования болезней человека?
5. Что такое клонирование?
6. Расскажите, как с помощью трансгеноза можно получать моноклональные антитела человека,
7. Как молочная железа может быть использована в качестве «биореактора» для синтеза коммерческих продуктов.
8. Каким образом трансгеноз может облегчить трансплантацию органов?
9. Какие подходы используются для выведения транс генных цыплят?
10. Опишите способы улучшения пород рыб с помощью трансгеноза.
