Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
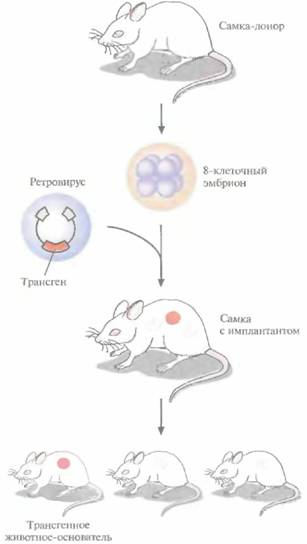
Трансгенные мыши: методологияТрансгенные технологии разрабатывались и совершенствовались на лабораторных мышах. С начала 1980-х гг. в различные линии мышей были введены сотни генов. Эти исследования в значительной мере способствовали установлению механизмов генной регуляции и развития опухолей, природы иммунологической специфичности, молекулярной генетики роста и развития, других фундаментальных биологических процессов. Трансгенные мыши сыграли свою роль в исследовании возможности крупномасштабного синтеза лекарственных веществ, а также в создании трансгенных линий, позволяющих моделировать различные генетические болезни человека. Введение чужеродной ДНК мышам можно осуществить разными методами: 1) с помощью ретровирусных векторов, инфицирующих клетки эмбриона на ранних стадиях развития перед имплантацией эмбриона в самку-реципиента; 2) микроинъекцией в увеличенное ядро спермия (мужской пронуклеус) оплодотворенной яйцеклетки; 3) введением генетически модифицированных эмбриональных стволовых клеток в предимплантированный эмбрион на ранних стадиях развития. Использование ретровирусных векторовПреимущество метода, основанного на использовании ретровирусных векторов (рис. 19.1), перед другими методами трансгеноза состоит в его эффективности. Однако размер вставки в этом случае ограничивается 8 т. п. н., вследствие чего транс ген может оказаться лишенным прилегающих регуляторных последовательностей, необходимых для его экспрессии. Использование ретровирусных векторов имеет и еще один большой недостаток. Хотя эти векторы создаются так, чтобы они были дефектными по репликации, геном штамма ретровируса (вируса-помощника), который необходим для получения большого количества векторной ДНК, может попасть в то же ядро, что и трансген. Несмотря на все принимаемые меры, ретровирусы-помощники могут реплицироваться в организме трансгенного животного, что совершенно недопустимо, если этих животных предполагается использовать в пищу или как инструмент для получения коммерческого продукта. И поскольку существуют альтернативные методы трансгеноза, ретровирусные векторы редко используются для создания трансгенных животных, имеющих коммерческую ценность. 420 ГЛАВА 19
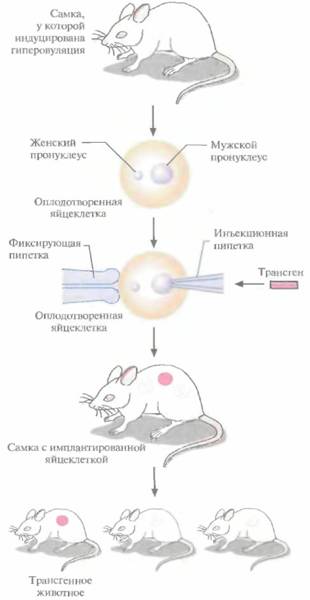
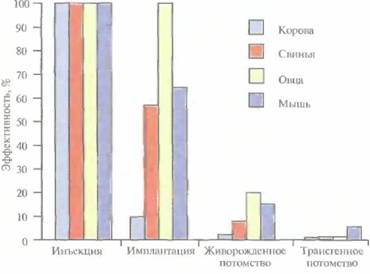
Метод микроинъекции ДНКВ настоящее время для создания трансгенных мышей чаще всего используют метод микроинъекций ДНК. Он заключается в следующем (рис. 19.2). Трансгенные животные 421 1. Увеличение числа яйцеклеток, в которых будет инъецирована чужеродная ДНК, путем стимуляции гиперовуляции у самок-доноров. Сначала самкам вводят сыворотку беременной кобылы, а спустя примерно 48 ч -хорионичеcкий гонадотропин человека. В результате гиперовуляции образуется примерно 35 яйцеклеток вместо обычных 5—10. 2. Скрещивание с самцами самок с гиперовуляцией и их умерщвление. Вымывание из яйцеводов оплодотворенных яйцеклеток. 3. Микроинъекция ДНК в оплодотворенные яйцеклетки — как правило, сразу после выделения. Часто вводимая трансгенная конструкция находится в линейной форме и не содержит прока-риотических векторных последовательностей. У млекопитающих после проникновения сперматозоида в яйцеклетку ядро спермия (мужской пронуклеус) и ядро яйцеклетки существуют раздельно. После того как последнее заканчивает митотическое деление и становится женским пронуклеусом, может произойти слияние ядер (кариогамия). Мужской пронуклеус обычно гораздо больше женского, его легко локализовать с помощью секционного микроскопа и ввести в него чужеродную ДНК. При этом яйцеклетку на время проведения микроинъекции можно перемещать, ориентировать нужным образом и фиксировать. Опытный экспериментатор за день может инокулировать несколько сотен яйцеклеток. После введения ДНК от 25 до 40 яйцеклеток имплантируют микрохирургическим путем в «суррогатную» мать, у которой вызывают ложную беременность скрещиванием с вазэктомированным самцом. У мышей спаривание — это единственный известный способ подготовки матки к имплантации. Поскольку вазэктомированный самец сперматозоидов не продуцирует, ни одна из яйцеклеток «суррогатной» матери не оплодотворяется. Эмбрионы развиваются только из введенных яйцеклеток, и мышата рождаются спустя примерно 3 нед после имплантации. Для идентификации трансгенных животных выделяют ДНК из маленького кусочка хвоста и тестируют ее на наличие трансгена с помощью блот-гибридизации по Саузерну методом полимеразной цепной реакции (ПЦР). Чтобы определить, находится ли трансген в клетках зародышевой линии животного, трансгенную мышь скрещивают с другой мышью. Далее можно проводить скрещивание потомков для получения чистых (гомозиготных) трансгенных линий. Описанный подход кажется на первый взгляд относительно простым, однако он требует четкой координации разных этапов. Даже высококвалифицированному специалисту удается получить жизнеспособных трансгенных животных в лучшем случае лишь из 5% инокулированных яйцеклеток (рис. 19.3). Ни один из этапов эксперимента не эффективен на все 100%, поэтому для микроинъекций необходимо использовать боль-
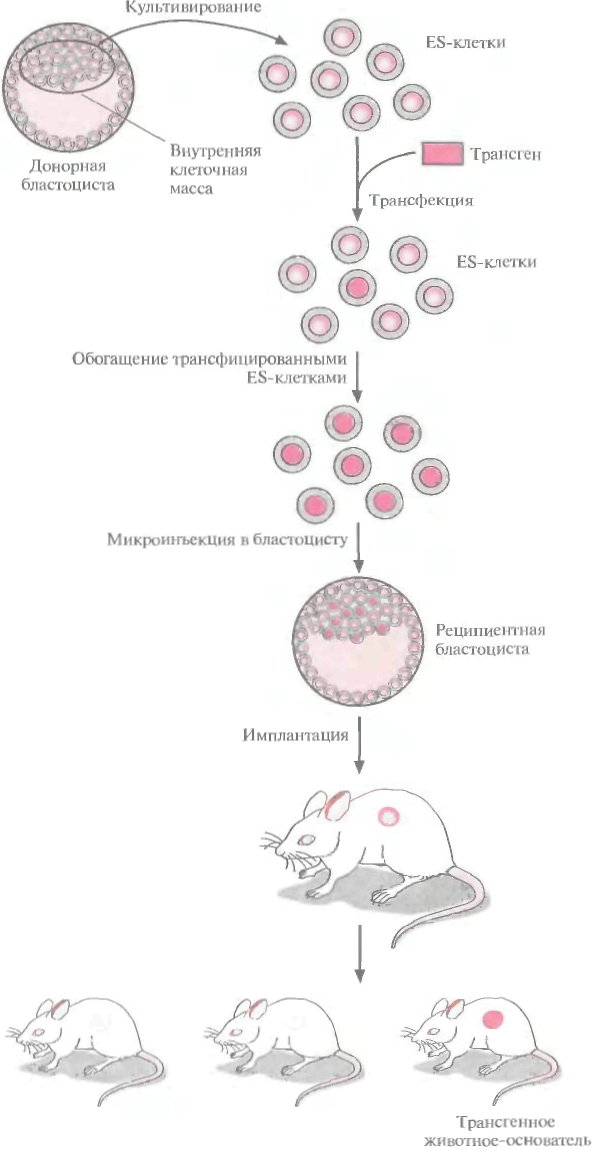
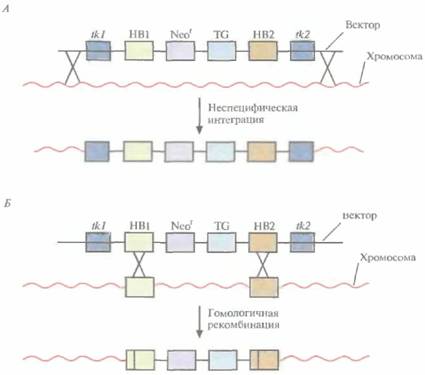
422 ГЛАВА 19 шое число оплодотворенных яйцеклеток. Например, при получении трансгенных мышей после инъекции ДНК выживают только 66% оплодотворенных яйцеклеток; мышата развиваются примерно из 25% имплантированных яйцеклеток, причем трансгенными из них оказываются лишь 25%. Таким образом, из 1000 имплантированных оплодотворенных яйцеклеток развивается от 30 до 50 трансгенных мышат. Кроме того, введенная ДНК может интегрировать в любое место в геноме, и зачастую множество ее копий включаются в один сайт. И наконец, не все трансгенные мышата будут обладать нужными свойствами. В организме некоторых особей трансген может не экспрессироваться из-за неподходящего окружения сайта интеграции, а в организме других число копий чужеродного гена может оказаться слишком большим, что может привести к гиперпродукции белка и нарушению нормальных физиологических процессов. И все же, несмотря на все это, метод микроинъекций используют для получения линий мышей, несущих функциональные трансгены, довольно часто. Использование модифицированных эмбриональных стволовых клетокКлетки, выделенные из мышиных эмбрионов на стадии бластоцисты, могут пролиферировать в культуре, сохраняя способность к дифференцировке в любые типы клеток, в том числе и в клетки зародышевой линии, при введении в другой эмбрион на стадии бластоцисты. Такие клетки называются плюрипотентными эмбриональными стволовыми клетками (ES). ES-клет-ки в культуре легко модифицировать методами генной инженерии без нарушения их плюрипотентности. Например, в определенный сайт несущественного гена в их геноме можно встроить функциональный трансген. Затем можно отобрать измененные клетки, культивировать их и использовать для получения трансгенных животных (рис. 19.4). Это позволяет избежать случайного встраивания, характерного для метода микроинъекций и ретровирусных векторных систем. При трансфекции ES-клеток в культуре вектором, предназначенным для интеграции в специфический хромосомный сайт, в некоторых клетках ДНК встраивается случайным образом, в других встраивание происходит в нужный сайт, в большинстве же ES-клеток интеграции вообще не происходит. Для увеличения числа клеток первого типа используют так называемую позитивно-негативную селекцию. Эта стратегия состоит в позитивной селекции клеток, несущих векторную ДНК, встроившуюся в нужный сайт, и негативной селекции клеток с векторной ДНК, интегрировавшей в случайный сайт. Сайт-мишень должен находиться в такой области геномной ДНК, которая не кодирует важных белков, чтобы интеграция чужеродной ДНК не повлияла на процессы развития или клеточные функции. Кроме того, существенно, чтобы встраивание трансгена не блокировало трансляцию соответствующего участка генома. Поиск подобных сайтов ведется непрерывно. Вектор для позитивно-негативной селекции обычно содержит следующие элементы: 1) два блока последовательностей (НВ1 и НВ2), гомологичных отдельным участкам сайта-мишени; 2) трансген (TG), кодирующий новую функцию реципиента; 3) последовательность, кодирующую устойчивость к соединению G-418 (Neor); 4) два разных гена тимидинкиназы (tkl и tk2) вируса простого герпеса типов 1 и 2 (HSV-rit/ и HSV-Î&2) (рис. 19.5, А). Ключевым для позитивно-негативной селекции является взаимное расположение этих элементов. Трансген и ген устойчивости к G-418 (Neor) должны находиться между двумя участками ДНК, гомологичными сайту-мишени, а гены HSV-tk1 и HSV-tk2 — по бокам этой конструкции. Если встраивание происходит в случайный сайт (не в НВ1 и НВ2), то с высокой вероятностью вместе с другими последовательностями интегрируют один или оба гена HSV-/& (рис. 19.5, А). Напротив, если интеграция происходит в результате гомологичной рекомбинации путем двойного кроссинговера в нужный сайт, то в геном встроятся только трансген и ген Neor, а гены HSV-/& — нет (рис. [9.5, 5). При выращивании трансфицирован-ных клеток в присутствии G-418 клетки, не несущие ген Neor, расти не будут. Выживут только клетки, в которых произошла интеграция -иными словами, осуществляется позитивная селекция. Если одновременно с G-418 в среду Трансгенные животные 423
424 ГЛАВА 19
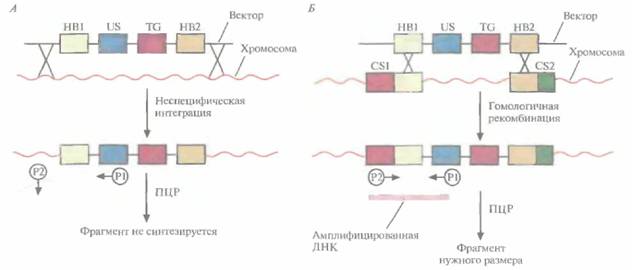
добавить ганцикловир, то рост клеток, синтезирующих тимидинкиназу, будет подавлен, поскольку этот фермент катализирует превращение ганцикловира в токсичное соединение, летальное для клетки, т. е. произойдет негативная селекция. Клетки, прошедшие через такое двойное сито, скорее всего будут содержать последовательность, встроившуюся в нужный сайт. Хоть этот метод не застрахован от ошибок, он позволяет обогатить клеточную популяцию клетками, несущими трансген в специфичном хромосомном сайте. Более простой способ идентификации ES-клеток, несущих трансген в нужном сайте, основан на использовании ПЦР. В этом случае ДНК-вектор содержит два участка, гомологичных сайту-мишени, по одному со стороны трансгена и со стороны клонированной бактериальной или синтетической (уникальной) последовательности, отсутствующей в геноме мыши (рис. 19.6). После трансфекции ES-клеток этим вектором проводят скрининг трансфицированных клеток методом ПЦР. Один из ПЦР-праймеров (Р1) комплементарен участку клонированной бактериальной или синтетической (уникальной) нуклеотидной последовательности интегрировавшего вектора, а второй (Р2) — участку хромосомной ДНК, прилегающему к одному из гомологичных участков ДНК. При встраивании последовательности-мишени в случайный сайт Трансгенные животные 425
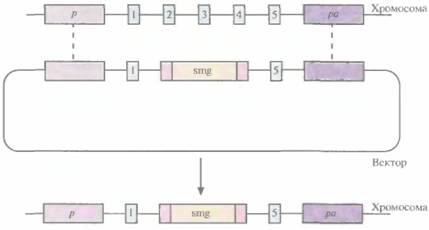
ожидаемый продукт амплификации образовываться не будет (рис. 19.6, А), а при сайт-специфической интеграции в результате ПЦР-амплификации образуется фрагмент ДНК известного размера (рис. 19.6, Б). Таким образом можно идентифицировать пулы ES-клеток, содержащих трансген в нужном сайте, а пересевая клетки из этих пулов — получить клеточные линии с сайт-специфической вставкой. ES-клетки, в геном которых в нужном сайте встроен трансген, можно культивировать и ввести в эмбрион на стадии бластоцисты, а затем имплантировать такие эмбрионы в матку псевдобеременных «суррогатных» матерей. Мышата, у которых генетически модифицированные ES-клетки участвовали в образовании клеток зародышевой линии, могут дать начало трансгенным линиям. Для этого их нужно скрестить с особями той же линии, а затем скрестить их трансгенных потомков. В результате будут получены трансгенные мыши, гомозиготные по трансгену. В специфический хромосомный сайт ES-клеток можно не только встроить трансген, кодирующий какую-то новую функцию, но и направленно разрушить этот сайт интеграцией с его кодирующей областью специфической последовательности (обычно селективного маркерного гена) (рис. 19.7). Одна из задач направленного нарушения («нокаута») гена состоит в исследовании влияния этого процесса на развитие организма и протекающие в нем физиологические процессы. Кроме того, есть надежда, что трансгенных животных с нарушением в определенном гене можно использовать как модель для изучения болезней человека на молекулярном уровне. Например, направленный «нокаут» гена родопсина мыши приводит к инактивации палочек сетчатки, что имитирует такую болезнь человека, как пигментный ретинит. На мышах с «нокаутированным» геном родопсина можно изучать процесс дегенерации сетчатки, а также 426 ГЛАВА 19 терапевтический эффект лекарственных средств, замедляющих или вообще останавливающих генетически обусловленный патологический процесс. Уже создано более 250 линий мышей с «нокаутированными» генами, использующихся в качестве моделей для изучения различных заболеваний человека. В принципе подходы к созданию трансгенных животных с «улучшенными функциями» и с «потерей функций» сходны. К сожалению, плюрипотентные ES-клетки, аналогичные таковым у мышей, пока не обнаружены у крупного рогатого скота, овей, свиней и цыплят, но их поиск продолжается.
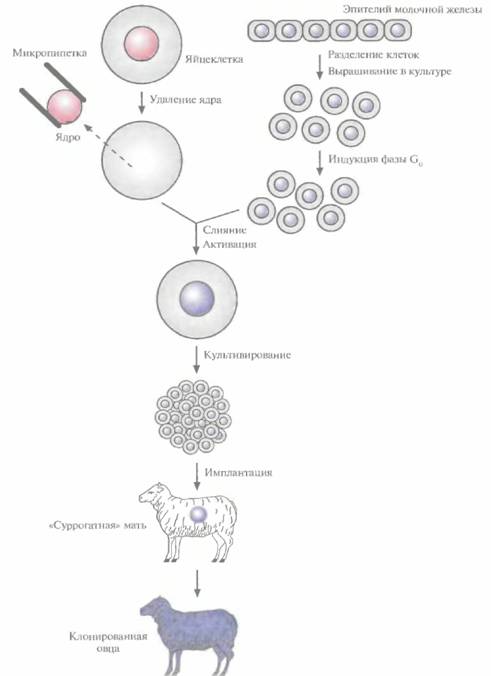
Клонирование с помощью переноса ядраПлюрипотентность можно выявить, если перенести ядро тестируемой клетки в яйцеклетку с удаленным ядром и затем исследовать способность последней к развитию и образованию жизнеспособного потомства. В нескольких лабораториях с переменным успехом исследовали плюрипотентность линий эмбриональных клеток, клеток плода и взрослой особи. Было показано, что ядра эмбриональных клеток способны -хотя и с низкой эффективностью — обеспечивать развитие. Например, с помощью переноса ядер эмбриональных клеток крупного рогатого скота, культивированных непродолжительное время, были получены жизнеспособные особи. Всем известная овца по имени Долли была клонирована с помощью переноса ядра клетки молочной железы (вымени) взрослого животного (рис. 19.8). Так впервые была доказана плюрипотентность ядра дифференцированной взрослой клетки. Впрочем, нельзя исключить, что на самом деле донорское ядро было взято из недифференцированной клетки, присутствовавшей в эпителии молочной железы организма-донора. Клонирование Долли из ядра дифференцированной клетки и трех других овец из ядер эмбриональных клеток удалось осуществить благодаря переносу ядер из клеток, находящихся в стадии покоя (G0), и. возможно, особенностям эмбриогенеза этого животного. Дело в том, что в течение первых трех делений зиготы овцы, занимающих несколько суток, происходит только репликация ДНК, ни один из генов не экспрессируется. Предполагается, что за это время введенная ДНК освобождается от специфичных для клетки регуляторных белков, а соответствующие гены эмбрионального развития связываются с инициаторными эмбриональными белковыми факторами из цитоплазмы яйцеклетки. Основная проблема, которую нужно решить для того, чтобы создание трансгенных животных с помощью метода переноса ядер стало реальным, — это сохранение плюрипотентности клеток в непрерывной культуре. Если это удастся, то генетическое изменение таких клеток и создание трансгенных организмов станет почти рутинной процедурой. Однако вследствие видовых различий во времени процесса деления Трансгенные животные 427
|